京尼平苷通过调节Perilipin-2 表达对肝细胞脂滴形成的影响
2022-07-22徐星科边阳萍赵婉均王秋惠殷菲
徐星科 边阳萍 赵婉均王秋惠殷菲*
(1.重庆理工大学药物化学与分子药理学重庆市重点实验室,重庆400054; 2.重庆理工大学药学与生物工程学院,重庆400054)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种肝脏脂质积累性疾病,主要表现为单纯的肝脏脂肪变性或非酒精性脂肪性肝炎[1]。研究表明,富含甘油三酯(triglycerides,TG)的脂滴异常累积是导致NAFLD 的重要机制[2]。
中药栀子是一种药食两用的植物,具有多种药理学作用[3-4]。近年来,国内外学者研究表明,栀子主要活性成分京尼平苷可降低血清中谷草转氨酶(aspartate aminotransferase,AST)和谷丙转氨酶(alanine aminotransferase,ALT)水平,影响脂质代谢,改善糖尿病小鼠肝组织炎症,并通过调节肠道菌群和炎症因子水平等改善NAFLD 症状,在保肝和肝病防治中具有广阔的应用前景[5-10]。
本课题组前期研究发现,京尼平苷是一种选择性胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)受体激动剂,可通过激活GLP-1 受体调节胰腺β 细胞对葡萄糖的吸收和代谢,影响胰岛素分泌[11-15]。目前尚不清楚京尼平苷是如何影响肝细胞脂滴的形成,因此,本研究分别在饱和脂肪酸油酸诱导的肝细胞和ob/ob 小鼠动物模型上考察京尼平苷对脂滴形成的影响。
1 材料
1.1 细胞与动物 人源HepG2 肝细胞,购自美国ATCC库,在含10%胎牛血清和1%青霉素/链霉素(P/S)的DMEM 培养基中,于37 ℃、5% CO2饱和湿度培养箱中培养。10 只雄性8~10 周龄C57BL/6 小鼠、20 只ob/ob 小鼠购自北京华阜康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2019-0008,饲养于重庆医科大学实验动物中心,在12 h/12 h 光照/黑暗、温度(25±2)℃,相对湿度50%~60%,自由进食饮水的环境中适应性喂养1 周后进行实验。动物实验经重庆理工大学实验动物伦理委员会审查通过[批准文号(2019)研审第(201918)号]。
1.2 试剂与药物 京尼平苷购自北京生物制品研究所有限责任公司。DMEM 细胞基础培养基、蛋白酶抑制剂、RIPA 裂解液购自美国Sigma 公司;胎牛血清购自美国HyClone 公司;胰酶、青霉、链霉素购自生工生物工程(上海)股份有限公司;Tris、Glycine 购自美国Genview 公司;Prililipin-2抗体购自美国Proteintech 公司;β-actin 抗体购自北京中杉金桥生物技术有限公司;ECL 发光底物购自美国Millipore 公司;BCA 蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;总RNA 提取试剂盒、PCR 相关试剂盒购自美国Bio-Rad公司。
2 方法
2.1 分组与给药 将20 只ob/ob 小鼠随机分为模型组和京尼平苷组,每组10只,10 只同月龄C57BL/6 小鼠作为对照组。京尼平苷组每天灌胃给予20 mg/kg 京尼平苷,模型组及对照组灌胃等体积蒸馏水,每天1次,连续4 周。
2.2 葡萄糖耐量检测 小鼠灌胃给药4 周后禁食14 h,记录体质量,每只按照2.5 g/kg 剂量灌胃给予葡萄糖,分别在给糖前(0 min)和给糖后15、30、60、120 min 尾静脉采血,血糖仪检测血糖水平,绘制糖耐量曲线,计算曲线下面积。
2.3 甘油三酯、总胆固醇水平检测 采集小鼠全血,静置0.5 h,4 ℃、3 000 r/min 离心15 min,吸取上层血清,采用Vitros-250 化学分析仪检测血清甘油三酯(TG)、总胆固醇(TC)水平。
2.4 HE 染色 将小鼠肝组织进行固定,经脱水、包埋、切片后用蒸馏水润洗1~2次,苏木素染色1~2 s,流水洗去苏木素染液,1%盐酸乙醇溶液分化3~5 s,流水清洗5~10 s,碱水返蓝20 s,流水清洗5~10 s,伊红染色30~60 s,蒸馏水漂洗3~5 s,经80%乙醇1~2 s、95%乙醇1~2 s、无水乙醇1~2 s、二甲苯(Ⅰ)2~3 s、二甲苯(Ⅱ)2~3 s 处理后中性树胶封片,在倒置显微镜下观察。
2.5 油红O 染色 将HepG2 细胞随机分为对照组、模型组、京尼平苷组,模型组、京尼平苷组用0.6 mmol/L 油酸进行诱导,对照组不作任何处理,处理8 h 后京尼平苷组加入10 μmol/L 该成分,对照组、模型组加入DMEM 培养基,处理24 h 后将各组细胞爬片用PBS 漂洗2次,4%多聚甲醛固定10 min,PBS 漂洗3次,60%异丙醇处理2 min,油红O 工作液染色20 min,弃去染色液,在倒置显微镜下观察。
2.6 RT-qPCR 法检测Perilipin-2 mRNA 表达 采用RNA 提取试剂盒提取各组细胞或肝组织总RNA,定量后取1 μg,iScript cDNA 合成试剂盒进行逆转录,反应条件为25 ℃5 min,42 ℃30 min,85 ℃5 min,4 ℃保持,反应结束后在-20 ℃下保存,SYBR PCR MASTER MIX 试剂盒检测Perilipin-2 mRNA 表达,反应条件为95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸60 s,共40 个循环,以βactin为参照基因,2-ΔΔCT法计算目的基因相对表达,并对数据进行归一化处理。β-actin正向引物序列为5′-GCAAGTGCTTCTAGGCGGAC-3′,反向引物序列为5′-AAGAAAGGGTGTAAAACGCAGC-3′;人Perilipin-2 基因正向引物序列为 5′-TTGCAGTTGCCAATACCTATGC-3′,反向引物序列为 5′-CCAGTCACAGTAGTCGTCACA-3′;小鼠Perilipin-2 基因正向引物序列为 5′-TGGTGAGTGGCCTGTGTTAG-3′,反向引物序列为5′-GCACACGCCTTGAGAGAAAC-3′。
2.7 Western blot 法检测目的蛋白表达 使用RIAP 裂解液裂解细胞或肝组织,离心收集上清,得总蛋白,BCA 法定量后取20~30 μg 上样,10%SDS-PAGE 电泳后转移到PVDF 膜上,加入5% 脱脂奶粉室温封闭2 h,加入一抗Perilipin-2(1∶2 000),在4 ℃下孵育过夜,TBST 漂洗3次,每次15 min,加入辣根过氧化物酶标记的二抗(1∶10 000)孵育1 h,TBST 漂洗3次,每次15 min,ECL 试剂显影、成像,采用Image J 软件分析条带灰度值,以GAPDH 为内参,计算Perilipin-2 蛋白相对表达。
2.8 统计学分析 通过Origin 8.0 软件进行处理,数据以()表示,2 组间比较采用Student’st检验,多项比较采用单因素方差分析和Bonferroni检验。P<0.05 为差异具有统计学意义。
3 结果
3.1 京尼平苷对ob/ob 小鼠体质量、葡萄糖耐量及血清TG、TC 水平的影响 如图1 所示,与对照组比较,模型组ob/ob 小鼠体质量增加(P<0.01),葡萄糖耐量降低(P<0.05),血清TG、TC 水平均升高(P<0.01);与模型组比较,京尼平苷组ob/ob 小鼠体质量减轻(P<0.05),葡萄糖耐量升高(P<0.05),血清TG、TC 水平均降低(P<0.01)。
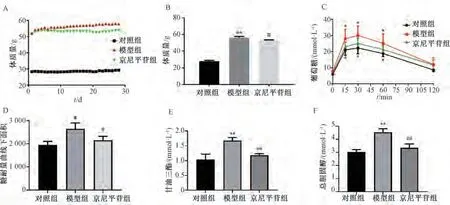
图1 京尼平苷对ob/ob 小鼠体质量、葡萄糖耐量及血清TG、TC 水平的影响(, n=10)Fig.1 Effects of geniposide on the body weight,glucose tolerance,and serum TG and TC levels in ob/ob mice(, n=10)
3.2 京尼平苷对ob/ob 小鼠肝组织中脂滴形成的影响 如图2 所示,与对照组比较,模型组ob/ob小鼠肝组织呈现大量的空泡,呈明显脂肪变性,脂滴数量和大小均增加;与模型组比较,京尼平苷组ob/ob 小鼠肝组织中的空泡减少,脂肪变性得到改善,组织更加致密,脂滴数量和大小均减少。

图2 京尼平苷对ob/ob 小鼠肝组织中脂滴的影响Fig.2 Effect of geniposide on lipid droplets in liver tissue of ob/ob mice
3.3 京尼平苷对ob/ob 小鼠肝组织中Perilipin-2表达的影响 如图3 所示,与对照组比较,模型组ob/ob 小鼠肝组织中Perilipin-2 mRNA 和蛋白表达均升高(P<0.01);与模型组比较,京尼平苷组ob/ob 小鼠肝组织中Perilipin-2 mRNA 和蛋白表达均降低(P<0.05)。

图3 京尼平苷对ob/ob 小鼠肝组织中Perilipin-2 mRNA(A)和蛋白(B)表达的影响(, n=3)Fig.3 Effects of geniposide on hepatic mRNA(A)and protein(B)expressions of Perilipin-2 in ob/ob mice(, n=3)
3.4 京尼平苷对油酸诱导的HepG2 细胞中脂滴形成的影响 如图4 所示,油酸处理可明显诱导HepG2 细胞中脂滴的形成,而京尼平苷干预后可明显抑制油酸诱导的HepG2 细胞中脂滴的积累。

图4 京尼平苷对油酸诱导的HepG2 细胞中脂滴形成的影响Fig.4 Effects of geniposide on lipid droplet formation in oleic acid-induced HepG2 cells
3.5 京尼平苷对油酸诱导HepG2 细胞中Perilipin-2 表达的影响 如图5 所示,与对照组(不含京尼平苷和油酸)比较,油酸诱导可增加HepG2 细胞中Perilipin-2 mRNA 和蛋白表达(P<0.01);与模型组(0.6 mmol/L 油酸)比较,京尼平苷干预后可降低油酸诱导的HepG2 细胞中Perilipin-2 的mRNA 和蛋白表达(P<0.05,P<0.01)。

图5 京尼平苷对油酸诱导的HepG2 细胞中Perilipin-2 mRNA(A)和蛋白(B)表达的影响(, n=3)Fig.5 Effects of geniposide on mRNA(A)and protein(B)expressions of Perilipin-2 in oleic acid-induced HepG2 cells(, n=3)
4 讨论
Perilipin-2 是一种脂肪细胞因子,属于PAT 家族蛋白成员,位于多种细胞的脂滴表面,是脂滴的主要成分之一,主要在分化的脂肪细胞中表达,在脂质运输、脂滴形成和贮存中起重要作用[16]。本实验结果表明,京尼平苷可降低ob/ob 小鼠体质量,改善胰岛素抵抗,降低血清中TG、TC 水平,同时还可减少肝脏中脂滴的积累和脂滴相关蛋白Perilipin-2 的表达,并在体外抑制油酸诱导的HepG2 细胞中脂滴的积累和Perilipin-2 表达。提示,京尼平苷可能在防止肥胖和过量饱和脂肪酸摄入引起的NAFLD 中发挥一定的作用。
脂滴是一种亚细胞结构,由中心的中性脂质如TG、胆固醇酯和周围包裹的磷脂单分子层所构成,其生命周期始于脂肪酸及胆固醇酯。在众多调节脂滴形成和分解的分子中,脂滴表面磷脂中镶嵌的Perilipin 对于脂滴的代谢及调节具有重要作用[17-19]。研究表明,在NAFLD中,Perilipin-2 蛋白普遍存在于肝细胞和肝星状细胞,包裹在脂滴周围,在所有Perilipin 蛋白中上调最为明显[20]。Perilipin-2 会促进TG 积累,抑制肝脏脂质分解,促进高脂食物诱导的NAFLD 症状[21-22]。本研究发现,京尼平苷在调节Perilipin-2 表达的同时抑制脂滴形成。提示,调节Perilipin-2 表达可能是京尼平苷减少脂滴积累,进而改善NAFLD 症状的重要途径。
由于NAFLD 是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤,因此,首要治疗目标是改善胰岛素抵抗,防治代谢综合征及其相关终末期器官病变,目前临床上尚缺乏安全有效的药物。GLP-1 受体激动剂是NAFLD 在研药物中极有发展前景的一类[23]。肝细胞上普遍表达GLP-1 受体,GLP-1 受体激动剂可直接调节肝脏脂质代谢、抑制炎性反应来保护肝细胞[24-25]。本课题组前期研究发现,京尼平苷是一种选择性GLP-1 受体激动剂,不仅可通过激活GLP-1 受体发挥抗氧化和抗炎作用[11,26],还能调节胰腺β 细胞对葡萄糖的吸收和代谢,影响分泌胰岛素,拮抗高糖和高脂诱导的胰腺β 细胞损伤[13-14,27-30]。本研究发现,京尼平苷能在体内外降低肝细胞中脂滴的数量和大小。尽管京尼平苷调节脂滴形成的分子机制还有待于进一步深入研究,但综合国内外研究进展和本研究结果,京尼平苷可能在NAFLD 的防治中具有广阔的应用前景。
