青藤碱对胆管癌细胞的抑制作用
2022-07-22吕彦霖邓亚竹朱昌毫崔胜男喻超孙诚谊
吕彦霖邓亚竹朱昌毫崔胜男喻超孙诚谊
(贵州医科大学,贵州 贵阳550004)
胆管癌是属于原发性肝癌的一种常见恶性肿瘤,我国恶性肿瘤的发病率和死亡率一直稳中有升[1],其患病初期难以诊断,大多数患者确诊时已为晚期[2-3]。尽管胆管癌的临床诊疗方法日新月异,但对晚期患者尚无有效控制病情发生发展的手段,导致总体预后较差,5 年生存率仅20%~30%[4]。因此,寻找一种新型、高效、低毒的药物以改善现有胆管癌临床诊疗方案变得极为迫切。
有研究发现,PI3K/Akt 通路在胆管癌组织中的表达较癌旁组织及正常胆管组织更高,提示该通路可能参与病情发生发展,并可作为其生物学行为的评估指标[5-6]。PI3K 是一种细胞内磷脂酰肌醇激酶,国内外研究认为PI3K/Akt 是一种与细胞增殖、凋亡密切相关的信号通路,在胆管癌治疗中发挥重要作用[7]。
许多中药提取物在多种癌症治疗中均表现出优秀的抗肿瘤作用[8-10],而且有着价格低廉、储量丰富等优点。青藤碱是从青藤中提取的一种活性物质,研究人员发现该成分可直接或间接地在视网膜母细胞瘤[11]、乳腺癌[12]、胃癌[13]、肾细胞癌[14]等多种肿瘤中发挥抗癌作用,而且与PI3K/Akt 信号通路及相关蛋白表达密切相关。课题组前期研究发现,青藤碱可在体外有效抑制胆管癌细胞增殖,促进胆管癌细胞凋亡[15]。因此,本实验从PI3K/Akt 通路着手,考察该成分对胆管癌的抑制作用。
1 材料
1.1 细胞 HuCCT-1、TFK-1 胆管癌细胞株,由武汉同济医院肝胆胰外科肝胆胰外科实验室提供。
1.2 动物 6 周龄SPF 级雌性免疫缺陷BALB/c nude mice 裸鼠18只,体质量约为20 g,购自北京华阜康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2019-0008,按照SPF 级标准饲养于贵州医科大学临床研究中心动物房,温度(25±2)℃,相对湿度70%,昼夜12 h/12 h,自由饮食饮水。所有动物操作实验均按贵州医科大学动物保护和利用委员会批准的规程进行。
1.3 试剂与药物 青藤碱(批号S235901,纯度99.88%)、LY294002(批号S110504,纯度99.84%)均购自美国Selleck 公司。胎牛血清、RPMI-1640、0.25%胰蛋白酶、0.05% 不含EDTA 的胰蛋白酶(美国Gibco 公司);GeenNucTM活细胞caspase-3 活性检测试剂盒[含GreenNucTMcaspase-3 Substrate与Ac-DEVD-CHO(乙酰基-天冬氨酰-谷氨酰-缬氨酰-天冬氨醛)](南京碧云天生物技术有限公司);AV-FITC/PI 凋亡试剂盒(美国BD 公司);RIPA裂解缓冲液(北京索莱宝科技有限公司);BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶配置试剂盒(美国Millipore 公司);cleaved caspase-3、PCNA、PI3K、p-Akt、Akt 抗体(美国CST 公司);Ki67抗体(上海爱必信生物科技有限公司);羊抗鼠、羊抗兔抗体(美国Boster Bio 公司)。
2 方法
2.1 GreenNucTM活细胞caspase-3 活性检测 取对数生长期细胞,PBS 清洗,0.25%胰酶消化,用含10%血清的培养基终止消化后,得到细胞悬液。细胞计数后,以每孔4×103个的密度接种于96 孔板,待细胞贴壁后分为3组,分别为0 mmol/L 青藤碱组、1.0 mmol/L 青藤碱组、1.0 mmol/L 青藤碱+Ac-DEVD-CHO 抑制剂(20 μmol/L)组,重复3次,各孔加入相应试剂后放入培养箱孵育24 h,用含5 μmol/L GreenNucTMcaspase-3 Substrate 底物的RPIM-1640 培养液进行换液,Ac-DEVD-CHO 抑制剂组补充20 μmol/L 抑制剂。将96 孔板在室温下避光孵育30 min后,在倒置荧光显微镜下观察,设置绿色荧光的滤光片最大激发波长为500 nm/530 nm,拍照并记录结果,设置酶标仪激发波长/发射波长为485 nm/515 nm,采用酶标仪检测,并记录结果。
2.2 Annexin V/PI 双染色检测细胞凋亡率 取对数期生长胆管癌细胞,以每孔5×104个的密度接种6 孔板中,置于培养箱中培养,待细胞贴壁后分为2组,分别为0 μL LY294002 组、5 μL LY294002(caspase-3 抑制剂)组,继续培养24 h 后收集各组细胞,将6 孔板内上清液收集于15 mL 离心管中,PBS 清洗,用不含EDTA 的胰蛋白酶消化细胞,用含血清培养基终止消化,1 200 r/min 离心5 min,弃上清,加入PBS 至15 mL 离心管中,转移细胞悬液于流式管内,1 200 r/min 离心5 min,弃上清,每管加入500 μL 1×Binding buffer、5×105个细胞,再加入5 μL AnnexinV FITC 染色液、10 μL PI染色液,轻轻吹打均匀,在4 ℃下避光孵育15 min,通过流式细胞仪检测细胞凋亡情况。
2.3 Western blot 检测细胞增殖、凋亡及PI3K/Akt信号通路相关蛋白表达 取对数期生长胆管癌细胞,以每孔5×105个的密度接种于6 孔板中,待其贴壁后进行分组和加药,24 h 后收集细胞,采用RIPA 裂解液,在4 ℃下提取细胞总蛋白采用,BCA 蛋白法检测蛋白浓度,与5×Loading buffer 混合后在95 ℃下煮沸10 min,每孔泳道中加入20 μg蛋白样品进行SDS-PAGE 电泳(90 V、2 h),再300 mA 恒流2 h 转至PVDF 膜上,5%脱脂牛奶室温封闭2 h,加入相应一抗,4 ℃摇床孵育过夜,TBST 洗膜3次,每次15 min,加入二抗室温孵育2 h,TBST 洗膜3次,每次15 min,最后使用ECL发光液曝光显色,通过ImageJ 1.45s 软件进行灰度值分析。
2.4 裸鼠皮下成瘤实验 取对数期生长胆管癌Hucct-1 细胞,调整密度为4×106/200 μL,置于冰盒中待用,碘伏、酒精消毒裸鼠皮肤,胰岛素针将200 μL 细胞悬液缓慢注射入裸鼠右腋下,形成3~5 mm 的皮丘。Hucct-1 细胞植入24 h后,裸鼠随机分为生理盐水组及青藤碱低、高剂量组(75、150 mg/kg),生理盐水组腹腔注射生理盐水,青藤碱组腹腔注射PBS 溶解的青藤碱混悬液,每只100 μL,每天1次,每周观察肿瘤生长情况及生命体征,称定体质量,游标卡尺测量肿瘤大小并计算其体积。给药4 周后,乙醚麻醉处死裸鼠,测定肿瘤质量,组织提取蛋白,按“2.3”项下方法进行Western blot 实验。
2.5 统计学分析 通过SPSS 22.0 软件进行处理,数据以()表示,多组间比较采用方差分析,2 组间比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 青藤碱抑制胆管癌细胞增殖 如图1 所示,与0 mmol/L 青藤碱组比较,随着该成分浓度升高,Hucct-1、TFK-1 细胞中增殖关键蛋白Ki67、PCNA表达均降低(P<0.05,P<0.01)。

图1 青藤碱对Hucct-1、TFK-1 细胞中Ki67、PCNA 蛋白表达的影响(, n=3)Fig.1 Effects of sinomenine on protein expressions of Ki67 and PCNA in Hucct-1 and TFK-1cells(, n=3)
3.2 青藤碱促进胆管癌细胞凋亡 如图2 所示,与0 mmol/L 青藤碱组比较,1.0 mmol/L 青藤碱干预后Hucct-1、TFK-1 细胞核可见绿色荧光(凋亡细胞),细胞caspase-3 活性升高(P<0.01)。
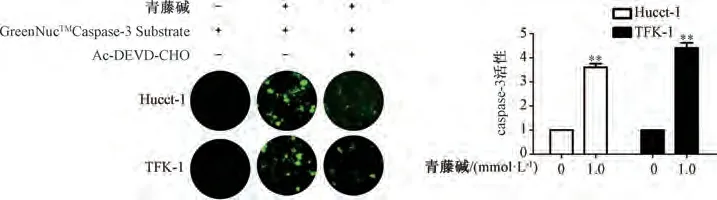
图2 青藤碱对Hucct-1、TFK-1 细胞中caspase-3 活性的影响(, n=3)Fig.2 Effects of sinomenine on caspase-3 activities in Hucct-1 and TFK-1 cells(, n=3)
3.3 PI3K/Akt 信号通路参与青藤碱诱导凋亡的过程 如图3 所示,与0 mmol/L 青藤碱组比较,随着青藤碱浓度升高,Hucct-1、TFK-1 细胞中p-Akt/Akt、PI3K 蛋白表达均降低(P<0.01)。如图4 所示,与0 μL LY294002 组比较,5 μL LY294002 干预后能降低Hucct-1、TFK-1 细胞中p-Akt/Akt 蛋白比值和增殖关键蛋白Ki67 表达,增加凋亡关键蛋白cleaved caspase-3 表达(P<0.05,P<0.01)。如图5 所示,与单用1 mmol/L 青藤碱比较,5 μL LY294002+1 mmol/L 青藤碱干预后可进一步降低Hucct-1、TFK-1 细胞中p-Akt/Akt、Ki67 蛋白表达,增加cleaved caspase-3 蛋白表达(P<0.01)。如图6 所示,与0 μL LY294002 组比较,5 μL LY294002 可促进Hucct-1、TFK-1 细胞的凋亡(P<0.01);与单用青藤碱比较,5 μL LY294002 +1 mmol/L青藤碱可促进Hucct-1、TFK-1 细胞凋亡(P<0.01),而且效果优于单用LY294002(P<0.01)。
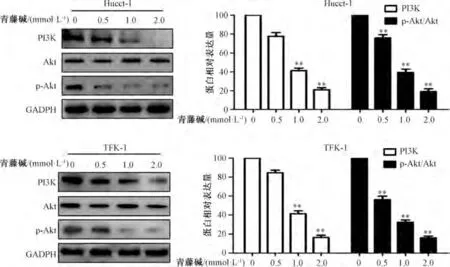
图3 青藤碱对Hucct-1、TFK-1 细胞中PI3K/Akt 通路的抑制作用(, n=3)Fig.3 Inhibitory effects of sinomenine on PI3K/Akt pathway in Hucct-1 and TFK-1 cells(, n=3)

图4 LY294002 对Hucct-1、TFK-1 细胞中增殖与凋亡关键蛋白的影响(, n=3)Fig.4 Effects of LY294002 on the key proteins responsible for proliferation and apoptosis in Hucct-1 and TFK-1 cells(, n=3)

图5 青藤碱联合LY294002 对Hucct-1、TFK-1 细胞中关键蛋白增殖与凋亡的影响(, n=3)Fig.5 Effects of combination use of sinomenine and LY294002 on the key proteins responsible for proliferation and apoptosis in Hucct-1 and TFK-1 cells(, n=3)
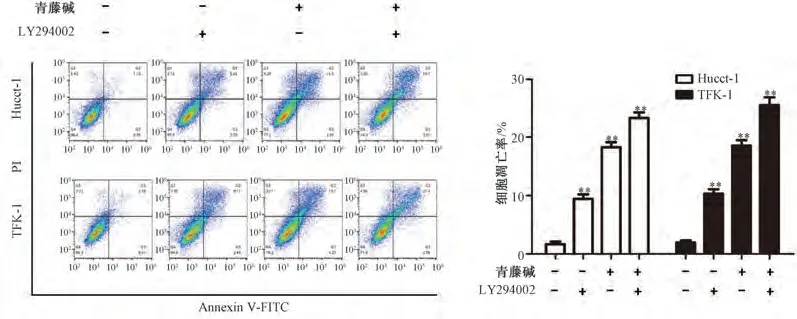
图6 青藤碱联合LY294002 对Hucct-1、TFK-1 细胞凋亡的影响Fig.6 Effects of combination use of sinomenine and LY294002 on the apoptosis of Hucct-1 and TFK-1 cells
3.4 青藤碱在体内抑制胆管癌荷瘤生长 如图7所示,给药4 周内各组裸鼠体质量均无明显变化(P>0.05)。如图8 所示,与生理盐水组比较,给药2 周后青藤碱高剂量组对肿瘤生长有较强的抑制作用(P<0.05),给药4 周后各剂量组均表现出不同程度的抑制作用(P<0.05,P<0.01)。如图9所示,与生理盐水组比较,青藤碱各剂量组裸鼠荷瘤组织细胞中Ki67、p-Akt/Akt 蛋白表达随剂量增加而降低(P<0.01),cleaved caspase-3 蛋白表达随着剂量增加而升高(P<0.05,P<0.01)。

图7 各组裸鼠体质量变化(, n=6)Fig.7 Body weight changes of nude mice in each group(, n=6)

图8 各组裸鼠肿瘤体积、质量变化(, n=6)Fig.8 Changes of tumor volumes and weights of nude mice in each group(, n=6)
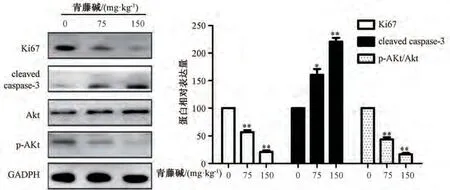
图9 各组裸鼠肿瘤组织中关键蛋白表达(, n=6)Fig.9 Expressions of key proteins in tumor tissues of nude mice in each group(, n=6)
4 讨论
胆管癌是一种高发病率和高死亡率的肝胆肿瘤,其起病初期隐蔽,诊断困难,虽然相关治疗取得了很大进展,但5 年生存率仍不理想[16-17]。目前,临床上许多抗肿瘤药物都存在免疫抑制、副作用大、价格昂贵、效果有限等问题,故寻找一种新型、廉价、低毒的药物来提高患者的生活质量是非常迫切的。
青藤碱是从青藤中提取的活性成分,可在体外对胆管癌发挥优秀的抑制作用[15],但其分子机制尚不清楚。有研究发现,与癌旁胆管癌组织与正常胆管组织比较,PI3K/Akt 通路在胆管癌组织中异常激活,表现出高表达水平[5-6],提示其异常激活可能对促进胆管癌细胞增殖起到积极的促进作用,抑制此通路可起到良好的抗胆管癌作用。大量报道显示,青藤碱抗癌作用与PI3K/Akt 通路密切相关[11,14]。本实验发现,青藤碱可显著抑制胆管癌细胞中PI3K/Akt 信号通路和细胞株增殖,并诱导其凋亡。
前期发现,腹腔注射75 mg/kg 青藤碱可在裸鼠体内发挥优异的抗食管鳞状细胞癌作用[18];在150 mg/kg剂量下,可显著改善小鼠乳腺癌细胞对骨的破坏[19];在75、150 mg/kg 剂量下,可较好地抑制人乳腺癌肿瘤的生长[20]。因此,本实验采用裸鼠建立皮下成瘤模型,每天腹腔注射给药,发现相较于模型组,青藤碱治疗组小鼠体质量并无明显变化,但随着其给药剂量增加,对肿瘤生长的抑制作用增强,并且cleaved caspase-3 蛋白表达升高,Ki67、p-Akt/Akt 蛋白表达降低。
综上所述,青藤碱可通过PI3K/Akt 途径有效抑制胆管癌细胞增殖,并诱导其凋亡,具有明显的抗胆管癌作用,可为临床相关治疗提供新视角,但该成分正式应用于临床还需作进一步探索。
