结直肠腺瘤的肠道微生态分析及临床意义
2022-07-22陈冰心朱永亮奚沁华
徐 俊 陈冰心 朱永亮 奚沁华 严 苏
1.苏州大学附属第一医院消化内科,江苏苏州 215006;2.苏州普瑞森基因有限公司,江苏苏州 215000
结直肠癌(colorectal cancer,CRC)是西方世界癌症相关的第二大死因[1];在我国,CRC 是第三大常见癌症,第五大死亡原因[2]。CRC 通常起源于结直肠腺瘤(colorectal adenoma,CRA)[3],随着APC 基因的丢失以及KRAS、TP53 等基因激活和失活突变的累积,最终导致肿瘤发生[4]。目前认为在经典的腺瘤—癌发展进程中,CRA 患者存在明显的肠道菌群失衡现象[5-6],其发生是涉及多个细菌类群组成改变的复杂过程。如能将这种复杂的变化提炼为一个简单的指标,将有助于推动肠道菌群研究的临床应用。
目前临床缺乏对CRA 非侵入性安全高效的早期检测手段[7]。本研究拟运用16S rRNA 高通量测序技术及生物信息学分析方法,观察CRA 患者和健康志愿者肠道菌群组成差异并以此构建模型,为发展CRA 早期诊断标志物提供新的思路及理论依据。
1 资料与方法
1.1 一般资料
收集2017 年1 月至2018 年7 月在苏州大学附属第一医院行肠镜检查的96 例CRA 患者。纳入标准:①年龄≥18 周岁;②在苏州地区居住满5 年以上;③肠镜和病理学结果明确。排除标准:①既往有结直肠手术史;②近1 个月使用过非甾体类抗炎药、抗生素、类固醇皮质激素及益生菌;③有肠道感染、肠功能紊乱、炎症性肠病、代谢性疾病(糖尿病、肥胖、高脂血症)、严重肝肾疾病及免疫缺陷;④有特殊饮食习惯(高脂肪、高蛋白、低膳食纤维)或饮食限制。同期以相同排除标准纳入59 名肠镜未见异常的健康体检者作为对照组。所有志愿者于肠道准备前留取粪便样本,并进行粪便隐血试验(fecal occult blood test,FOBT)和血清癌胚抗原(carcinoembryonic antigen,CEA)检测。两组一般资料比较,差异无统计学意义(P >0.05),具有可比性,见表1。本研究通过苏州大学附属第一医院伦理委员会审核[批准号+56(2016)],每位受试者签署知情同意书。
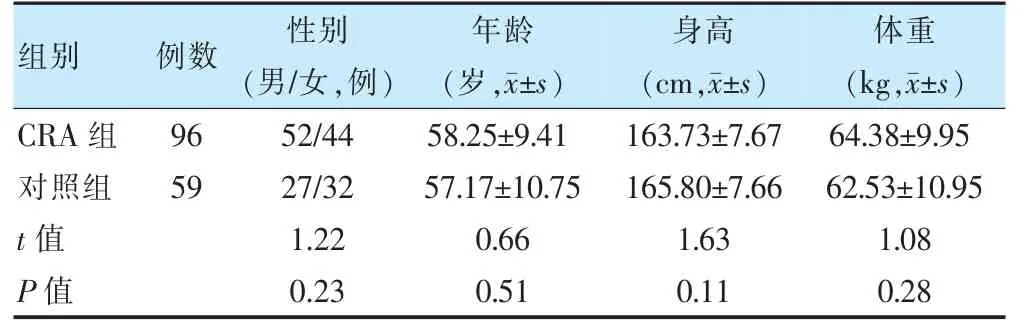
表1 两组一般资料比较
1.2 研究方法
使用TIANamp 粪便DNA 试剂盒(天根生化科技有限公司,货号:DP328)进行粪便DNA 提取。使用NanoDrop 2000c 分光光度计(赛默飞世尔科技公司)对纯化核酸进行定量。通过PCR 技术对细菌16S V3-V4区域扩增,所用引物为:16SF_V3:5’-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGRRBGCASCAGKVRVGAAT-3’和16SR_V4:5’-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGGACTACNVGGGTWTCTAATC-3’。将PCR 产物在Illumina Miseq测序平台进行双端测序分析。
使用PANDAseq(v0.21.1)拼接V3-V4 序列,用Trimmomatic(V0.30)进行质量过滤。通过Vsearch(v1.9.6)去除序列中的嵌合体。按97%相似度进行out群落聚类。通过Cytoscape 将丰度差异菌属构建网络关系图。使用R 中的随机森林分类系统训练OTU 预测患者风险。
基于差异菌株构建加权失衡指数(weighted dysbiosis index,WDI)模型,WDI 定义为样本到健康组质心欧式距离(μN)与样本到疾病组质心欧式距离(μD)的差值,即WDIs(S,μD,μN)=,其 中Si,μDi,μNi 分别代表样本S、μN、μD 第i 类群丰度,FCi 是第i 类群倍数变化。WDI 正值代表测试样本远离健康组距离超过疾病组,处于失衡状态。
1.3 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验;绘制受试者操作特征(receiver operating characteristic,ROC)曲线,观察不同检测方法对CRA 的诊断效能。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组基本特征比较
每个样本平均可获得110 000 条序列,序列平均长度为453.7 bp。两组ACE、Chao1、Shannon 和Simpson指数比较,差异无统计学意义(P >0.05);两组序列数、序列长度比较,差异无统计学意义(t=0.11、0.32,P=0.92、0.76)。见图1。
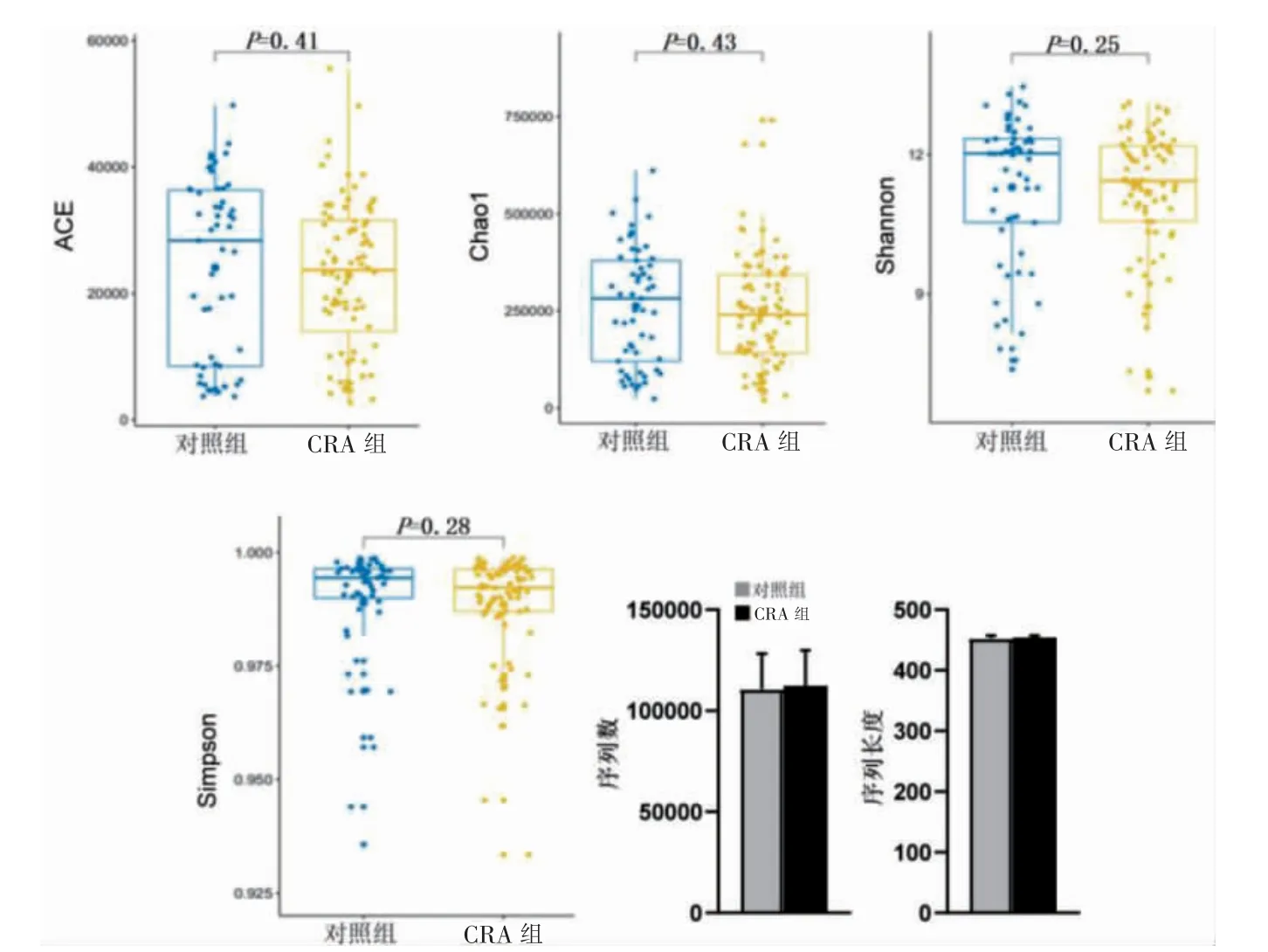
图1 两组基本特征比较
2.2 两组菌群组成比较
与对照组比较,CRA 组肺炎克雷伯菌、粪副拟杆菌、梭杆菌属丰度增加;放线菌门、毛螺菌科、布劳特氏菌属、双歧杆菌属、罗氏杆菌属、链球菌属、假丁酸弧菌属、溃疡梭杆菌种丰度减少。见图2。

图2 两组菌群组成比较
2.3 多种检测方法对CRA 的诊断效能
FOBT 诊断CRA 的灵敏度为15.63%(15/96),特异度为91.53%(54/59),误诊率为8.47%(5/59),漏诊率为84.38%(81/96)。WDI 诊断CRA 的灵敏度为83.33%,特异度为71.19%,曲线下面积(area under the curve,AUC)为0.795(P <0.0001,95%CI:0.712~0.877);CEA诊断CRA 的灵敏度为71.88%,特异度为52.54%,AUC为0.614(P=0.017,95%CI:0.523~0.706)。见图3。

图3 基于WDI 和CEA 的ROC 曲线
3 讨论
本研究运用高通量测序比较CRA 组和对照组肠道菌群组成,显示CRA 阶段存在明显的菌群失衡现象。与临床常用的FOBT 和CEA 比较,基于11 个丰度差异类群构建的WDI 模型在CRA 诊断中具有更为优秀的效能。
研究表明,CRA 患者肺炎克雷伯菌丰度高于对照组[8],而粪副拟杆菌在进展期腺瘤中明显富集[9]。腺瘤中梭杆菌属丰度与局部炎症呈正相关,而与腺瘤大小或数量无明显相关性[10]。毛螺菌可减少肠道息肉的发生[11],其在CRA 组的丰度低于对照组[12]。双歧杆菌可以降低结肠pH、抑制潜在的病原体[13]。Rezasoltani等[14]发现,CRA 组双歧杆菌、罗氏杆菌明显减少,且息肉越大、分化越差、丰度降低越明显。此外,CRA 患者布劳特菌属的丰度也是下降的[15],该菌还涉及代谢相关疾病[16]。假丁酸弧菌属和溃疡梭杆菌同为产丁酸盐类细菌[17]。丁酸盐具有抑制结肠炎症和癌变的作用,本研究中上述类群在CRA 组的缺失与发病机制的联系还有待进一步研究。
大规模人群筛查是降低结直肠肿瘤发病率的重要途径[18]。现有的方法包括:FOBT、血清CEA、粪便DNA、胶囊内镜、气钡双重造影、CT、结肠镜等[19],但往往存在依赖先进设备、检查费用昂贵、放射性危害、对腺瘤检出率不高等问题[20-23]。有报道,FOBT 对CRA 的诊断敏感度为47.7%[24],而CEA 的敏感度仅为11%~18%[25],缺乏参考价值。本研究构建的模型对于CRA的诊断潜能明显优于这两者。鉴于肠道菌群模型只需采集患者粪便,无创便捷,在扩大样本量寻找更具代表性的菌株优化模型基础上,或许有望将其发展为CRA 早期筛查的一种新手段。
