谷氨酸二乙酸四钠类Fenton氧化法对减阻剂EM50的降黏效果
2022-07-21陈文秋孙三祥
陈文秋,孙三祥,谢 娟
(1. 兰州交通大学 环境与市政工程学院,甘肃 兰州 730070;2. 寒旱地区水资源综合利用教育部工程中心,甘肃 兰州 730070;3. 西安石油大学 化学化工学院陕西省油气田环境污染控制与储层保护重点实验室,陕西 西安 710065)
压裂是页岩气开采增产的重要技术之一。随压裂规模不断增加,压裂返排液量逐年上升。压裂返排液成分复杂且较为稳定,COD、黏度、无机盐含量高,且含有细菌、油类等,在自然条件下难降解,如不经处理直接排放,对周边土壤、水资源、动植物及人类带来巨大的潜在危害[1-4]。压裂液中的减阻剂使压裂返排液具有一定的黏性,增加了处理难度。目前,高级氧化法处理压裂返排液最为常见、应用最广,尤其Fenton氧化法效果好、反应快[5-8]。但由于Fenton试剂需在较强酸性(pH=3.5左右)条件下完成,使工艺操作及后续处理难度增大、成本增加。研究高效、绿色、拓宽pH适用范围的聚合物类Fenton氧化法成为热点[9-10]。
本工作采用生态毒性较低、生物降解性好的谷氨酸二乙酸四钠(GLDA)[11-12]与Fe2+形成配合物,催化H2O2氧化反应,对减阻剂EM50溶液进行降黏处理,并研究了反应pH、反应温度、溶液矿化度对降黏效果的影响。
1 实验部分
1.1 试剂和仪器
减阻剂EM50:工业级;GLDA:质量分数47%;乙二胺四乙酸二钠(EDTA):质量分数78%;亚氨基二琥珀酸四钠(IDS):质量分数33%~35%,工业级;H2O2(质量分数30%),NaCl,CuCl2,ZnCl2,FeSO4,Ce(NO3)3,CaCl2,MgCl2,NaHCO3:均为分析纯。
平氏(毛细管)黏度计:Φ0.8 mm,上海良晶玻璃仪器厂;GJ-3S 型数显高速搅拌机:青岛海通达专用仪器厂;ISO 9001型电子天平:北京赛多利斯仪器系统有限公司;DK-98-II 型电热恒温水浴锅:天津市泰斯将仪器有限公司。
1.2 溶液的配制
1.2.1 EM50溶液的配制
用蒸馏水配制质量分数为0.1%的EM50溶液,密封后室温放置24 h以上,使其充分溶胀。
1.2.2 配合物溶液的配制
分别配制浓度为0.20 mol/L的GLDA,EDTA,IDS,FeSO4溶液。取 20 mL GLDA、EDTA、IDS溶液分别与20 mL FeSO4溶液混合,配制n(配合物)∶n(Fe2+)=1.0∶1、c(配合物)=c(Fe2+)=0.10 mol/L的配合物溶液。
分别配制浓度为0.20 mol/L的CuCl2,ZnCl2,FeSO4,Ce(NO3)3,CaCl2,MgCl2溶液。6种溶液各取20 mL,分别与20 mL GLDA溶液混合,得到6种不同金属离子配合溶液。
1.2.3 矿化度水样的配制
准确称量5.00 g NaCl、0.20 g MgCl2·6H2O、0.60 g Na2SO4、0.53 g CaCl2、0.04 g NaHCO3,混合溶于93.63 g蒸馏水中,配制矿化度为60 g/L的盐溶液。使用时分别稀释至矿化度为200,500,1 000,2 000,3 000 mg/L,以此盐溶液分别配制质量分数为0.1%的EM50溶液。
1.3 实验方法
1.3.1 配合物体系的选择
取EM50溶液100 mL于锥形瓶中(pH=6,溶液矿化度为0 mg/L),在30 ℃恒温水浴锅中放置20 min,加入H2O2溶液0.5 mL,再加入不同的配合物溶液,催化氧化反应30 min。测定反应前后溶液在30 ℃下的黏度,计算降黏率,确定适宜的金属离子配合物种类、GLDA与金属离子摩尔比及配合物溶液加入量(100 mL EM50溶液中加入配合物溶液的体积,mL)。
1.3.2 反应条件实验
在n(GLDA)∶n(Fe2+)=1.0∶1,c(GLDA)=c(Fe2+)=0.10 mol/L的配合物加入量为1.0 mL的条件下,考察反应pH、反应温度、溶液矿化度等对EM50溶液降黏效果的影响。
2 结果与讨论
2.1 配合物体系的确定
2.1.1 金属离子的确定
在GLDA与金属离子摩尔比为1∶1、c(GLDA)=0.10 mol/L的配合物溶液的加入量为1.0 mL的条件下,不同金属离子-GLDA配合物对EM50溶液降黏率的影响见图1。由图1可见:6种不同的配合物对EM50溶液均具有降黏的效果;随着反应时间的增加,降黏率在10 min之内呈现快速上升趋势,10 min后逐渐达到稳定;Zn2+,Ce2+,Ca2+,Mg2+4种金属离子与GLDA的配合物对EM50溶液降黏效果不明显;反应30 min后降黏率分别仅有17.62%,19.02%,10.13%,13.07%;Cu2+与GLDA的配合物的降黏效果一般,反应30 min时降黏率为42.82%;Fe2+与GLDA的配合物的降黏效果最佳,在10 min时降黏率已达86.70%,反应30 min时降黏率为89.50%,此时溶液黏度为0.85 mPa·s。实验结果表明,GLDA-Fe2+配合物具有更显著的催化能力。
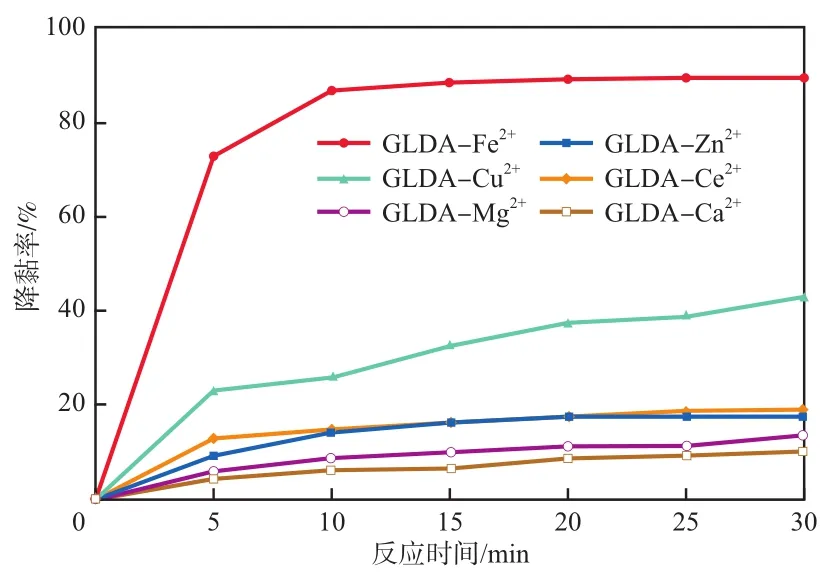
图1 不同金属离子-GLDA配合物对EM50溶液降黏率的影响
2.1.2n(GLDA)∶n(Fe2+)的确定
在c(Fe2+)=0.10 mol/L的GLDA-Fe2+配合物溶液的加入量为2.0 mL的条件下,n(GLDA)∶n(Fe2+)对EM50溶液黏度的影响见图2。由图2可见:随着n(GLDA)∶n(Fe2+)的增加,EM50溶液的黏度也不断减小,n(GLDA)∶n(Fe2+)为(0.5∶1),(1.0∶1),(2.0∶1),(3.0∶1)时,EM50溶液的降黏效果显著,反应30 min时溶液黏度分别为0.93,0.85,0.87,0.92 mPa·s,降黏率分别达到84.36%,85.79%,85.38%,84.61%;其中,n(GLDA)∶n(Fe2+)为(1.0∶1),(2.0∶1),(3.0∶1)时降黏效果相差甚小,所以以下实验均选择n(GLDA)∶n(Fe2+)=1.0∶1的配合物作为最佳催化剂。

图2 n(GLDA)∶n(Fe2+)对EM50溶液黏度的影响
当n(GLDA)∶n(Fe2+)=0∶1时,EM50溶液中仅加入了Fe2+和H2O2,此时的反应体系为单一的Fenton体系。由图2可知,单一Fenton体系对于压裂液的降黏效果不佳。其原因是Fenton试剂主要依靠Fe2+及H2O2在水溶液中产生的·OH氧化降解有机物,最佳pH范围为2.5~3.5,而实际工业废水一般呈中性或碱性,为达到理想降黏效果需要额外增设昂贵的酸化过程,且增加后续处理难度[13],所以对该方法进行改进很有必要。
2.1.3 GLDA-Fe2+配合物溶液加入量的确定
在n(GLDA)∶n(Fe2+)=1.0∶1、c(GLDA)=c(Fe2+)=0.10 mol/L的条件下,GLDA-Fe2+配合物溶液加入量对EM50溶液黏度的影响见图3。由图3可见:配合物溶液加入量为0.5~3.0 mL 时对EM50溶液的降黏效果均很显著,其中加入量为1.0 mL和2.0 mL的配合物对EM50溶液降黏效果更为明显且差异较小,反应15 min后EM50溶液黏度可降到1 mPa·s左右。综合考率降黏率和成本两个因素,确定GLDA-Fe2+配合物溶液的最佳加入量为1.0 mL。
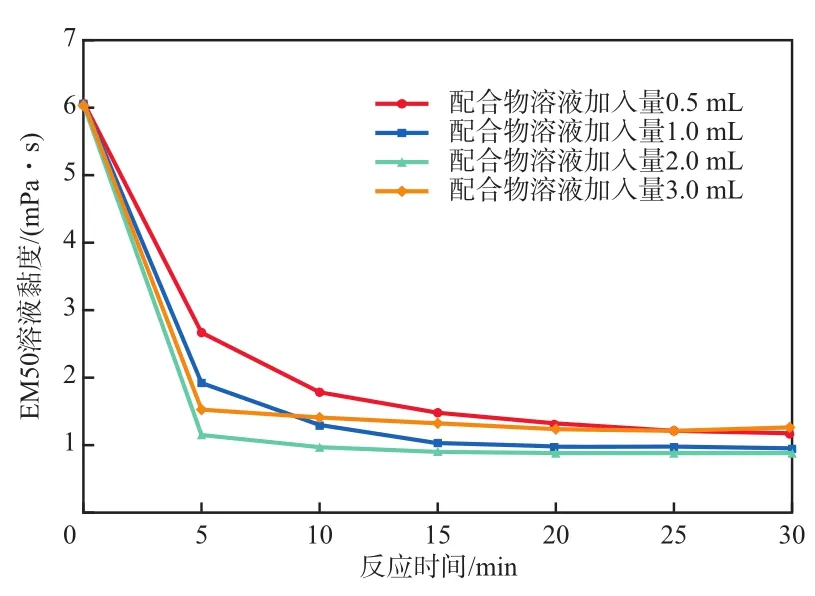
图3 GLDA-Fe2+配合物溶液加入量对EM50溶液黏度的影响
2.1.4 不同反应体系降黏率的比较
分别以4种不同反应体系(H2O2溶液0.5 mL,FeSO4溶液1.0 mL,GLDA溶液1.0 mL,H2O2溶液0.5 mL+n(GLDA)∶n(Fe2+)=1.0∶1的GLDA-Fe2+溶液1.0 mL)对EM50溶液进行降黏实验,不同反应体系对EM50溶液降黏率的影响见图4。由图4可见:4种反应体系的降黏效果顺序如下:H2O2溶液0.5 mL+n(GLDA)∶n(Fe2+)=1.0∶1的GLDA-Fe2+溶液1.0 mL 体系> FeSO4溶液1.0 mL体系> H2O2溶液0.5 mL体系> GLDA溶液1.0 mL体系;其中,单独加入FeSO4,H2O2,GLDA时对于EM50溶液的降黏效果不明显;当加入H2O2溶液0.5 mL及n(GLDA)∶n(Fe2+)=1.0∶1的GLDA-Fe2+溶液1.0 mL时,降黏效果较理想,反应10 min即可达到82.82%的降黏率,反应30 min时降黏率为88.88%,比其他3种反应体系的降黏率分别提高了49.72、54.45、72.94个百分点,此时溶液黏度降至1.03 mPa·s。

图4 不同反应体系对EM50溶液降黏率的影响
在GLDA,IDS,EDTA与Fe2+摩尔比均为1∶1、c(Fe2+)=0.10 mmol/L、配合物溶液加入量均为.01 mL的条件下,不同配合物对EM50溶液降黏率的影响见图5。由图5可见:3种配合物催化H2O2氧化处理EM50溶液的降黏效果均很理想,在反应30 min时降黏率均达到80%以上;GLDA-Fe2+催化H2O2氧化处理EM50溶液的降黏效果优于IDSFe2+和EDTA-Fe2+两种配合物体系。目前,EDTA、IDS、DTPA(二乙烯三胺五乙酸)、NTA(氨三乙酸)等螯合剂的应用较为广泛。EDTA与FeSO4所形成的配合物体系的催化效果明显[14-15],但与GLDA相比,EDTA与金属离子的螯合能力相对较弱,生物降解性差,易造成重金属富集,对环境中水、土壤造成较为严重的污染,对人体具有一定的伤害,现今多个国家和地区已经禁止或限制使用;IDS与金属离子的配伍能力强且性质稳定,属于新型绿色环保的螯合物质,但降黏效果略逊于GLDA;市面上86%的GLDA来源于自然原料,且在很宽的pH范围内都具有良好的溶解性能,与金属离子螯合的效果佳,物化能力优,生物毒性低,属于环境友好型的螯合剂[16-18]。

图5 不同配合物对EM50溶液降黏率的影响
2.2 其他因素对降黏效果的影响
2.2.1 反应pH
在反应温度为30 ℃、溶液矿化度为0 mg/L的条件下,反应pH对EM50溶液初始黏度的影响见图6。由图6可见,EM50溶液的初始黏度随着溶液pH的变化而改变;在pH=3~5的酸性条件下,溶液初始黏度有明显降低,酸性越强,黏度下降越明显;而在pH>7的碱性条件下,溶液初始黏度随之上升。
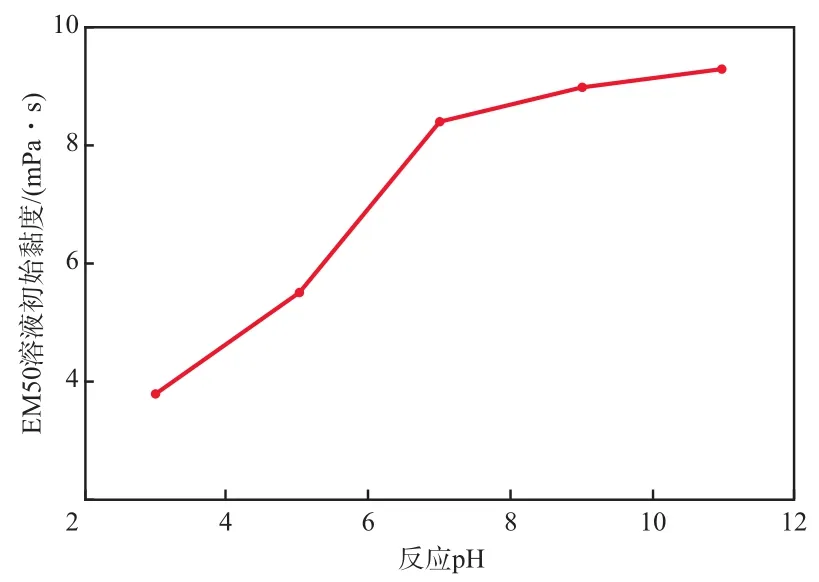
图6 反应pH对EM50溶液初始黏度的影响
在反应温度为30 ℃、溶液矿化度为0 mg/L的条件下,反应pH对EM50溶液降黏率的影响见图7。由图7可见:当pH=6时,对溶液的降黏效果最佳,反应30 min时降黏率可达80%左右;随着溶液酸性及碱性的不断增强,降黏率也随之减小,强酸强碱(pH=3和pH=11)的情况下降黏效果最差。由此得出本方法的适宜反应pH为6左右。常规的Fenton氧化法最佳pH为3左右,本研究使pH适用范围拓宽至6左右,实际压裂返排液的pH为6.0~6.5,因此本方法可为压裂返排液的降黏处理节约成本、减少工序。
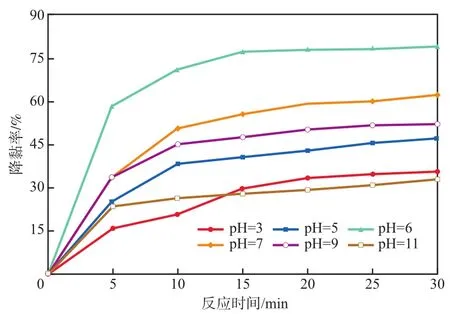
图7 反应pH对EM50溶液降黏率的影响
2.2.2 反应温度
在反应pH为6、溶液矿化度为0 mg/L的条件下,反应温度对EM50溶液黏度的影响见图8。由图8可见:EM50溶液的初始黏度随着温度的升高而逐渐降低;但4个温度下溶液的最终黏度变化不大,反应30 min时降黏率分别达到89.77%,89.80%,90.05%,89.01%。由此得出结论,温度会影响EM50溶液的初始黏度,溶液初始黏度随着温度的升高而降低,但不同温度对溶液的降黏效果影响甚微。
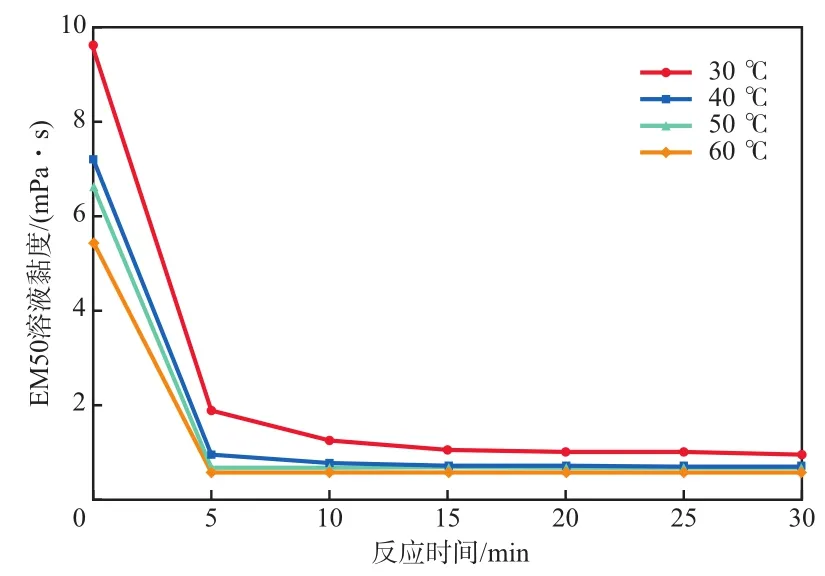
图8 反应温度对EM50溶液黏度的影响
2.2.3 溶液矿化度
在反应温度为30 ℃、反应pH为6的条件下,溶液矿化度对EM50溶液黏度的影响见图9。由图9可见:随溶液矿化度的增加,EM50溶液的初始黏度不断下降,但经过30 min 反应后,溶液的最终黏度较为接近;当溶液矿化度为3 000 mg/L时,EM50溶液的初始黏度降至1.81 mPa·s,反应30 min时最终黏度降至0.84 mPa·s,但由于初始黏度较低,使降黏率大幅下降。由此可得,溶液矿化度对EM50溶液的初始黏度有影响,对反应最终黏度影响不大。
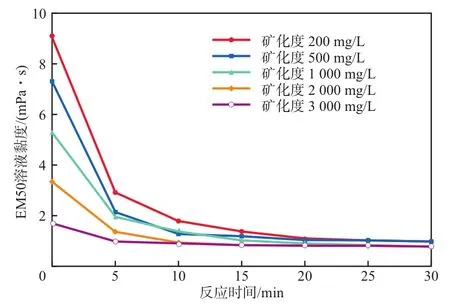
图9 溶液矿化度对EM50溶液黏度的影响
3 结论
a)采用GLDA与FeSO4制备GLDA-Fe2+配合物,作为类Fenton反应催化剂催化H2O2氧化反应,对EM50溶液进行降黏处理。实验结果表明,在反应温度为30 ℃、100 mL EM50溶液中加入H2O2溶液0.5 mL及n(GLDA)∶n(Fe2+)=1.0∶1、c(GLDA)=c(Fe2+)=0.10 mol/L的配合物溶液1.0 mL的条件下,反应30 min后EM50溶液黏度降低至 0.85 mPa·s左右,降黏率达89.50%。
b)溶液pH为6时降黏效果最佳,强酸强碱对初始黏度影响较大,降黏效果也更差。随反应温度升高,EM50溶液初始黏度不断降低,但对降黏效果影响小。溶液矿化度对EM50溶液初始黏度有影响,对反应最终黏度影响小。
c)GLDA-Fe2+-H2O2的催化氧化体系将传统的Fenton法最佳pH从3扩展至6。GLDA-Fe2+的降黏效果优于传统螯合剂,并且符合水处理的环保要求。
