番木瓜镁离子转运蛋白基因CpMGT1的克隆与功能分析
2022-07-21许迎港邹智郭静远孔华朱国鹏郭安平
许迎港 邹智 郭静远 孔华 朱国鹏 郭安平



摘 要:鎂是一种大量金属营养元素,其在植物的生长、发育、光合、胁迫响应等生物学过程中起重要作用。在高等植物中,Mg的吸收、运输、分布和再分配主要由镁离子转运蛋白(MGT/MRS2)和Mg/H交换体(MHX)介导。其中,MGT/MRS2又名CorA,最先在鼠伤寒沙门氏菌中被发现,后在拟南芥、水稻等模式植物中进行了较为深入的研究。番木瓜( L.)是一种隶属于十字花目番木瓜科的重要热带果树,至今还未见有关基因的报道。本研究基于番木瓜的基因组和转录组数据,采用RT-PCR技术成功克隆到一个基因(),应用生物信息学手段预测蛋白的理化特性和保守基序,运用qRT-PCR分析基因的表达模式,利用缺失CorA、MgtA和MgtB的沙门氏菌突变株MM281进行功能互补。结果表明:的编码区为1332 bp,预测编码443 aa,理论分子量为50.43 kDa、等电点为5.12;该蛋白含有2个疏水跨膜区(TM1和TM2),其中TM1包含高度保守的GMN基序;进化及亚细胞定位分析表明CpMGT1与拟南芥中AtMGT1和AtMGT2的亲缘关系较近,定位于细胞膜;定量分析显示基因为组成型表达,其中在根、茎和果实中的表达量较高;在MM281中异源表达可显著提高工程菌在低Mg浓度下的生长速率,表明CpMGT1具有高效的Mg转运活性。的克隆与鉴定为进一步揭示番木瓜基因在不同组织特别是在果实中Mg的积累机制奠定了坚实的基础。
关键词:番木瓜;镁离子转运蛋白;表达分析;沙门氏菌;功能互补中图分类号:S59;S813.3 文献标识码:A
Cloning and Functional Analysis of , a Magnesium Transporter Gene from
XU YinggangZOU ZhiGUO JingyuanKONG HuaZHU GuopengGUO Anping
1. College of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. Sanya Research Institute, Chinese Academy of Tropical Agricultural Sciences, Sanya, Hainan 572024, China; 3. Hainan Key Laboratory for Biosafety Monitoring and Molecular Breeding in Off-Season Reproduction Regions / Institute of Tropical Biosciences and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Magnesium is a macronutrient that plays essential roles in plant growth, development, photosynthesis, stress response as well as other biological processes. In higher plants, it has been established that absorption, transport, distribution, and reallocation of Mg are mainly mediated by MGTs/MRS2s (magnesium transporters/mitochondrial RNA splicing2s) and MHXs (magnesium-proton exchangers). Among them, the family MGT, also known as CorA (cobalt resistance A) that was originally identified in , was most studied, especially in model plants such as arabidopsis () and rice (). By contrast, little information is available in papaya (L.), an economically important tropical crop of the Caricaceae family within Brassicales. Based on mining accessible genome and transcriptome data of papaya, in this study, a magnesium transporter gene named , which includes an open reading frame of 1332 bp, was successfully cloned using RT-PCR (reverse transcription polymerase chain reaction). Furthermore, the protein physicochemical properties and conserved motifs were investigated using bioinformatics tools, the gene expression patterns were analyzed using qRT-PCR (quantitative real-time PCR), and functional complementarity was performed through heterologous expression in mutant MM281 that lacks Mgtransporting systems (i.e. CorA, MgtA, and MgtB) and can’t grow on media containing low concentrations of Mg. Results showed that was predicted to encode 443 amino acids with a theoretical molecular weight of 50.43 kDa and an isoelectric point of 5.12; the protein was shown to contain two hydrophobic transmembrane regions (i.e. TM1 and TM2), while TM1 harbored the highly conserved GMN motif; the subcellular localization prediction suggested that the CpMGT1 protein was located in the plasma membrane, whereas the evolutionary analysis revealed that it was closely related to AtMGT1 and AtMGT2, two high affinity Mg transporters in arabidopsis; the expression analysis showed that was constitutively expressed in tissues examined, with most abundance in roots, stems, and fruits; heterologous expression of in the MM281 mutant could significantly improve the growth of engineering strain at low Mg concentrations, implying its high Mgtransport activity. Taken together, this study presents the molecular cloning and characterization of the first gene in papaya, including sequence features, physicochemical properties, evolutionary relationships, gene expression patterns as well as Mgtransport activity. These results could not only lay a solid foundation for further uncovering the accumulation mechanism of Mg in different tissues especially in the fruit, but also provide a valuable resource for genetic improvement in papaya and other species.
; magnesium transporter; expression analysis; ; functional complementarity
10.3969/j.issn.1000-2561.2022.06.003
Mg是生物體内广泛存在的二价金属阳离子,其在植物的各种生理生化过程中起重要作用。Mg具有较大的水合半径、小的离子半径和高的电荷密度,这些物理结构决定了其转运蛋白的特异性。在高等植物中,Mg的转运主要由镁离子转运蛋白(magnesium transporter/mitochondrial RNA splicing 2, MGT/MRS2)和Mg/ H交换体(magnesium-proton exchanger, MHX)介导。其中,基因最早在鼠伤寒沙门氏菌()中被发现,缺失Mg转运系统(即CorA、MgtA和MgtB)的突变株MM281无法在低于10 mmol/L Mg的N-Minimal培养基上生长。至今MGT家族成员已在拟南芥()、水稻()等植物中进行了较为深入的研究。在拟南芥的10个中,有9个基因的编码蛋白具有Mg转运活性,其中,AtMGT1、AtMGT2和AtMGT10为高亲和型,AtMGT3、AtMGT6、AtMGT7和AtMGT9为低亲和型,AtMGT5为双亲和型;对、、等突变体的研究表明,其胞质中的Mg浓度明显低于野生型。在水稻的9个家族成员中,的上调表达可明显增加细胞中的Mg浓度,从而增强植株的耐铝胁迫能力。结构分析显示,MGT蛋白序列的C-末端通常含有两个保守的疏水跨膜结构域(TM1和TM2)及位于TM1末端的三肽基序GMN(Gly-Met-Asn)。
番木瓜( L.)是一种隶属于十字花目番木瓜科的多年生常绿果树,含多种维生素、氨基酸、钾、钙、镁、铁等,被誉为“水果之王”。本研究基于番木瓜的基因组和转录组数据,对一个果实高丰度表达基因进行克隆、生物信息学及表达模式分析,并在此基础上利用沙门氏菌突变株MM281进行功能互补,以期为今后的遗传改良奠定基础。
材料与方法
材料
1.1.1 植物材料 供试番木瓜品系为中白,种植于中国热带农业科学院文昌试验基地,树龄为7个月。选取长势基本一致的植株分成3组,每组3个单株,花授粉后即进行标记,最后于同一天早上8:00之前采集授粉后10、60、120 d的果实及根、茎、叶、花等其他组织,授粉后120 d的果实用报纸包裹后置于25℃培养室中,分别放置6 h、2 d和6 d,每样品3次生物学重复,样品采集后立即放入液氮中速冻,并置于–80℃保存备用。
1.1.2 菌株及载体 大肠杆菌DH5α由本实验室保存;沙门氏菌突变株MM281和质粒Trc99A由中国热带农业科学院橡胶研究所阳江华副研究员惠赠。
1.1.3 主要试剂 反转录试剂盒PrimeScript II 1st Strand cDNA Synthesis Kit和高保真酶PrimerSTAR Max DNA Polymerase购自宝日医生物技术(北京)有限公司;胶回收试剂盒Gel Extraction Kit和质粒提取试剂盒Plasmid DNA Mini KitⅠ购自Omega Bio-Tek;各类限制性内切酶均购自美国NEB;重组克隆试剂盒ClonExpress II One Step Cloning Kit购自诺唯赞;其余试剂均为国产分析纯。
方法
1.2.1 总RNA的提取及cDNA的合成 总RNA的提取参照房平昌的方法,主要流程如下:取样品2~3 g,在液氮下用研钵研磨成细粉末;加入10 mL 65℃预热的CTAB提取液和200 mL β-巯基乙醇,涡旋剧烈混匀,65℃水浴5~20 min,中间振荡数次;待冷却到室温后加入等体积的氯仿,振荡混匀,4℃ 15 000´离心10 min;将上清液转至另一新管中,并加入等体积的水饱和酚和氯仿,充分振荡,4℃ 15 000´离心10 min(视情况重复上述步骤1~2次);将上清吸出后,加入总体积1/3的8 mol/L LiCl,–20℃冰箱放置12 h,再次离心,取上清,75%乙醇洗涤沉淀2次,沉淀用50~100 mL DEPC水溶解。质检合格后参照TAKARA反转录试剂盒说明书合成cDNA,–20℃保存待用。
1.2.2 基因克隆与载体构建 通过搜索番木瓜的基因组和转录组数据(https://www.ncbi.nlm.nih. gov/)获得的全长转录本序列,并据此设计如表1所示的3对基因特异性引物。以不同组织混合来源的cDNA作为模板,采用巢式PCR法进行扩增,首轮反应体系为PrimeSTAR Max premix 2×12.5 μL、cDNA 1 μL、F/ R各1 μL、ddHO 10.5 μL;扩增程序为95℃预变性1 min,98℃变性10 s、53℃退火25 s、72℃延伸1.5 min(35个循环),最后72℃延伸5 min。PCR产物经电泳检测后切胶回收,稀释50倍作为第二轮PCR扩增的模板,反应体系为PrimeSTAR Max premix 2×50 μL、第一轮PCR产物为cDNA 1 μL;-99F/- 99R各1 μL、ddHO 22 μL;扩增程序为95℃预变性1 min,98℃变性11 s、54℃退火25 s、72℃延伸1.5 min(25个循环),最后72℃延伸5 min。表达载体Trc99A使用限制性核酸内切酶RⅠ(10 U/mL)和Ⅰ(10 U/mL)进行酶切,切胶回收后与第二轮PCR获得的目的基因片段按1∶3比例混匀,并用同源重组酶Exnase II 37℃水浴连接2 h,然后采用冻融法转入DH5α大肠杆菌感受态细胞,菌落PCR验证后选取阳性克隆进行测序分析。
1.2.3 生物信息学分析 用在线软件Expasy(https://web.expasy.org)分析理论分子量和等电点;用NCBI CDD(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)分析保守結构域;用在线软件WoLF PSORT(https://www.genscript. com/wolf-psort.html)分析亚细胞定位;用MEGA 6.0软件中的MUSCLE进行序列比对,并用邻接法构建进化树。
1.2.4 基因的表达分析 参照邹智等的方法进行荧光定量分析,内参基因为,引物信息详见表1,使用2法计算基因的相对表达值,并用SPSS软件进行显著性差异分析。
1.2.5 沙门氏菌功能互补分析 利用化学转化法将重组质粒Trc99A-转入MM281感受态中,选取阳性单克隆摇菌,阳性对照为Trc99A- ,阴性对照为MM281突变株及转Trc99A空载的MM281突变株。摇至0.6后,加入1/10 IPTG,将菌液继续摇至1.0,并用N-Minimal培养基洗涤2~3次,分别稀释到5个浓度梯度。准备4个不同Mg浓度的N-Minimal固体培养皿,将处理好的菌液呈梯度式点至培养皿,倒置培养2~3 d后,观察长势并拍照。
结果与分析
基因克隆
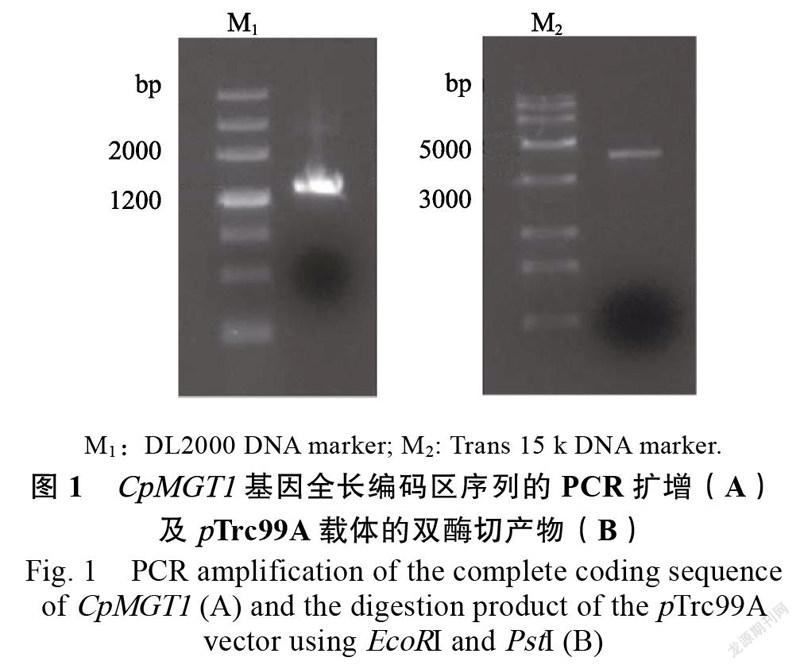
如图1所示,PCR扩增成功获得1条约1300 bp的目的条带,而Trc99A的双酶切获得1条约4100 bp的目的条带,将其孵育后构建原核表达载体Trc99A-。
2.2 生物信息学分析
序列分析表明,的编码区(CDS)为1332 bp(NCBI登录号为XM_022050807),预测编码443 aa,理论分子量(MW)为50.43 kDa,等电点(pI)为5.12。CDD分析和序列比对显示,CpMGT1含有保守的Mrs2_Mfm1p-like(cd12823)结构域;在C端含有2个疏水跨膜区(即TM1和TM2),且TM1包含高度保守的GMN基序(图2)。WoLF PSORT分析显示,CpMGT1定位在细胞膜。
2.3 进化分析
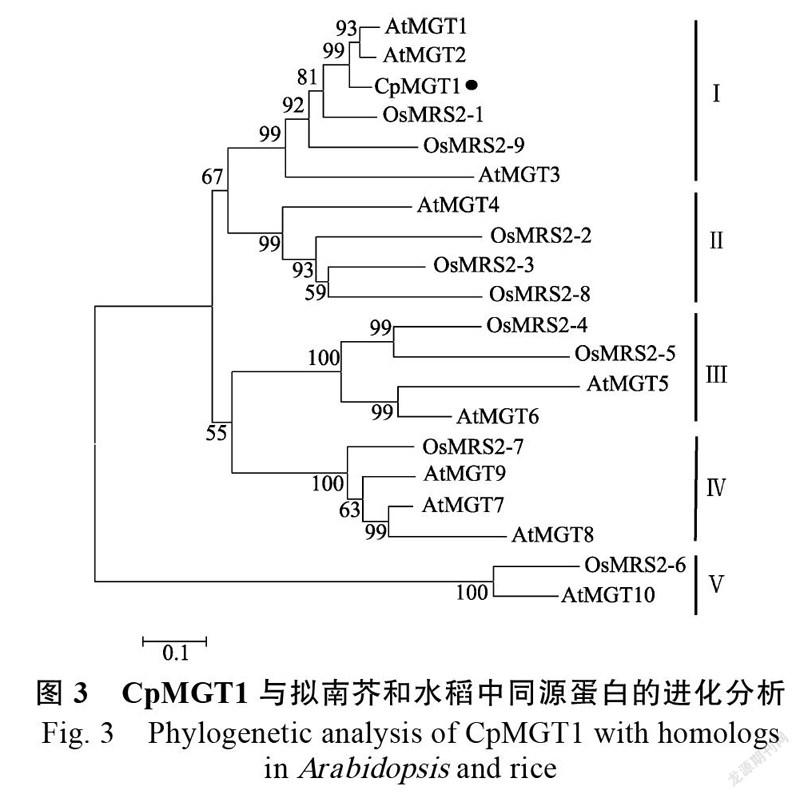
为揭示CpMGT1的进化特征,将其与已报道的拟南芥和水稻MGT蛋白构建进化树(图3)。结果表明,这些MGT被聚为5支,其中,CpMGT1与拟南芥的AtMGT1(NP_001322724)、AtMGT2(NP_001077545)、AtMGT3(NP_001118259),水稻的OsMRS2-1(XP_015643498)、OsMRS2-9(XP_015633967)聚在一起。相比而言,CpMGT1与AtMGT1和AtMGT2的相似性更高,分别为83.33%和86.04%。
2.4 基因表达分析
表达分析显示,在所分析的不同组织中均有表达,其中在根、茎和果实中的表达量相对较高(图4A)。在果实中,随着果实的发育呈现先降后升的趋势,即在授粉后120 d时相对表达量最高;采后呈现先升后降的趋势,即采后2 d相对表达量最高,但低于授粉后120 d(图4B)。
2.5 功能互补分析
为鉴定的Mg转运活性,将构建的重组质粒Trc99A-转入MM281突变株中。功能互补实验显示,实验组和对照组在10 mmol/L Mg的平板上均可正常生长。然而,当培养基中的Mg浓度降低到5 mmol/L时,阴性对照未见生长,而实验组与阳性对照长势相当。随着Mg浓度的进一步降低,实验组和阳性对照的生长虽然都呈现减弱趋势,但是趋势相当,这表明CpMGT1是与AtMGT1活性相当的高亲和型Mg转运蛋白(图5)。
讨论
植物的生长发育依赖于根系所吸收的矿质营养元素,这些元素需通过质外体和共质体途径转移到地上部组织中,这一过程不仅需要蒸腾作用的驱动,还需要各种离子通道和转运体的运输,其中包括Mg转运蛋白。在植物中,Mg转运蛋白由多个成员构成的基因家族编码,如拟南芥中含有10个成员、水稻中有9个成员、玉米中有12个成员、甘蔗中有10个成员、香蕉中有10个成员、油菜中有36个成员。对拟南芥、水稻等模式植物的深入研究表明,MGT蛋白广泛参与了Mg吸收、转运及分区储藏。
本研究首次报道了一个隶属于基因家族的番木瓜Mg转运蛋白基因,该基因编码443 aa、分子量为50.43 kDa、等电点为5.12,细胞膜定位。更重要的是,蛋白含有该家族特有Mrs2_Mfm1p-like或CorA(PFAM登陆号PF01544)结构域及位于C端疏水跨膜区TM1上的GMN基序。早前的研究表明,GMN基序为Mg转运所必需。根据基因表达分析结果,总体为一组成型表达基因,其中在根、茎和果实中的表达量较高,暗示该基因可能在多个部位发挥Mg转运功能。根据进化分析结果,CpMGT1与拟南芥中AtMGT1和AtMGT2的亲缘关系较近,相似性高达80%以上,这不仅暗示它们之间的直系同源关系及类似的生物学功能,同时,该结果跟番木瓜与拟南芥同属十字花目的分类学关系是一致的。前人的研究结果表明,和均可互补沙门氏菌突变株MM281,且二者均编码高亲和型Mg转运蛋白。AtMGT1定位于细胞质膜,具有较高的组织特异性,主要在根部和表皮中表达;基因表达受Al

诱导,其过量表达可增强转基因植株对铝毒的抗性。AtMGT2定位于液泡膜,主要在幼嫩叶片中发挥Mg转运功能,并与AtMGT3共同维持叶肉细胞中液泡的Mg平衡。此外,有研究显示,还能互补Mg转运缺陷型酵母突变株CM66,并显著提高酵母的生长效率。与进化结果相应的是,的异源过表达可互补MM281突变株,并显著提高工程菌在低Mg浓度下的生长速率,这初步证实编码一个高亲和的Mg转运蛋白,且其活性与AtMGT1相当。虽然如此,具体是如何调控Mg平衡的分子机制还有待深入研究。
综上,本研究完成了番木瓜基因的克隆及序列特征、进化关系、表达模式和Mg转运活性分析。这些结果不仅为进一步揭示番木瓜基因在不同组织特别是在果实中Mg的积累机制奠定了坚实的基础,也为今后的品种改良提供了宝贵的资源。
参考文献
- 郭照辉, 张德元, 毛丹丹, 李咏梅. 植物Mg转运蛋白与相关基因及其功能的研究进展[J]. 生命科学研究, 2008, 12(3): 4.GUO Z H, ZHANG D Y, MAO D D, LI Y M. Progress on the function of magnesium transport proteins and genes in plant[J]. Life Science Research, 2008, 12(3): 4. (in Chinese)
- 张 岗, 翟清华, 张大为, 胡本祥, 郭顺星. 铁皮石斛镁离子转运蛋白基因的克隆及表达分析[J]. 中草药, 2014, 45(23): 3443-3448.ZHANG G, ZHAI Q H, ZHANG D W, HU B X, GUO S X. Cloning and expression analysis of a magnesium transporter gene in [J]. Chinese Herbal Medicine, 2014, 45(23): 3443-3448. (in Chinese)
- SZEGEDY M A, MAGUIRE M E. The CorA Mg transport protein of [J]. Journal of Biological Chemistry, 1999, 274(52): 36973-36979.
- PAPP-WALLACE K M, NARTEA M, KEHRES D G, PORWOLLIK S, MCCLELLAND M, LIBBY S J, FANG F C, MAGUIRE M E. The CorA Mg channel is required for the virulence of serovar Typhimurium[J]. Journal of Bacteriology, 2008, 190(19): 6517-6523.
- 叢悦玺. 拟南芥镁胁迫突变体筛选及镁毒害响应机制初探[D]. 杭州: 浙江大学, 2012.CONG Y X. Screening of magnesium stress mutants and the mechanism of the plant responding to magnesium toxicity in [D]. Hangzhou: Zhejiang University, 2012. (in Chinese)
- SAITO T, KOBAYASHI N I, TANOI K, IWATA N, SUZUKI H, IWATA R, NAKANISHI T M. Expression and functional analysis of the CorA-MRS2-ALR-Type magnesium transporter family in rice[J]. Plant and Cell Physiology, 2013, 54(10): 1673-1683.
- 赵智芳. 梨镁离子转运体家族分析及的功能验证[D]. 南京: 南京农业大学, 2016.ZHAO Z F. Family analysis of magnesium transporter in pear and functional verification of [D]. Nanjing: Nanjing Agricultural College, 2016. (in Chinese)
- CONN S J, CONN V, TERMAN S D, KAISER B N, LEIGH R A, GILLIHAM M. Magnesium transporters, MGT2/ MRS2-1 and MGT3/MRS2-5, are important for magnesium partitioning within mesophyll vacuoles[J]. New Phytologist, 2011, 190(3): 583-594.
- 房平昌. 橡胶树己糖激酶在胶乳再生中基因鉴定及功能分析[D]. 绵阳: 西南科技大学, 2021.FANG P C. Gene identification and functional analysis of hexokinase involoving in the latex regeneration of [D]. Mianyang: Southwest University of Science and Technology, 2021. (in Chinese)
- 邹 智, 郭运玲, 孔 华. 橡胶树叶片衰老相关基因的克隆与表达分析[J]. 西南林业大学学报(自然科学), 2021, 41(4): 42-48.ZOU Z, GUO Y L, KONG H. Cloning and expression analysis of , a gene associated with leaf senescence in rubber tree ( Muell. Arg.)[J]. Journal of Southwest Forestry University (Natural Science), 2021, 41(4): 42-48. (in Chinese)
- DAVID-ASSAEL O, SAUL H, SAUL V, MIZRACHY- DAGRI T, BEREZIN I, BROOK E, SHAUL O. Expression of , an vacuolar metal transporter, is repressed by the 5' untranslated region of its gene[J]. Journal of Experimental Botany, 2005, 56(413): 1039-1047.
- LI L, TUTONE A F, DRUMMOND R S, GARDNER R C, LUAN S. A novel family of magnesium transport genes in [J]. The Plant Cell, 2001, 13(12): 2761-2775.
- WHITEMAN S A, SERAZETDINOVA L, JONES A M, SANDERS D, RATHJEN J, PECK S C, MAATHUIS F J. Identification of novel proteins and phosphorylation sites in a tonoplast enriched membrane fraction of [J]. Proteomics, 2008, 8(17): 3536-3547.
- 邓沛怡, 田连福, 陈 键, 栾 升, 李东屏. 拟南芥基因转运功能研究[J]. 生命科学研究, 2007(4): 328-333.DENG P Y, TIAN L F, CHEN J, LUAN S, LI D P. The functional analysis of , a member of putative Mg transporter family in [J]. Life Science Research, 2007(4): 328-333. (in Chinese)
- MAO D D, TIAN L F, LI L G, CHEN J, DENG P Y, LI D P, LUAN S. : An gene encoding a low-affinity magnesium transporter[J]. Journal of Integrative Plant Biology, 2008, 50(12): 1530-1538.
- CHEN Z C, YAMAJI N, MOTOYAMA R, NAGAMURA Y, MA J F. Up-regulation of a magnesium transporter gene is required for conferring aluminum tolerance in rice[J]. Plant Physiology, 2012, 159(4): 1624-1633.
- ZHANG L, WEN A, WU X, PAN X, WU N, CHEN X, CHEN Y, MAO D, CHEN L, LUAN S. Molecular identification of the magnesium transport gene family in [J]. Plant Physiology and Biochemistry, 2019(136): 204-214.
- BOSE J, BABOURINA O, SHABALA S, RENGEL Z. Low-pH and aluminum resistance in correlates with high cytosolic magnesium content and increased magnesium uptake by plant roots[J]. Plant and Cell Physiology, 2013, 54(7): 1093-1104.
- DENG W, LUO K, LI D, ZHENG X, WEI X, SMITH W, THAMMINA C, LU L, LI Y, PEI Y. Overexpression of an magnesium transport gene, , in confers Al tolerance[J]. Journal of Experimental Botany, 2006, 57(15): 4235-4243.
