不同因素对油茶未授粉子房愈伤组织诱导的影响
2022-07-20靳皓然鲁建军张紫缇盘鑫海袁德义范晓明
靳皓然,鲁建军,余 安,何 杰,张紫缇,盘鑫海,袁德义,范晓明
(1. 中南林业科技大学 经济林育种与栽培国家林业和草原局重点试验室,湖南 长沙 410004;2. 长沙市林木种苗管理站,湖南 长沙 410399)
油茶Camellia oleifera为山茶科Theaceae 山茶属Camellia植物,被誉为“东方的橄榄树”,是我国南方地区重要的木本食用油料树种之一,和油棕、椰子、油橄榄并称为世界四大木本油料树种[1-3]。油茶种植利用历史悠久,广泛分布于中国中南部的低山丘陵地区,在东南亚北部如泰国等地也有种植[4-6]。然而,低产低效长期制约着油茶产业的健康高效发展[7]。其主要原因是优良品种短缺,而传统的无性系选育和杂交育种方法均存在育种周期长、性状不稳定等问题[8]。利用单倍体诱导可以加快育种进程,获得所需性状的纯合体,加快优良品种的选育。
植物组织培养技术是人工获得单倍体的重要途径之一,包括通过离体培养花药或花粉诱导小孢子发育和通过离体培养未授粉子房或胚珠诱导卵细胞发育[9]。子房的离体培养研究可以追溯到1979 年,Noeum 首次通过培养大麦未授粉子房获得单倍体植株,并提出将这一过程定义为“雌核发育”[10]。经过近半个世纪的发展,未授粉子房培养已经被证明是一种有效缩短育种年限的方法,可快速筛选纯合子材料的优势使之受到广泛关注[11]。目前,通过培养未授粉的雌核,已获得许多植物的单倍体,如洋葱、黄瓜、非洲菊、柑橘等[12-15]。
前人对油茶花药进行了30 多年的离体培养,但未能获得再生植株[8,16-18],说明该方法具有较大的挑战性。关于油茶未授粉子房的离体培养研究鲜见报道。愈伤组织是由散乱细胞组成的无定形去分化组织,影响其诱导、离体培养和发育的因素包括外植体类型、激素、培养基组成、培养温度和培养基pH 等[19]。在未授粉子房培养中,单倍体再生植株的获得取决于预处理方式、雌配子体发育时期和培养基组成等因素。本研究中探讨了油茶未授粉子房愈伤组织诱导的影响因素,包括子房消毒灭菌方法、切割方式、发育时期、预处理方式和激素配比,以期为以油茶未授粉子房诱导再生单倍体植株提供参考。
1 材料与方法
1.1 试验材料
试验材料取自中南林业科技大学油茶种质资源圃无病虫害的‘华硕’健康植株。2020 年11—12 月晴朗天气的上午9:00—11:00,采集不同发育时期的未授粉花蕾,放在冰盒中带回试验室。除预处理对照组所需花蕾外,其余花蕾均在使用前采集。
1.2 试验设计
将外植体使用75%乙醇溶液消毒30 或60 s,使用0.1%升汞溶液或10%次氯酸钠溶液消毒5、10 或15 min,放入培养瓶中培养1、7 d 后,观察其染菌率和褐化情况,筛选最佳消毒方式;选择0.3 mg/L 生长素(NAA、IAA、IBA、2,4-D)和3 mg/L 细胞分裂素(6-BA、KT、TDZ)两两组合添加在培养基中,筛选适宜的激素种类;选择横切、纵切、切喙和不切4 种方式处理子房外植体,探索切割方式对子房愈伤组织诱导率的影响[20-21];分别以开花前倒数第7 天、倒数第3 天、倒数第1 天和开花当天的花蕾子房为外植体,筛选适宜的子房发育时期[22-24];将未授粉花蕾在4、35 ℃黑暗条件下,持续处理1 或2 d,研究预处理对子房愈伤组织诱导的影响。每次试验均采用前一次试验的最佳处理。
采用愈伤组织诱导率最高的生长素和细胞分裂素组合,并在培养基中添加不同质量浓度(40、50、60 g/L)的蔗糖,进行L9(33)正交试验,探索诱导子房愈伤组织的该激素组合及蔗糖的最佳浓度。
1.3 试验方法
1.3.1 外植体处理
将花蕾用流水冲洗20 min,在无菌条件下剥离花瓣、萼片和花柱等部分,仅剩子房。先用无菌水冲洗子房3 ~5 次,再用75%乙醇溶液消毒,无菌水冲洗3 ~5 次,然后用0.1%升汞溶液或10%次氯酸钠溶液消毒,其间不断振荡,最后用无菌水冲洗3 ~5 次。将子房放在滤纸上晾干水分,进行切割处理后接种在培养基上。
1.3.2 培养基配制
以MS 培养基为基础培养基,用7 g/L 琼脂固化,用1 mol/L 稀HCl 或NaOH 溶 液 将pH 调 至5.4 ~5.6。将培养液分成每份30 ~40 mL,置于121 ℃高压灭菌锅中灭菌20 min。
1.3.3 培养条件
每瓶接种2 个子房,每组处理接种4 个培养瓶,重复3 次。置于(26±2) ℃光照培养室中,在一定光周期(光照16 h,黑暗8 h)下培养,使用冷白光LED 灯管,光照强度为2 000 lx。
1.4 数据分析
30 d后统计子房的愈伤组织诱导率和褐化率。愈伤组织诱导率为诱导出愈伤组织的外植体数量占接种外植体数量的百分比;褐化率为褐变子房或愈伤组织数量占接种子房数量的百分比。
使用Photoshop 软件处理照片,使用Microsoft Excel 软件制作图片,使用SPSS 26.0 软件进行差异性检验和LSD 多重比较。
2 结果与分析
2.1 消毒处理对油茶子房褐化和染菌的影响
采用不同的消毒剂处理不同时长后,子房产生了不同程度的褐化反应。将子房的褐化程度分为4 个等级,分别为正常、轻度褐化、中度褐化和重度褐化,若褐化程度在2 个等级之间,则归入较严重的褐化等级,消毒7 d 后不同褐化程度的子房如图1 所示。不同消毒方式处理下油茶子房的褐化率和染菌率见表1。

图1 不同褐化程度的子房Fig. 1 Different degrees of browning of ovary
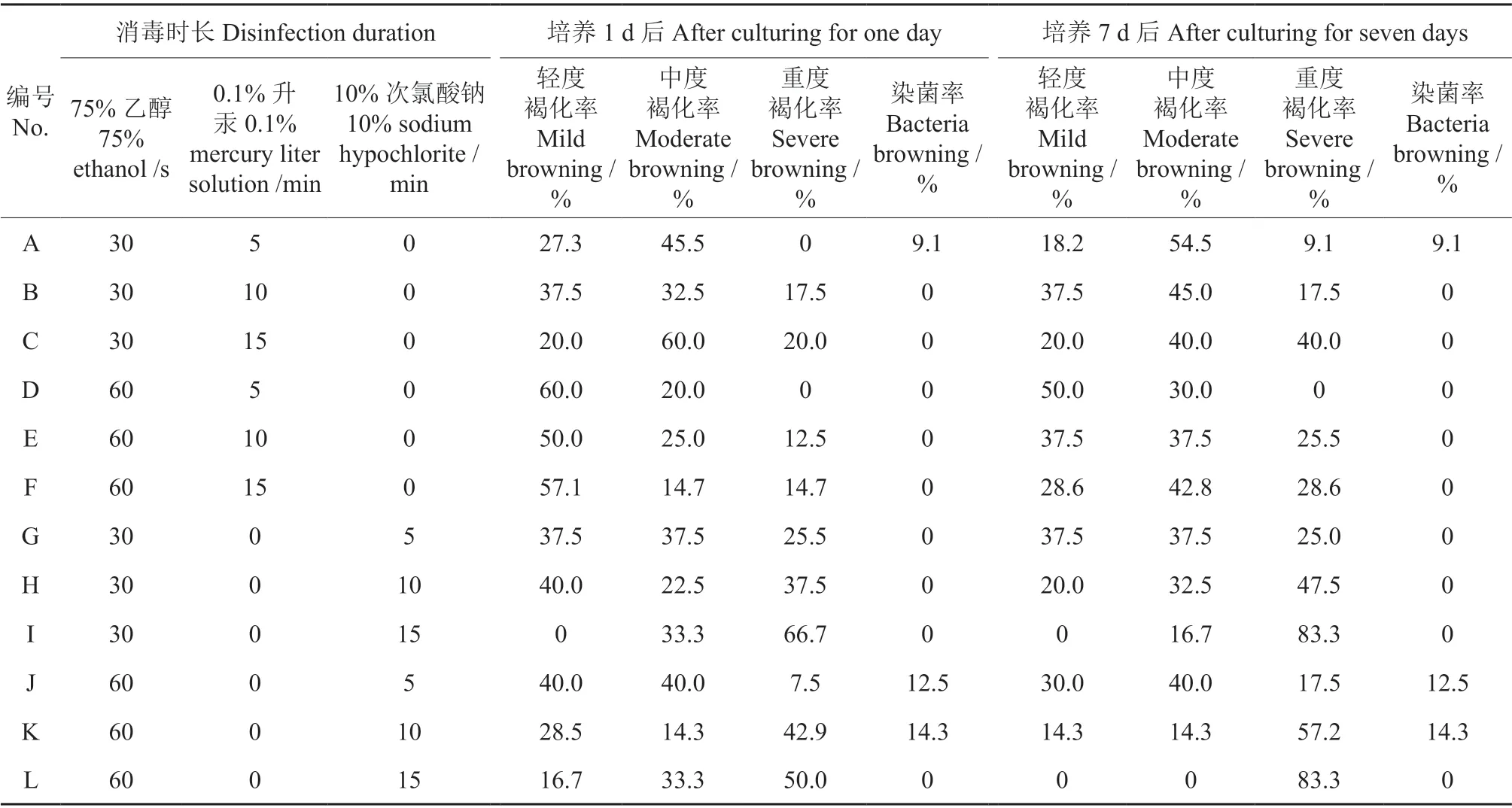
表1 不同消毒方式处理中油茶子房的褐化率和染菌率Table 1 Browning rate and infection rate of ovaries of C. oleifera treated by different disinfection methods
从表1 可以看出,D 处理的效果最好,即用75%乙醇溶液消毒60 s 和0.1%升汞溶液消毒5 min。D 组处理中,消毒1 d 后正常子房和轻度褐化子房的比例为80.0%,感染率为0;消毒7 d 后正常子房和轻度褐化子房的比例为70.0%,感染率仍为0。用其他消毒方式处理的子房的褐化程度较严重,少部分出现染菌情况。因此,75%乙醇溶液消毒60 s 和0.1%升汞溶液消毒5 min 的组合为最合适的消毒灭菌方式。
2.2 激素对油茶子房愈伤组织诱导的影响
不同激素组合处理下油茶子房的愈伤组织诱导情况见表2。由表2 可以看出,各激素组合对子房愈伤组织诱导的影响显著。在12 组处理中,C组处理(NAA 和TDZ 组合)的子房愈伤组织诱导率最高,为63.89%。

表2 不同激素组合处理下油茶子房的愈伤组织诱导情况†Table 2 Callus induction of C. oleifera ovary under different hormone combinations
同时,激素种类对愈伤组织的形态和生长速率也有影响,不同激素组合处理下油茶子房愈伤组织的形态如图2 所示。由图2 可以看出:C 组处理的愈伤组织呈浅绿色,质地紧密,生长速度中等;I 组处理的愈伤组织诱导率虽然低于C 组,但愈伤组织同样呈浅绿色,质地紧密。由于C 组和I 组处理均使用了TDZ,因此推测TDZ 对形成良好的愈伤组织有一定的促进作用。综合来看,NAA和TDZ 组合更适合油茶子房愈伤组织的诱导。

图2 不同激素组合处理下油茶子房愈伤组织的形态Fig. 2 Morphology of C. oleifera ovary callus treated with different hormone combinations
2.3 切割方式对油茶子房愈伤组织诱导的影响
不同切割方式处理下油茶子房的愈伤组织诱导情况见表3。由表3 可以看出,横切、纵切、切喙和不切割对子房愈伤组织诱导率影响的差异显著。在4 种切割方式处理中:纵切处理的子房愈伤组织诱导率最高,为64.58%;切喙处理的效果最差,诱导率仅为8.33%。其原因可能是切喙处理未能使胚珠暴露出来,愈伤组织的诱导受限,纵切子房时产生的创面较大,可以使胚珠充分暴露出来,刺激了愈伤组织的发生。由此可知,纵切子房可有效提高油茶子房的愈伤组织诱导率。

表3 不同切割方式处理下油茶子房愈伤组织的诱导情况†Table 3 Induction of C. oleifera ovary callus under different cutting methods %
2.4 发育时期对油茶子房愈伤组织诱导的影响
所选取4 个发育时期的油茶花蕾的外部形态如图3 所示,开花前随时间推移逐渐露白,开花当天花瓣打开。

图3 不同发育时期油茶花蕾的外部形态Fig. 3 External morphology of C. oleifera bud at different development stages
不同发育时期采样处理下子房愈伤组织的诱导情况见表4。由表4 可以看出,子房的发育时期对愈伤组织诱导率的影响有显著差异。其中:采集开花当天花蕾处理中,子房愈伤组织诱导率最高,可达66.67%;采集开花前倒数第7 天、倒数第1 天的花蕾处理中诱导率次之,分别为47.92%和45.04%。开花当天,子房发育为7 细胞8 核的成熟胚囊结构,更容易诱导成功。因此,以开花当天的子房为外植体时,愈伤组织诱导率更高。

表4 不同发育时期采样处理下子房愈伤组织的诱导情况†Table 4 Induction of ovary callus under sampling treatments at different developmental stages %
2.5 预处理对油茶子房愈伤组织诱导的影响
不同预处理下(2 组冷处理和2 组热处理,以不进行预处理为空白对照组)油茶子房愈伤组织的诱导情况见表5。由表5 可以看出,预处理对油茶子房愈伤组织的诱导有显著影响。其中:将花蕾在35 ℃热处理1 d 后,子房的愈伤组织诱导率最高,达到70.83%;其次为空白对照组,诱导率为64.58%。将花蕾在35 ℃处理2 d 后,子房干枯死亡,无法产生愈伤组织。将花蕾在4℃预处理1 d后,子房的褐化率最低,可能是低温抑制了酚类物质的合成,减缓了褐化。因此,在35 ℃条件下预处理花蕾1 d 可以提高子房愈伤组织的诱导率。

表5 不同预处理下油茶子房愈伤组织的诱导情况†Table 5 Induction of C. oleifera ovary callus under different pretreatments %
2.6 激素和蔗糖组合处理对油茶子房愈伤组织诱导的影响
在L9(33)正交试验中,激素和蔗糖组合处理下油茶子房愈伤组织的诱导情况见表6。由表6 可以看出,激素配比对愈伤组织诱导有显著影响。在9 组处理中,子房愈伤组织的诱导率为13.89%~72.34%。其中,D 组处理(NAA 0.3 mg/L+TDZ 2 mg/L)的愈伤组织诱导率最高,为72.34%。
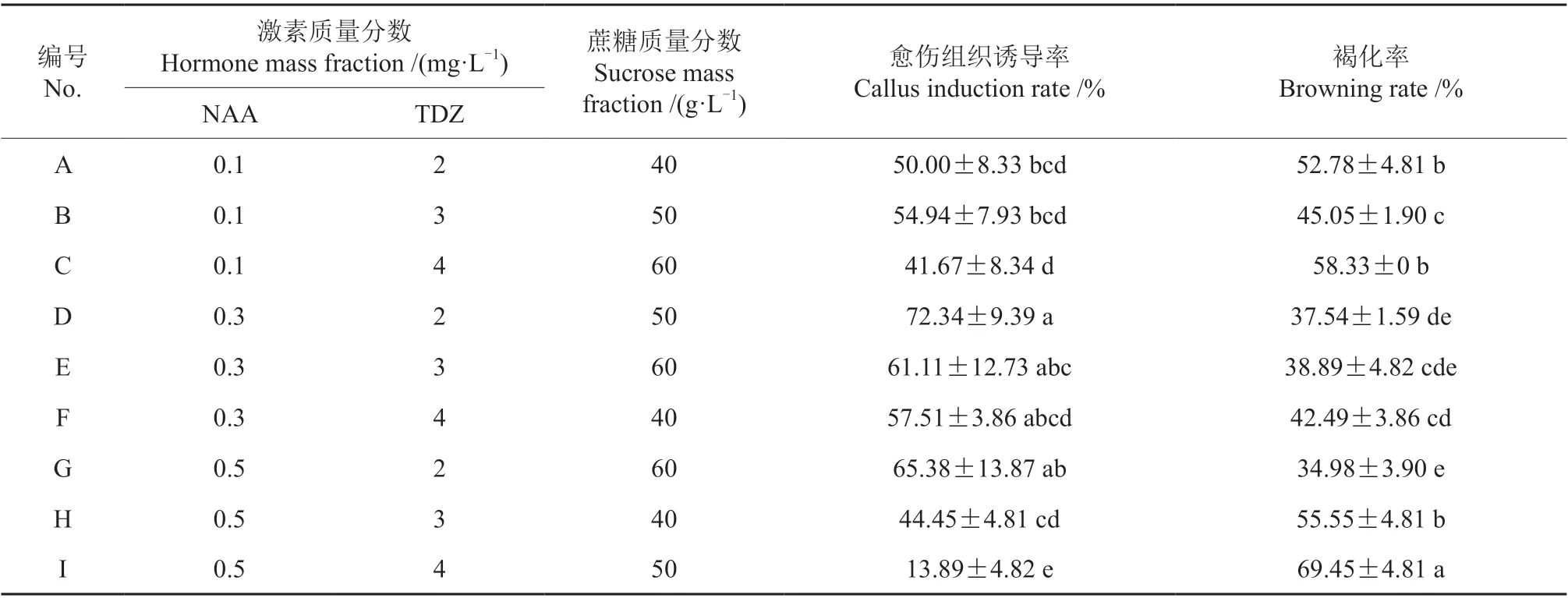
表6 激素和蔗糖组合L9(33)正交试验中油茶子房愈伤组织的诱导情况†Table 6 Induction rate of C. oleifera ovary callus in the L9 (33)orthogonal test of hormone and sucrose combination
对愈伤组织诱导率进行极差分析,结果见表7。由表7 可以看出,在3 个试验因子中,TDZ 对诱导率极差的影响最大,诱导率极差为24.88%,其次为NAA,诱导率极差为22.41%,蔗糖对诱导率的影响最小,诱导率极差仅为8.99%。最优处理组合为A2B1C3,即NAA 0.3 mg/L,TDZ 2 mg/L,蔗糖60 g/L。

表7 正交试验中油茶子房愈伤组织诱导率的极差分析结果Table 7 Result of range analysis of callus induction rate of C. oleifera ovary in orthogonal experiment
对愈伤组织诱导率进一步进行方差分析,结果见表8。由表8可以看出,2种激素NAA(F=8.232,P<0.05)和TDZ(F=10.054,P<0.05)对 诱导率的影响显著,蔗糖对诱导率的影响不显著(F=1.299,P>0.05)。因此,油茶子房愈伤组织诱导的最佳培养基为MS+60 g/L 蔗糖+7 g/L 琼脂+0.3 mg/L NAA+2 mg/L TDZ。
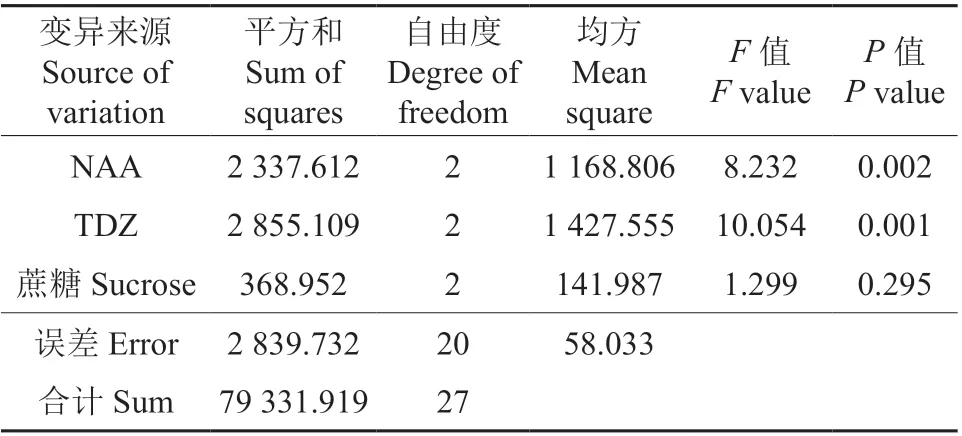
表8 正交试验中油茶子房愈伤组织诱导率的方差分析结果Table 8 Result of variance analysis of callus induction rate of C. oleifera ovary in orthogonal experiment
3 结论与讨论
本试验结果表明:油茶未授粉子房和胚珠离体培养的影响因子有激素的种类和浓度、子房发育时期、切割方式、预处理方式等。其中激素种类和浓度对愈伤组织的诱导有显著影响,诱导率最高的激素组合为NAA 和TDZ;纵切子房的创伤面暴露更大,愈伤组织诱导率最高,为64.58%;开花当天花蕾的胚囊发育成熟,较开花前花蕾的子房愈伤组织诱导率更高,为66.67%;冷(4 ℃)预处理虽然降低了褐化率,但诱导率不如热激(35 ℃)预处理的效果好,最佳预处理方式是热激(35 ℃)预处理1 d;对NAA、TDZ、蔗糖进行正交试验的结果表明,TDZ 对诱导率的影响高于NAA,蔗糖影响最小,NAA 0.3 mg/L、TDZ 2 mg/L和蔗糖60 g/L 组合处理的愈伤组织诱导率最高,为72.34%。因此,在本试验中愈伤组织诱导效果最好的处理是选择开花当天的花蕾,热激(35 ℃)预处理1 d 后,无菌条件下剥出子房,并使用乙醇(60 s)和升汞(5 min)消毒,纵切后接种到MS+60 g/L 蔗糖+7 g/L 琼脂+0.3 mg/L NAA+2 mg/L TDZ 培养基上,培养30 d 后子房的愈伤组织诱导率可达72.34%。
3.1 未授粉油茶子房消毒处理的最佳方式
子房消毒是诱导愈伤组织的前提,合适的消毒方式需要在抗褐化和杀菌之间保持平衡。消毒过度可能导致外植体发生褐变,但消毒不足可能导致外植体染菌。常见的消毒剂包括乙醇溶液、升汞溶液和次氯酸钠溶液,其适宜浓度因植物种类的不同而有异。Zhang 等[25]采用75%乙醇溶液消毒50 s 和10%次氯酸钠溶液消毒15 ~20 min 的方法处理油茶种子,诱导率较高;Zou 等[20]以西瓜子房为材料,首先用75%乙醇溶液消毒1 min,切片后再用2%次氯酸钠溶液消毒2 min,效果较好。本试验中使用75%乙醇溶液与10%次氯酸钠溶液或0.1%升汞溶液进行组合消毒,结果显示,使用乙醇溶液消毒60 s 和0.1%升汞溶液消毒5 min 的处理中,子房的褐化率和感菌率均最低。说明此消毒方法不但杀菌效果好,且较少造成外植体褐变。
3.2 未授粉油茶子房诱导愈伤组织的影响因素
激素种类和浓度是影响愈伤组织诱导的关键因素。Fehér 等[26]的研究结果表明,生长素和细胞分裂素是参与调节植物细胞分裂和分化的主要激素。Deng 等[13]认为,离体雌核培养的目的是使雌配子体细胞从配子体发育途径向孢子体发育途径转变,添加激素可以有效地促进雌核发育。在本试验中,TDZ 浓度对子房愈伤组织的诱导率有显著影响,正交试验中添加2 mg/L TDZ 的D组和G 组处理的愈伤组织诱导率较高。据报道,用TDZ 诱导子房培养胚时,黄瓜植株再生频率最高[27-28]。因此TDZ 在离体雌核培养中有一定的积极作用。
子房切割方式、子房发育时期、预处理方式等因素对油茶子房和胚珠愈伤组织的诱导也有显著影响。本试验所选用的4 种子房切割方式中,纵切子房的愈伤组织诱导率最高,为64.58%,切喙子房的愈伤组织诱导率最低,仅为8.33%。陈学军等[21]认为:一方面,可能是切喙未能使胚珠外露,影响愈伤组织的产生;另一方面,纵切面处创面较大,胚珠外露能够更好地吸收营养物质,易刺激愈伤组织形成。子房发育时期对诱导愈伤组织也有重要影响,开花当天的子房是诱导愈伤组织的最佳材料,此时油茶子房发育处于7 细胞8 核成熟胚囊阶段[29-30]。Sorntip 等[31]经研究发现,选用开花当天的黄瓜子房进行离体培养,愈伤组织诱导率最高,与本试验结果一致。对外植体进行预处理是单倍体育种中经常使用的方法,预处理可改变外植体细胞的生理生化状态、细胞分裂方式或细胞发育状态,从而影响愈伤组织的诱导率[32]。王文英等[33]的研究结果表明,低温通过改变雌配子体的发育途径,促进单倍体胚的形成,热激处理也会促进愈伤组织和胚状体的形成。Golabadi 等[34]认为热激预处理显著提高了愈伤组织的诱导率。在试验中,经热激(35 ℃)预处理1 d 的油茶子房的愈伤组织诱导率最高,但与空白对照组无显著差异。低温预处理虽显著降低了子房褐化率,但也降低了愈伤组织诱导率,这可能是由于油茶花期在10 月下旬—12 月初[35],适宜的温度为10 ~15 ℃,冷处理抑制了酚类物质的生成,降低了褐化率。而热激预处理破坏了其内部结构,不能显著提高愈伤组织的诱导率。
通过对油茶未授粉子房的消毒方式和愈伤组织诱导的影响因素进行探索分析,初步得出子房最佳消毒方式,发现激素是影响愈伤组织诱导的关键因素且TDZ 的影响大于NAA,另外筛选出了愈伤组织诱导率较高的子房发育时期、切割方式、预处理方式等培养条件。但本研究中涉及的影响因素不够全面,后续将选取更多可能影响愈伤组织诱导率的因素进行试验,并探索因素间的相互作用,筛选子房愈伤组织诱导的最适条件,为建立油茶离体雌核单倍体诱导体系提供参考。
