外源钙缓解花生亚低磷光合障碍的机制
2022-07-18孙志宇刘欣悦张思威马明珠易伯涛韩晓日刘轶飞
孙志宇,刘欣悦,张思威,马明珠,白 蕊,刘 欢,易伯涛,韩晓日,刘轶飞
(沈阳农业大学土地与环境学院/土肥高效利用国家工程研究中心,辽宁 沈阳 110866)
磷是地球上所有生物维持生命所必需的元素,也是植物中核酸、蛋白质、磷脂、ATP、ADP以及各种含磷酶的重要组分[1–3],因此,磷对作物生长发育和产量形成至关重要[4]。然而,磷限制是全世界作物生产中的主要制约因素之一,同时化学磷肥来自于磷酸盐矿石,这也是一种极其有限的不可再生资源[5–6]。全球大约 70% 的耕地缺乏有效磷[7–8],但是磷肥当季利用率却仅有10%左右,没有被作物吸收利用的磷肥也引发了许多严重的环境污染问题[9]。喜磷喜钙作物—花生 (ArachishypogaeaL.)是国际重要油料经济作物,尤其在维持我国粮油安全上具有举足轻重的地位[10–14]。特别是,基于后疫情时代“双循环”新发展格局下、中国大豆产需缺口加大等背景下,我国明确了油料作物结构调整主要策略之一,就是多措并举发展国内花生生产部分替代大豆进口[15]。因此,我国油料作物供给 (食用油)安全和国际新形势新挑战已然将花生产业绿色发展推到一个前所未有的国家战略安全高度[13, 14, 16]。值得注意的是,我国花生中低产田面积大,尤其土壤有效磷多处于花生低磷 (<10 mg/kg)或者亚低磷 (17.5±7.5) mg/kg 胁迫状态下[10, 17–19],这严重制约着花生产业的可持续发展。
光合作用是对钙、磷养分变化最为敏感的代谢过程之一,同时也是花生生长发育和产量形成的基础[10, 19–22]。钙离子作为第二信使,在植物逆境适应性调节方面具有重要作用[23–25]。研究表明,增加外源钙素供应可以改善大豆、木豆、豇豆、瓜尔豆等的磷素吸收利用效率[26–28]。另外,叶面喷施外源钙也可促进低夜温胁迫下花生根、茎、叶的生长和磷素积累,并且外源钙激发了花生叶片的环式电子传递,提高了叶绿体ATP合酶活性[20]。钙被认为参与了卡尔文本森循环(Calvin-Benson-Bassham,CBB)中关键酶的调节,钙可介导CBB循环酶来调控光合作用[29]。磷素对光合器官进行光合碳同化作用是必不可少的,特别是花生中低产田有效磷多处于花生亚低磷胁迫状态,显著影响花生的叶片生长、相对叶绿素含量和光合物质积累,显著减少了花生叶面积和比叶质量,并造成了花生叶片光合碳同化障碍和光抑制[10],而生产中发现,增施钙肥可有效改善中低产田花生的生长发育、磷素利用效率和产量[14, 28, 30–32],但是其作用机制尚待探究。为此,本研究将主要探讨外源钙对亚低磷胁迫下花生生长发育和光合作用的影响,以期明确外源钙缓解花生亚低磷光合障碍的关键生理机制,旨在为花生高产栽培及优化养分管理技术提供理论基础和技术指导。
1 材料与方法
1.1 试验设计
试验于2020年在沈阳农业大学土地与环境学院人工气候室内进行,以花生(ArachishypogaeaL)品种‘辽宁白沙’为试验材料,温汤浸种催芽,花生带芽单粒播种于砂培盆(外径14 cm、底径9.2 cm、高12 cm)中,每两天浇透全量Hoagland’s营养液,采用人工气候室盆栽培养2周。人工气候室温度、湿度、光照的设置参数:昼间为[28℃、60%、600 μmol/(m2·s)],夜间为 [20℃、60%、0 μmol/(m2·s)],气候室内 CO2浓度始终设置为 (400±5) μmol/mol。在第14天,每盆浇透ddH2O (1.5 L)洗盐,砂培盆底孔(5个孔)自然外排。基于Hoagland’s营养液,本课题组前期筛选出了花生亚低磷胁迫浓度[–P,0.5 mmol/L,相当于花生中低产田土壤有效磷(15.5±3)mg/kg]及正常磷浓度营养液(CK,1 mmol/L,相当于花生高产田土壤有效磷≥30 mg/kg)[10],在不同磷浓度水平下使用KNO3和NH4NO3来平衡氮、钾浓度。在第15天,开始进行花生中低产田亚低磷胁迫模拟试验,选取人工气候室内长势整齐一致的盆栽花生幼苗100株,并平均分为四组,即:1) CK,正常磷营养液 (P 1 mmol/L)+喷清水对照;2) –P,亚低磷胁迫 (P 0.5 mmol)+喷清水;3) –P+Ca,亚低磷胁迫+叶面喷施 CaCl215 mmol/L;4)–P+TFP,亚低磷胁迫+钙调蛋白CaM抑制剂—三氟啦嗪(trifluoperazine, TFP)。每天早7:00浇透CK或者–P营养液(多余营养液底孔自然排出),并且早8:30对应以上各个处理,进行叶面均匀喷施ddH2O、CaCl2和TFP等。花生中低产田亚低磷胁迫试验处理10天,在亚低磷胁迫处理的第9天进行活体指标测定,在亚低磷胁迫处理的第10天进行破坏性取样。
1.2 花生植株干物质重、叶面积、相对叶绿素含量及叶片气体交换参数的测定
在亚低磷胁迫处理的第10天,使用便携式叶面积仪 AM-300 (ADC BioScientific,UK)测定各处理花生单株叶面积,记录参数,将植株洗净后放入牛皮纸袋,于电热恒温鼓风干燥箱DHG-9204A (上海精宏)中105℃杀青30 min后,65℃下烘干至恒重,使用千分之一天平测量各处理花生植株干物质重,记录参数。相对叶绿素含量采用叶绿素仪(SPAD-502 plus,日本)测定。
在亚低磷胁迫处理的第9天上午10:00,使用高级光合测量系统 GFS-3000 (Heinz Walz, Effeltrich,Germany)测量各处理花生倒三叶位置叶片的相关气体交换参数。测定时参数设置为:叶室面积3 cm2,CO2浓度 400 μmol/mol,测定光强 600 μmol/(m2·s)。CO2浓度通过二氧化碳钢瓶保持稳定。分别记录各处理花生叶片的净光合速率(net photosynthetic,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、胞间 CO2浓度 (intercellular CO2concentration,Ci)。
1.3 慢速叶绿素荧光诱导动力学曲线和P700活性的测定
在亚低磷胁迫处理的第9天,使用调制叶绿素荧光仪 Dual-Pam 100 (Heinz Walz, Effeltrich, Germany)对花生倒三叶位置叶片的叶绿素荧光和P700活性进行测量。待测花生植株暗适应30 min后,选择同时测量PSⅡ 和PSⅠ的Fluo+P700测量模式,分析模式选择SP-Analysis,测量开始后,打开测量光,测量光很弱,小于 1 μmol/(m2·s),只激发色素的本底荧光但不足以引起任何的光合作用,记录最小荧光(FO)。之后打开一次饱和脉冲,记录最大荧光(Fm)。关闭饱和脉冲后,荧光迅速回到FO附近,之后打开光化光,期间以30 s为周期打开一次饱和脉冲,记录最大荧光(Fm),待荧光稳定后记录稳定荧光(Fs),300 s后荧光曲线处于稳态,关闭光化光,待荧光值稳定后记录最小荧光(F′o),结束测量程序。测量的PSⅡ荧光参数包括:PSⅡ最大量子产量Fv/Fm、PSⅡ实际量子产量Y(Ⅱ)、PSⅡ非调节性能量耗散的量子产量Y (NO)、PSⅡ调节性能量耗散的量子产量Y (NPQ)。测量的PSⅠ参数包括:PSⅠ实际量子产量Y(Ⅰ)、由PSI供体侧限制引发的非光化学能量耗散的量子产量Y(ND)、由PSⅠ受体侧限制引发的非光化学能量耗散的量子产量Y(NA)。
1.4 P700氧化动力学曲线和P700+暗还原曲线的测定
在亚低磷胁迫处理的第9天,使用Dual-Pam 100 (Heinz Walz, Effeltrich, Germany)可以在远红光(FR)条件下,通过多周转脉冲(MT)和单周转脉冲(ST)所诱导形成峰的面积比来量化电子载体质体醌(PQ)库的大小[33],关闭远红光后,P700+暗还原曲线下降斜率的快慢可以表征环式电子传递(cyclic electron flow,CEF)的速率[34]。待测花生幼苗暗适应30 min 后,远红光下照射 20 s,然后打开 ST,15 s后打开MT,曲线平稳后关闭远红光,此时曲线将迅速下降,20 s后关闭程序,测量结束记录参数。使用Origin来计算MT和ST所形成峰的峰面积,之后计算MT峰与ST峰面积比值。将远红光关闭后P700信号下降曲线经标准化处理后,比较下降斜率。
1.5 P515信号测定
在亚低磷胁迫处理的第9天,使用Dual-Pam 100 (Heinz Walz, Effeltrich, Germany)的 P515/535 模块测量550—515 nm波长的信号变化。使用Dual Pam v1.19软件的自动化脚本在每次测量之前校准和平衡P515信号[35]。暗适应1 h后,记录单周转饱和脉冲诱导的P515信号变化情况,可以反映类囊体膜的完整性。在 630 μmol/(m2·s)光照 10 min 和暗适应4 min后,记录单周转饱和脉冲诱导的P515信号变化,可以反映叶绿体ATP合酶活性。暗适应12 h后550—515 nm信号的慢速暗光暗诱导曲线反映了膜电位和玉米黄质的变化情况。在分析p515信号变化情况的基础上,对组成质子动力势PMF的跨膜电势ΔΨ和跨膜质子势ΔpH进行了量化分析。
1.6 数据分析
采用Excel 2019软件进行数据汇总,Origin 2021软件对数据进行单因素方差分析,结果以3次独立生物重复的平均值和标准误表示,显著性检验采用 Fisher LSD 方法。采用 Graphpad Prism 8 和Origin 2021 软件作图。
2 结果与分析
2.1 亚低磷胁迫下外源钙对花生生长发育及叶片光合气体交换的调控作用
如图1所示,亚低磷处理显著降低了花生干物质重和总叶面积。与CK相比,–P处理的花生干物质重和总叶面积分别下降了21.1%和30.3%,这说明亚低磷胁迫下花生的生长受到限制。与–P处理相比,–P+Ca处理的总干物质重和总叶面积分别提高了26.7%和31.9%,达到了CK水平。–P处理显著降低了花生叶片的相对叶绿素含量,而–P+Ca处理相比–P处理显著提高了花生叶片的相对叶绿素含量。亚低磷胁迫下,外源钙有效缓解了花生生长发育所受的限制,促进了花生的生长。

图1 外源钙对亚低磷胁迫下花生总叶面积、总干物质重和相对叶绿素含量 (SPAD) 的影响Fig.1 Effects of exogenous Ca2+ on total dry matter, total leaf area, and relative chlorophyll concentration (SPAD)of peanut under P deficiency
如图2所示,与CK相比,–P处理下花生叶片的净光合速率Pn显著下降了19.1%,–P+Ca处理相比–P处理显著提高了亚低磷胁迫下花生叶片的Pn(图2A),提高了20.7%;–P处理下花生叶片的蒸腾速率Tr显著下降,下降了19%,而–P+TFP处理则进一步诱导了亚低磷胁迫下Tr的显著下降,外源钙提高了亚低磷胁迫下花生叶片的Tr,但差异不显著(图2B);–P处理下花生叶片的胞间CO2浓度Ci上升,–P+TFP处理则进一步加大了这种上升趋势,–P+Ca降低了亚低磷胁迫下花生叶片的Ci,但各处理间差异不显著(图2C);–P处理下花生叶片的气孔导度Gs显著下降,而–P+Ca处理显著提高了亚低磷胁迫下花生叶片的Gs(图2D),比–P处理提高了12.9%。

图2 亚低磷胁迫下外源钙对花生叶片气体交换参数的影响Fig.2 Effects of exogenous Ca2+ on net photosynthetic rate, transpiration rate, intercellular CO2 concentration,and stomatal conductance of peanut under P deficiency
2.2 亚低磷胁迫下外源钙对花生叶片PSⅡ活性的影响
如图3所示,亚低磷胁迫显著降低了花生叶片Y(Ⅱ),与CK相比,–P处理花生叶片Y(Ⅱ)下降了18.0%,而 Y(NO)和Y(NPQ)显著增高,表明亚低磷胁迫下,PSⅡ光化学反应受阻,造成光能过剩。与–P处理相比,–P+Ca处理降低了Y(NO)和Y(NPQ),Y(Ⅱ)显著提高,这说明外源钙提高了PSⅡ活性,减缓了PSⅡ的光抑制。
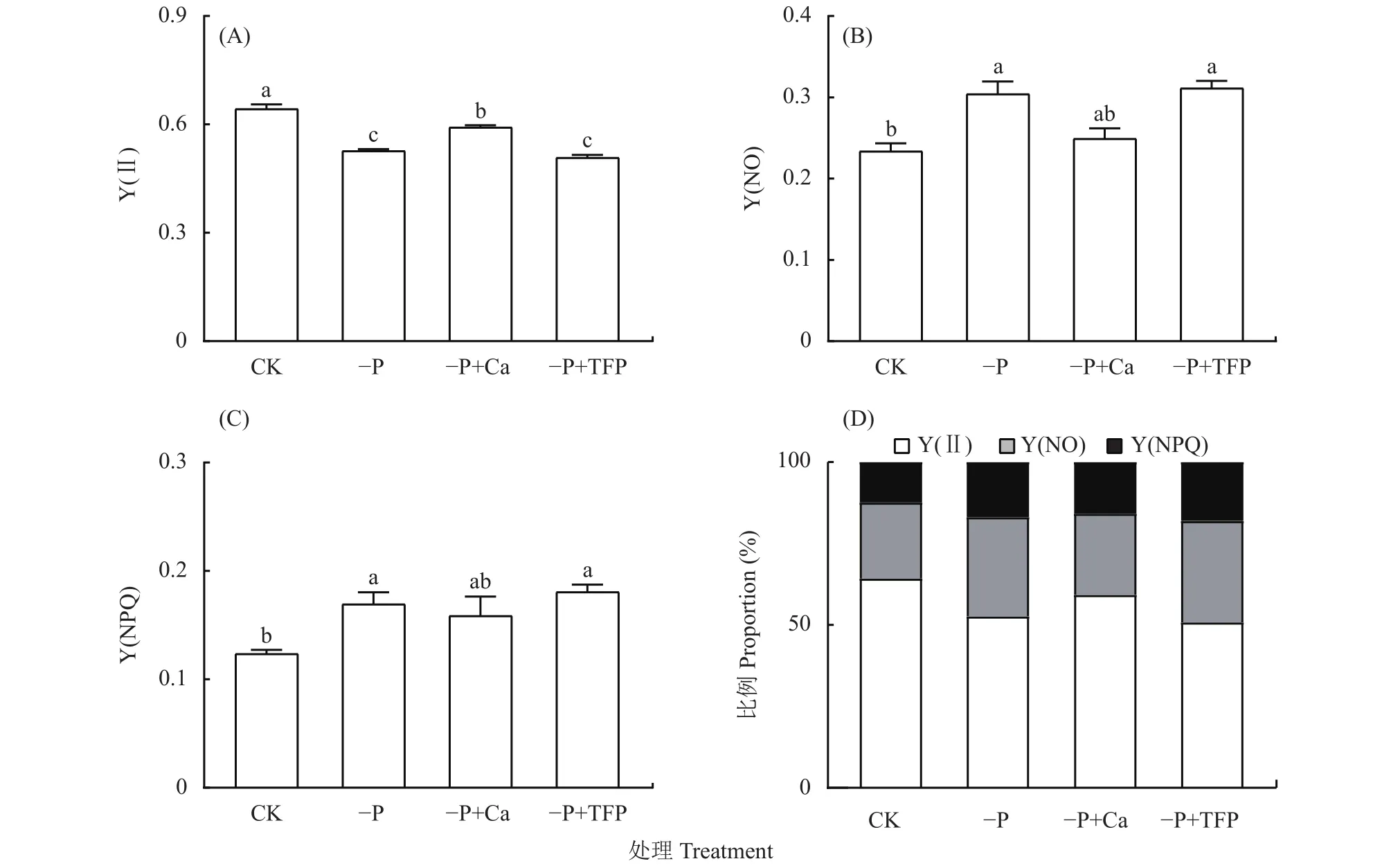
图3 亚低磷胁迫下外源钙对花生叶片光系统Ⅱ光化学活性的影响Fig.3 Effects of exogenous Ca2+ on the Y(Ⅱ), Y(NO), Y(NPQ), and their proportional allocation of peanut leaves under P deficiency
2.3 亚低磷胁迫下外源钙对花生叶片PSⅠ活性的影响
如图4所示,亚低磷胁迫显著降低了花生叶片的Y(Ⅰ)。与CK相比,–P处理Y(ND)和Y(NA)上升,Y(Ⅰ)下降了5.4%,这说明亚低磷胁迫造成花生叶片PSⅠ光抑制。与–P处理相比,–P+Ca处理Y(ND)和Y(NA)下降,Y(Ⅰ)提高并达到了同CK无显著差异的水平。说明外源钙缓解了亚低磷胁迫对PSI供体侧和受体侧限制,缓解了PSⅠ光抑制。
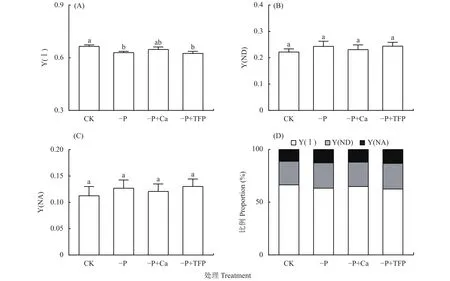
图4 亚低磷胁迫下外源钙对花生叶片PSI活性的影响Fig.4 Effects of exogenous Ca2+ on the Y(Ⅰ), Y(ND), Y(NA) and their proportional allocation of peanut leaves under P deficiency
2.4 亚低磷胁迫下外源钙对花生叶片PQ库和环式电子传递的影响
如图5A和B所示,CK曲线下降斜率小,此时受胁迫程度小,未完全启动环式电子传递。与CK相比,–P处理下降斜率升高,此时叶片已启动环式电子传递。与–P处理相比,–P+Ca处理的曲线下降斜率进一步升高,说明外源钙促进了亚低磷胁迫下花生叶片的环式电子传递。而–P+TFP处理的曲线下降斜率则小于CK和–P处理,这表明亚低磷胁迫下外源TFP处理进一步降低了环式电子传递速率,反向证明了钙离子参与调节环式电子传递。如图5C所示,亚低磷胁迫显著降低了花生叶片的PQ库大小,与CK相比,–P处理PQ 库大小下降了22.1%,亚低磷胁迫诱发了花生叶片PQ库的显著减少。而外源钙处理显著提高了亚低磷胁迫下花生叶片的PQ库大小,与–P处理相比,–P+Ca处理提升了21.3%,亚低磷胁迫下,外源钙缓解了PQ库的限制。
2.5 亚低磷胁迫下外源钙对花生叶片类囊体膜的完整性和ATP合酶活性的影响
如图6A所示,CK花生叶片经充分暗适应后,P515信号呈缓慢降低趋势。与CK相比,–P处理下降斜率变大,这反映了亚低磷胁迫降低了花生叶片类囊体膜的完整性,造成类囊体膜损伤;–P+Ca处理下降斜率处于CK和–P处理之间,该结果说明亚低磷胁迫下外源钙有效缓解了花生叶片类囊体膜的损伤程度。–P+TFP处理的下降斜率最高,类囊体膜损伤最严重。亚低磷胁迫下,外源TFP进一步降低了类囊体膜的完整性,反向说明了Ca2+对类囊体膜的保护作用。如图6B所示,充分照光后,CK花生叶片的P515信号下降最快,其次是–P+Ca处理和–P处理,–P+TFP处理下降最慢。该结果说明,亚低磷胁迫降低了ATP合酶的活性,而外源钙提高了ATP合酶的活性。亚低磷胁迫下,外源TFP进一步降低了ATP合酶活性。
2.6 亚低磷胁迫下外源钙对花生叶片质子动力势的影响
如图7A所示,各处理中,CK花生叶片 ∆Ψ最高,–P+TFP处理的 ∆Ψ最低。亚低磷胁迫显著降低了花生叶片的跨膜电势∆Ψ,与CK相比,–P处理的∆Ψ下降了26.7%;而–P+TFP处理进一步降低了花生叶片 ∆Ψ。外源钙显著提高了亚低磷胁迫下花生叶片的 ∆Ψ,与–P处理相比,–P+Ca处理花生叶片的∆Ψ提高了26.9%,–P+Ca处理达到CK水平。如图7B所示,在各处理中,跨膜质子势∆pH 与 ∆Ψ的变化趋势相反。CK花生叶片∆pH最低,–P+TFP处理的∆pH最高。与CK相比,–P处理∆pH升高了35.8%,这说明亚低磷胁迫造成花生叶片类囊体腔酸化。–P+TFP处理的∆pH与–P处理处于同一水平。外源钙显著降低了亚低磷胁迫下花生叶片的∆pH,与–P处理相比,Ca处理花生叶片的ΔpH降低了33.7%,–P+Ca处理与CK处于同一水平,这说明亚低磷胁迫下外源钙有效缓解了花生叶片类囊体腔的酸化。
3 讨论
花生具备较强根瘤固氮能力,但其对土壤有效磷含量具有较高要求[18]。本研究结果表明,亚低磷胁迫可造成花生干物质积累、总叶面积和相对叶绿素含量显著降低,严重限制花生生长发育(图1)。前人研究也发现,磷供应不足显著降低高产花生品种的叶片生长和干物质量[10]。另外,亚低磷胁迫显著降低花生功能叶片净光合速率Pn、蒸腾速率Tr和气孔导度Gs,全面抑制光合作用水平(图2);许多研究也证实,磷限制条件下库活性和生长抑制可导致植物光合反馈抑制[36–37]。亚低磷胁迫下,花生叶片叶绿体ATP合酶活性下降,质子在类囊体腔中积累,∆pH上升,造成类囊体腔酸化。有研究表明,缺磷会限制Benson-Calvin循环,影响CO2同化[38]。Benson-Calvin循环的限制可能会积累磷酸化的中间产物并固定基质中的Pi[39],同时Benson-Calvin循环受限也会降低对NADPH和ATP的需求。CO2同化受限,会导致ATP/ADP值升高,降低ATP合酶活性[40]。有研究表明,缺磷会导致叶绿体基质中的Pi减少,而ATP合酶对叶绿体中Pi浓度变化非常敏感,基质Pi浓度的轻微下降也会对ATP合酶活性产生重大影响,从而显著抑制质子的外流[41]。尽管Pi是ATP合酶合成ATP的底物,但Pi降低也会对其它代谢过程产生实质性的影响[42]。总而言之,缺磷会减少叶绿体基质中的Pi浓度,降低ATP合酶活性,并造成花生叶片类囊体腔酸化。
本研究发现,亚低磷胁迫不仅可以造成花生光合反馈抑制,同时还导致花生功能叶片光损伤(光抑制) (图3、图4)。在叶绿体中,质子动力势PMF驱动ATP合酶合成ATP,而PMF由∆pH和∆Ψ组成,这两个组分对ATP合成的贡献相等,但只有∆pH组分通过类囊体腔酸化来诱导光合电子传递速率的下调。PMF的调节要满足两个生理需求:1)满足CO2固定所需的ATP;2)下调电子传递避免光损伤[43]。在本试验中,亚低磷胁迫下花生叶片ΔpH上升和∆Ψ下降(图7)也说明,花生生长受限、ATP需求降低情况下,自身通过酸化类囊体腔下调光合电子传递速率避免光损伤,其中CEF的促进(图5)和ATP合酶活性的下降(图6)促进了ΔpH的升高,保护了光合膜、减少了ROS的产生。∆pH具有两方面功能:一是酸化的类囊体腔会下调细胞色素b6f复合体的活性,减少电子向PSⅠ传递,保护PSⅠ;二是诱导非光化学猝灭(NPQ)的qE组分来增加能量耗散[44]。有研究表明,环式电子传递在线性电子传递受限的条件下维持较大的ΔpH,从而诱导NPQ的qE组分耗散过多的光能。qE组分的激发会下调PSⅡ天线色素的光捕获效率,从而防止PSⅡ的过度光损伤(光抑制),但因此也会降低PSⅡ的电子传递速率[45],这一结果与本试验结果一致。在本试验中,亚低磷胁迫下,∆pH升高,类囊体腔酸化(图8),亚低磷胁迫下Y(Ⅱ)显著降低,而Y(NPQ)显著增加,这表明包括qE在内的调节性能量耗散机制已启动,消耗过剩光能。另一方面,升高的ΔpH会减缓PQH2在细胞色素b6f复合体处的氧化,限制电子向PSⅠ传递[46–49],而本试验中,亚低磷胁迫下,Y(Ⅰ)显著下降,光系统Ⅰ也发生光抑制。

图5 亚低磷胁迫下外源钙对花生叶片环式电子传递和PQ库的影响Fig.5 Effects of exogenous Ca2+ on CEF and PQ pool of peanut under P deficiency
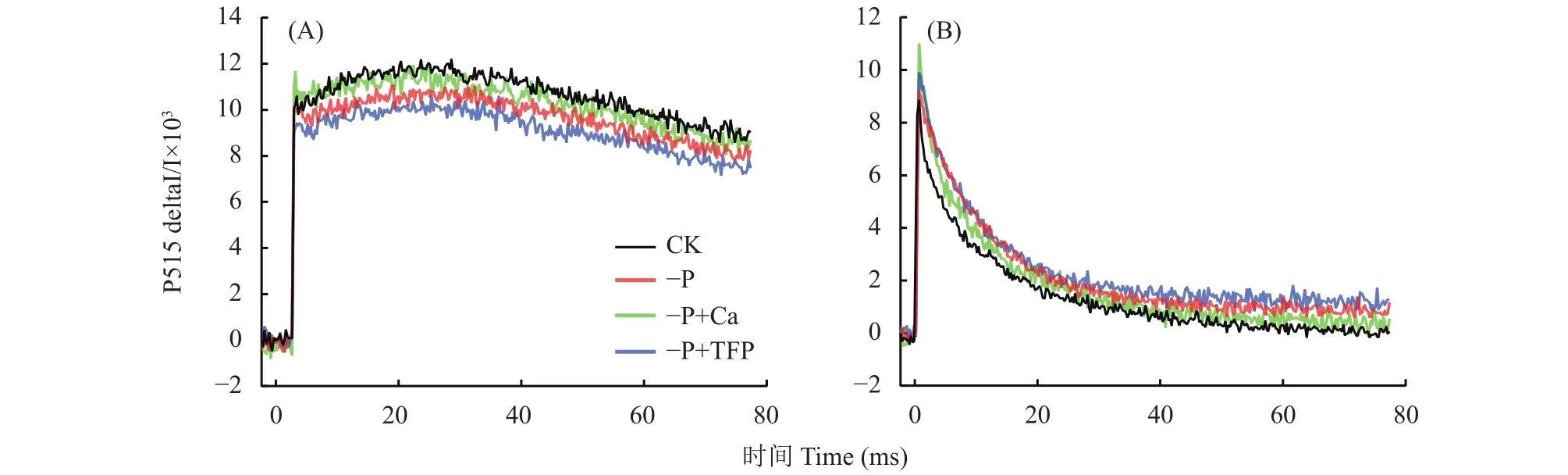
图6 亚低磷胁迫下外源钙对花生叶片类囊体膜的完整性和ATP合酶活性的影响Fig.6 Effects of exogenous Ca2+ on 515 rapid relaxation kinetics of peanut leaves under P deficiency
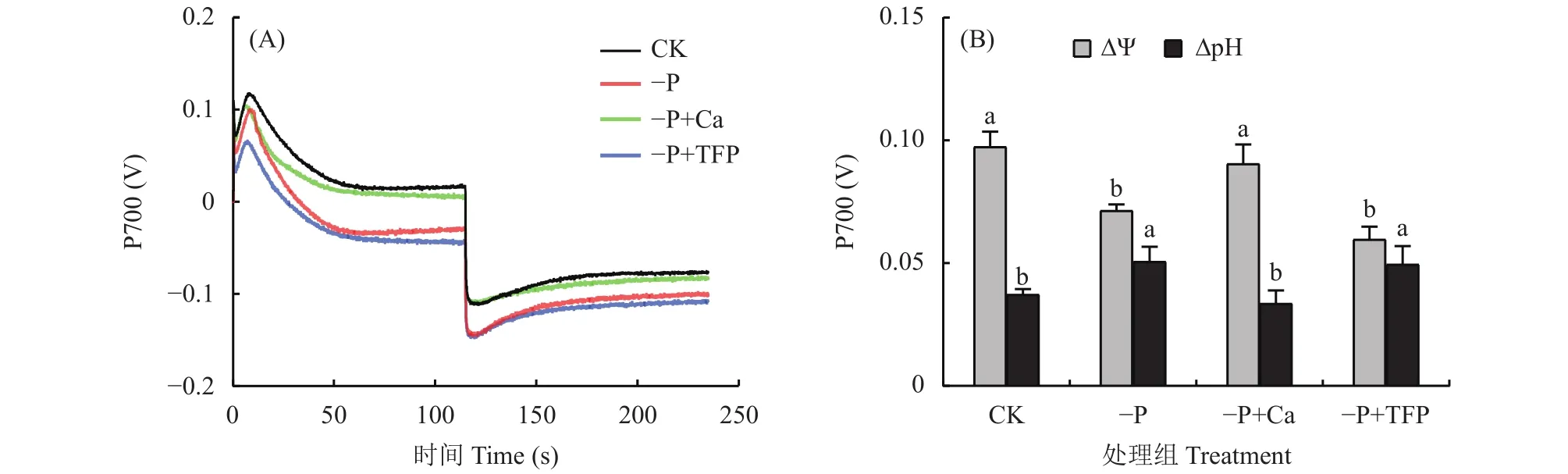
图7 亚低磷胁迫下外源钙对花生叶片质子动力势的影响Fig.7 Effects of exogenous Ca2+ on proton motive force of peanut under P deficiency
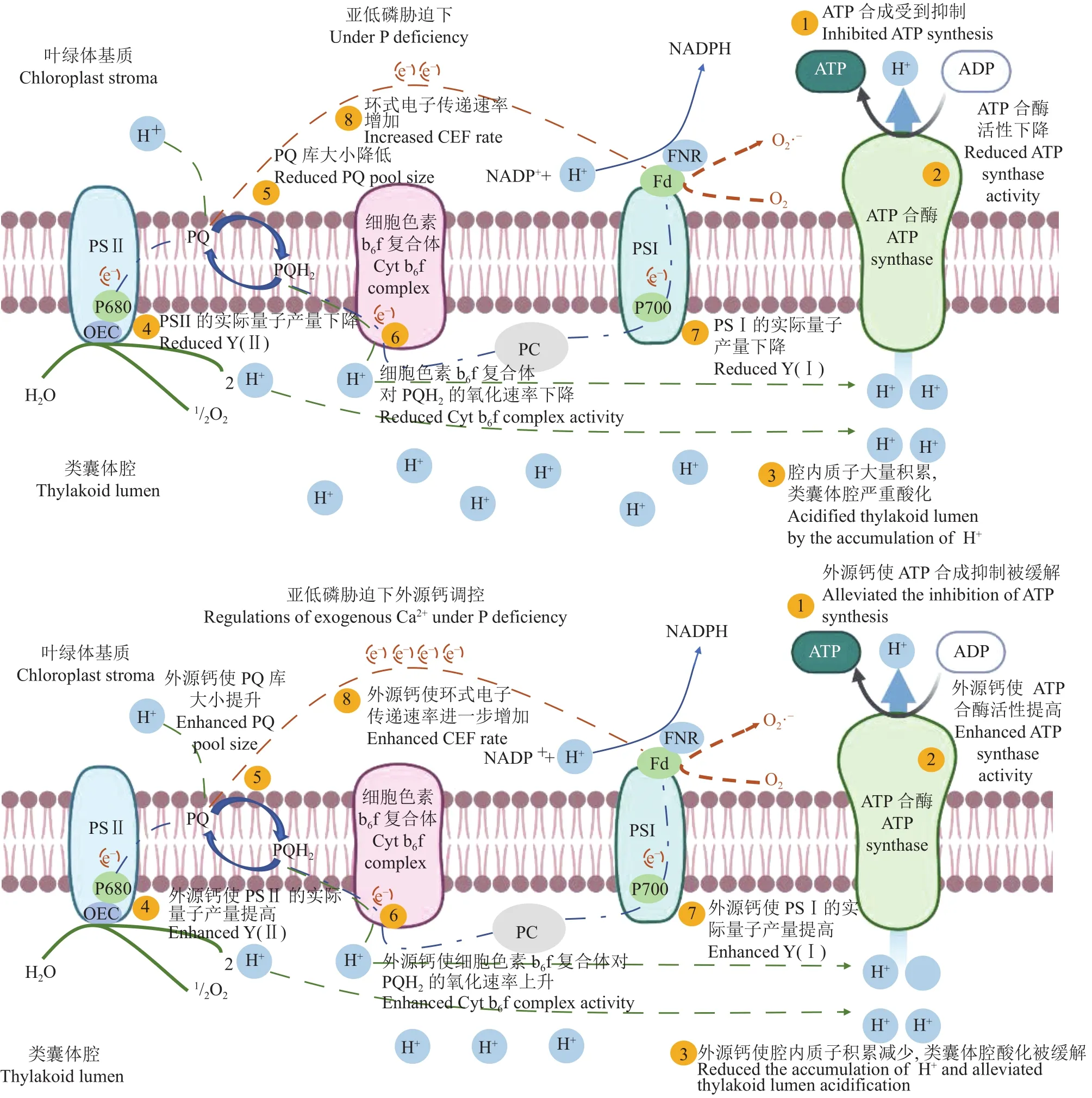
图8 亚低磷胁迫下外源钙对花生叶片光合电子传递链的影响Fig.8 Effects of exogenous Ca2+ on photosynthetic electron transport chain of peanut under P deficiency
Ca2+作为第二信使[24],在植物外源磷感知和胁迫信号传递中具有重要调节作用[50]。有研究表明,Ca调节了植物叶片磷的分配[51–52]。有些物种通过优先将磷分配到光合细胞中,以便更有效地利用磷,提高光合磷利用效率(PPUE)[23]。本试验结果表明,外源钙提高了亚低磷胁迫下花生的干物质重和总叶面积(图1),有效缓解了亚低磷胁迫对花生植株生长发育的限制。这与Ding等[53]的研究结果一致,提高钙供应可以缓解羽扇豆的缺磷症状,并促进其生物量的积累。外源钙提高了花生的净光合速率(图2),增加了花生植株对同化物的需求,缓解了花生光抑制;特别是亚低磷胁迫下,外源钙可激发花生叶片环式电子传递,提高花生叶片光保护能力,缓解光损伤[54–56]。本研究结果表明,外源钙提高了亚低磷胁迫下花生植株叶片 Y(Ⅰ)和 Y (Ⅱ),其中 Y(NO)和 Y(NPQ)的降低说明PSⅡ提高了对光能的转化效率,Y(NA)和Y(ND)的下降说明了PSI供体侧、受体侧限制减少,外源钙缓解了光系统的光抑制,并激活了环式电子传递(图8)。另外,亚低磷胁迫下,外源钙提高了ATP合酶的活性,降低了花生叶片的ΔpH (图7)。外源钙缓解了亚低磷胁迫诱导的类囊体腔酸化,这具有两方面作用:一方面,恢复了细胞色素b6f复合体的活性,平衡了PQ库的氧化还原状态,减缓了PSⅠ的光抑制;另一方面,降低了非光化猝灭NPQ的qE组分耗散的能量,上调PSⅡ天线色素捕光效率,减缓了PSⅡ的光抑制,提高了Y(Ⅱ) (图8)。
4 结论
亚低磷胁迫显著抑制花生的生长发育,降低花生植株干物质积累、叶面积和相对叶绿素含量,降低ATP合酶活性和造成类囊体腔酸化,进而降低Y(Ⅰ)和Y(Ⅱ),造成花生光抑制。亚低磷胁迫下,外源钙能有效解除花生生长发育所受的限制和光抑制,缓解亚低磷胁迫诱导的ATP合酶活性限制和类囊体腔的酸化,显著提高了花生叶片的光合作用水平。经过亚低磷胁迫下TFP反向调控试验证实,花生钙调蛋白(Ca2+-modulin)作为外源钙(Ca2+)的受体,可在钙离子缓解亚低磷光合障碍的营养信号转导中起到重要作用。
