纤维化型过敏性肺炎诊断及治疗研究进展
2022-07-18肖雯雯综述陈国忠审校
肖雯雯综述 陈国忠审校
过敏性肺炎(hypersensitivity pneumonitis,HP)是易感个体暴露于环境中的致敏原经免疫介导而引起的一种间质性肺疾病(interstitial lung diseases,ILD)。HP患病率随气候、职业暴露和环境暴露的区域差异而变化,文献报道的队列研究也很少,据报道,美国HP的发病率为(1.67~2.71)/10万,年累积发病率为(1.28~1.94)/10万[1],实际发病率可能远高于此水平。新发间质性肺病通过多学科讨论近半数诊断为HP。既往根据HP病程的长短分为急性、亚急性和慢性。然而临床实践发现这种分类临床难以界定,有一定人为因素,与病情进展和预后不尽一致。
2020年美国胸科学会(ATS)、日本呼吸病学会(JRS)和拉丁美洲胸科协会(ALTA)共同制定发表成人HP诊断的国际性循证指南[2],建立HP诊断的国际准则,在HP定义、临床影像、病理特征和分类等方面进行充分阐述。纤维化是影响HP预后、选择治疗策略的重要因素。该指南根据肺部影像及病理有无纤维化的表现,倾向于将HP分为纤维化型HP(fibrotic HP,f-HP)和非纤维化型HP(non-fibrotic HP,nf-HP) 。该分类能够客观反映疾病的表现,并且与临床病程和治疗结局相关,对评估HP的预后起着重要作用。本文就纤维化型HP的发病机制、临床诊断及治疗进展作一综述。
1 流行病学
2020年ATS/JRS/ALTA制定的成人过敏性肺炎的指南提出,HP是一种具有不同临床表现和结果的疾病,将影像学和/或组织病理学提示有纤维化的HP称为f-HP。目前有文献报道美国f-HP患病率(0.41~0.80)/10万,1年累积发病率为(0.29~0.43)/10万[1-2],nf-HP患者在接触致敏原后经常复发并发展为纤维化,而f-HP患者预后较差。日本的一项研究发现,f-HP组的5年和10年累计病死率分别为47.8%和79.6%,远高于nf-HP组[3]。组织病理学和/或影像学提示纤维化是HP预后不良的因素之一,有研究表明,f-HP中位生存时间4.9~9.2年[4-5]。
2 发病机制
2.1 致敏原和环境暴露 反复暴露于一种或多种致敏原,易感个体会发生HP。目前已证明引起HP的致敏原多达200余种,常见的致敏原来源于微生物、真菌、动物的蛋白质抗原(如禽类抗原),也可能是多糖或低分子量非蛋白质化学品(如异氰酸酯)。Kongsupon等[6]通过系统回顾,将HP接触源分为14 类,其中包括农业、植物加工、木材、动物相关、食品、食品加工、金属加工、聚合物、其他制造、化学品、雾化水、服务、废物和污水、管乐器等,然而这并不是完整的致敏原清单。随着研究进一步深入,更多的致敏原会被发现。这些致敏原可能存在于工作场所及家庭等地方,随着时间的推移和致敏原的多次接触,在不同的环境下,相似的致敏原可能诱发不同类型的HP[7],但发病不仅仅是与单一致敏原有关。致敏原作为诱发因素,遗传或环境因素作为发病的危险因素,导致过度免疫反应,最终引起肺泡、终末细支气管和间质的炎性反应[8]。因接触的抗原不同,HP又有多种不同的名称,如暴露于发霉的干草或稻草引起的农民肺(farmer’s lung),暴露于羽毛灰尘和鸟粪引起的鸟类饲养员肺(bird breeder lung)等。
2.2 免疫失调 目前认为HP最初由Ⅲ型超敏反应介导,而后转向Ⅳ型超敏反应。急性HP常有职业或致敏原的接触史,再次吸入同种致敏原后,先天免疫细胞将加工过的抗原呈递给B淋巴细胞,产生免疫球蛋白,在肺泡间形成免疫复合物,通过经典途径激活补体,促进炎性细胞与渗出液在肺泡间质积聚。HP患者出现Ⅳ型超敏反应,通过T淋巴细胞、巨噬细胞参与的免疫反应形成肉芽肿和间质纤维化。在HP肺纤维化发展过程中,Th1细胞活性下降而Th2细胞活性增加,Th2细胞因子IL-4和IL-13,通过诱导成纤维细胞增殖和胶原蛋白的生成,增强纤维化过程,而Th1细胞因子IFN-γ可以抑制该过程。Th1/Th2 细胞活性转换及上皮细胞凋亡增强和异常的成纤维细胞活性导致肺纤维化[8]。研究发现,除了Th1相关因子外,Th17 细胞分泌的IL-17,尤其是IL-17A对炎性反应的发展非常重要,IL-17A是中性粒细胞聚集、激活及迁移的重要细胞因子[9]。转化生长因子β(transforming growth factor-β,TGF-β)已被证明是肺纤维化发育的关键细胞因子,TGF-β介导PI3K/AKT信号通路可能进一步诱导mTOR和纤维化相关基因表达的激活。
2.3 基因或宿主易感性 目前研究最多的HP易感性因素是基因变异。大多数可能增加HP易感性的基因多态性在参与处理和呈递外部抗原的分子中被追踪到,主要包括组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类、蛋白酶体、转运蛋白和基质金属蛋白酶组织抑制剂。Falfan-Valencia等[10]研究发现,HLA-DRB1*04 似乎是HP的主要易感基因位点,表明位于HLA区域内的遗传因素有助于HP的发展。其次是可能涉及肺稳态和伤口修复及端粒相关基因突变的基因多态性。端粒缩短是衰老的主要特征之一,因为它们可以触发其他老化特征,如基因组不稳定、细胞衰老和凋亡、线粒体功能障碍和组织再生能力丧失[11]。患有慢性HP的患者中,有相当一部分在端粒相关基因中具有罕见的蛋白质变异,这些变异与短外周血端粒长度有关[12]。端粒酶逆转录酶(telomerase reverse transcriptase,TERT)的蛋白质成分和端粒酶的RNA成分(telomerase RNA component,TERC)的突变导致端粒长度缩短,与家族性肺纤维化也有关。粘蛋白5B(mucin5B,MUC5B) 启动子rs35705950多态性、较短的端粒长度与HP中的纤维化程度相关。MUC5B rs35705950的等位基因使远端细支气管上皮细胞产生过多的MUC5B损害黏膜间隙,导致肺损伤或上皮细胞应激和/或破坏远端肺的修复机制,导致肺纤维化[13]。
3 诊断
3.1 暴露史 对于nf-HP患者,通常与明确的致敏原暴露有关。f-HP患者中,约50%无法明确致敏原,可以使用调查问卷详细了解暴露史,或者测定HP潜在抗原的特异性血清IgG,但大部分HP患者的特异性抗体为阴性。还可以通过吸入特定的抗原激发试验寻找致敏原,但需专业人员才能进行,并且激发试验可能导致HP的发病和加重。
3.2 胸部高分辨CT 2020年ATS/JRS/ALAT指南将f-HP的影像学分为典型、符合及不确定HP 3种类型[2]。典型f-HP的影像学特征至少有1项肺纤维化和至少1项小气道病变表现。肺纤维化通常表现为不规则的线状影/网格影伴结构扭曲,可存在牵张性支气管扩张和蜂窝肺,分布特征为头尾和轴向随机分布或中肺野分布为主,下肺野相对受累较少。小气道病变的表现为边界不清的小叶中心结节影、磨玻璃影、血管纹理减少的低密度影和正常肺组织密度同时存在的三密度征、马赛克征和/或气体陷闭。符合f-HP的影像学表现为非特异性肺纤维化和小气道的病变表现,其中非特异性肺纤维化表现为以基底部胸膜下分布的蜂窝影伴或不伴牵张性支气管扩张或广泛磨玻璃影和轻度纤维化,小气道病变的表现同典型f-HP。不确定HP影像学表现为寻常型间质性肺炎(usual interstitial pneumonia,UIP)、非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)、机化性肺炎(organizing pneumonia,OP)等影像学表现。
3.3 肺泡灌洗液 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)检测在HP诊断中有着重要地位。HP的BALF中淋巴细胞显著升高,是正常人的5~10倍,2012年ATS/ERS指南提示HP、结节病的BALF中淋巴细胞比例通常大于25%,大于50%者常常提示HP或者富细胞型NSIP[14]。一项Meta分析纳入8项独立研究,BALF中淋巴细胞比例大于20%对诊断慢性HP的敏感度为68.1%、特异度为64.8%,阈值越高,敏感度越低、特异度越高[15]。HP患者的BALF中CD4+与CD8+细胞均升高,以CD8+细胞升高为主,CD4+/CD8+比值降低,但也可以表现为正常或升高,这与致敏原、吸烟史及HP的不同阶段有关,因此ATS/ERS指南不推荐在BALF中使用T细胞亚群作为诊断ILD的常规检测。有研究发现[16],Ⅱ型肺泡上皮细胞表达的涎液化糖链抗原-6(krebs von den lungen-6,KL-6)在f-HP患者的BALF及血清中均升高,且BALF中KL-6的浓度在HRCT表现为广泛磨玻璃影和小叶中心结节的f-HP患者中最高,主要是因为BALF中CD3+CD8+淋巴细胞增多,BALF中淋巴细胞增多和KL-6浓度显示出直接相关性。
3.4 组织病理学 肺活检对HP的诊断非常重要,组织病理提示的纤维成分与f-HP预后相关。组织病理诊断分为典型f-HP、符合f-HP与不确定f-HP 3个层级。典型f-HP的病理特征有以下表现[2]:(1)纤维性间质慢性炎性反应;(2)气道中心性纤维化可能伴有细支气管周围化生或桥接纤维化;(3)非坏死性肉芽肿,可能伴有细胞性间质慢性炎性反应或细胞性细支气管炎或机化性肺炎;至少1个活检部位组织病理具有以上第1条或第 2条+第3条病理特征,同时需除外广泛的淋巴组织样增生、结节病样肉芽肿及吸入性颗粒引起的疾病。符合f-HP的病理特征为至少1个活检部位组织病理为纤维性间质慢性炎性反应和气道中心纤维化,除外提示其他诊断的表现,可能伴有细胞性间质慢性炎性反应、细胞性细支气管炎或机化性肺炎。不确定f-HP的病理表现为至少1个活检部位组织病理具有纤维性间质慢性炎性反应或气道中心纤维化,除外提示其他诊断的表现,可能伴有细胞性间质慢性炎性反应、细胞性细支气管炎或机化性肺炎。
综上,HP的诊断是基于暴露史及血清IgG抗体、胸部高分辨CT、肺泡灌洗液细胞计数、有或无组织学病理[17]。2020年ATS/JRS/ALAT指南将诊断的可信程度分为确诊(≥90%可信度)、很可能(80%~89%可信度)、可能(70%~79%可信度)、低度可能(51%~69%)和不排除[2],见表1。
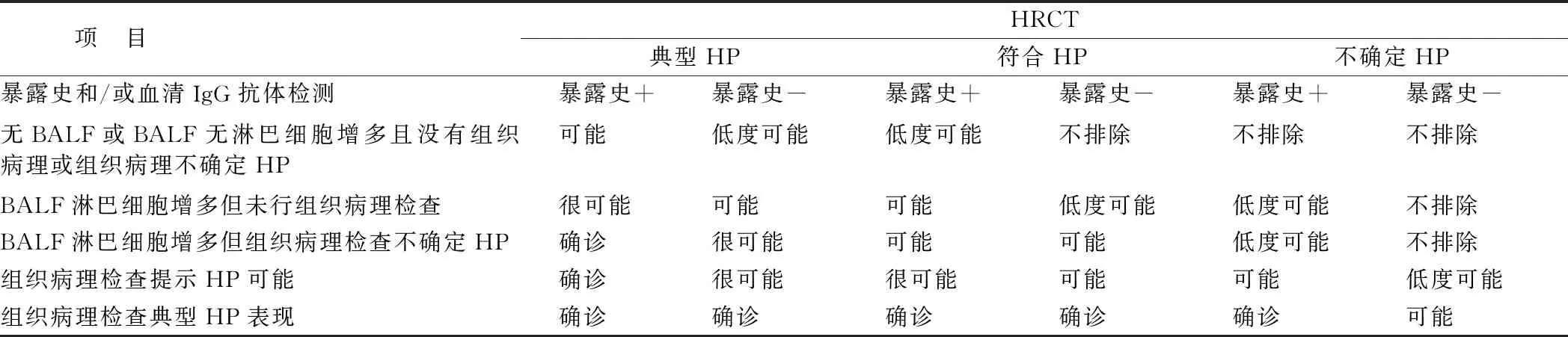
表1 过敏性肺炎的诊断
4 治疗
4.1 避免接触致敏原 详细询问暴露史、发现过敏原和避免接触过敏原在HP治疗中具有非常重要的意义。对于nf-HP患者,避免接触过敏原及脱离致敏环境可获得好转。对于f-HP的患者,肺组织已经产生纤维化及肺气肿等病变,脱离致敏原,病情仍会进展。
4.2 糖皮质激素 全身性糖皮质激素仍是治疗HP的最主要药物,可以缓解相关症状,但不是所有患者都能获得较好的疗效。Tony等[18]通过比较甲基强的松龙对nf-HP和f-HP的影响,并测量用力肺活量(forced vital capacity,FVC)、第一秒用力呼气容积(forced expiratory volume in one second,FEV1)、血氧饱和度和6 min步行试验,治疗8周后发现,糖皮质激素对f-HP及nf-HP患者均有效果,对nf-HP的治疗效果优于f-HP。De Sadeleer等[4]研究纳入93例 nf-HP和109例f-HP患者,使用糖皮质激素后,f-HP患者 FVC%和一氧化碳弥散量(carbon monoxide diffusion capacity,DLCO) 改善不明显。另有研究发现,对BALF淋巴细胞大于20%和/或影像学未提示蜂窝样改变的f-HP患者,早期使用糖皮质激素效果较好,但随着时间的延长,激素治疗的不良反应越来越多[19]。
4.3 免疫调节剂 霉酚酸酯(mycophenolate mofetil,MMF)和硫唑嘌呤(azathioprine,AZA)作为细胞周期抑制剂,用于治疗多种炎性ILD,例如结缔组织病相关性ILD。最近一项研究发现[20],对于影像学和/或组织学提示f-HP,接受MMF或AZA治疗1年后,DLCO的改善有统计学意义,FVC改善无统计学意义。来氟米特是一种二氢乳清酸脱氢酶抑制剂,从而影响活化淋巴细胞的嘧啶形成来抑制炎性反应。一项回顾性研究发现,来氟米特可以改善f-HP肺功能,在高分辨CT上纤维化程度<20%的患者中效果显著[21]。
由于HP的发病机制是由自身免疫介导的疾病[8],对于体液免疫反应特异性IgG,有可能通过利妥昔单抗非特异性抑制/耗尽B细胞,从而影响免疫球蛋白IgG的产生。在Keir等[22]的研究中,6例经常规免疫抑制剂治疗后肺功能下降的纤维化型HP患者接受利妥昔单抗治疗,其中有3例肺功能测试稳定或改善,另外3例患者的肺功能测试继续恶化,所有患者均在治疗后4个月内死亡。在5例使用利妥昔单抗的f-HP患者,对于FVC大于预计值50%和DLCO大于预计值30%的患者,肺功能保持稳定,6 min步行距离得到改善;与上述结果相反的患者肺功能及6 min步行距离无明显改善,提示在疾病的早期阶段,使用利妥昔单抗可能在一定程度上有助于稳定病情[23]。
慢性持续性炎性反应似乎是导致肺纤维化重塑的机制之一,因此抗原去除和控制炎性反应在疾病的进展中至关重要。IL-17可以诱导炎性反应及胶原纤维形成[24],Th2细胞因子IL-4和IL-13诱导成纤维细胞增殖和胶原蛋白的生成。Anti-IL-4、anti-IL-13及anti-IL-17阻断特定细胞因子和趋化因子通路,可能有助于控制纤维化。具有潜在抗炎作用和免疫调节药物包括英夫利昔单抗、依那西普和阿达木单抗,以及针对IFN-γ或其他特定细胞因子的单克隆抗体有可能预防肉芽肿形成。纯化的血清淀粉样蛋白P(pentraxin 2),抑制单核细胞分化为促纤维化纤维细胞,也是单核细胞分化为促炎巨噬细胞和产生 TGF-β1的有效抑制剂。在最近一项特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)患者的2期试验中,pentraxin2 与延缓疾病进展有关,这种药物调节慢性HP患者先天免疫反应的治疗潜力值得探索[25]。
4.4 抗纤维化药物 对于广泛或进行性纤维化的患者或类似于UIP的放射/组织病理学模式的HP,其进展可能与IPF一致,尼达尼布或吡非尼酮作为抗纤维化药物可能为f-HP的治疗提供较好的效果。2018年,Shibata等[26]回顾性分析23例使用吡非尼酮治疗f-HP患者的肺功能,发现吡非尼酮可以延缓FVC的下降。RELIEF研究通过48周追踪随访,发现在结缔组织疾病相关性ILD、纤维化性非特异性间质性肺炎、f-HP和石棉肺这4种进展性纤维化ILD中,吡非尼酮可以延缓 FVC%下降,并且该试验表明,吡非尼酮有较高的安全性,吡非尼酮组出现感染及不良反应较安慰剂组少[27]。Mateos-Toledo等[28]研究发现,免疫抑制药物联用吡非尼酮对FVC没有影响,但DLCO下降的趋势和圣乔治呼吸问卷总分得到显著改善。INBUILD试验的结果表明,在纤维化型间质性肺疾病中,与安慰剂组相比,尼达尼布组FVC年下降率明显降低,但在HP亚组(占总纳入人数26%)中,尼达尼布和安慰剂之间的FVC下降率没有统计学差异[29-30]。目前第一个关于吡非尼酮对f-HP患者疗效和安全性的随机双盲试验正在招募患者,通过52周的治疗和随访,观察患者肺功能变化来评估药物的安全性及有效性[31]。
4.5 肺移植 对激素和/或免疫调节剂治疗无反应的进展性HP患者,可考虑肺移植。移植后的HP患者需避免接触致敏原,避免移植肺再次发生HP。
5 预后
细胞炎性反应和纤维化对HP的预后和治疗具有重要意义。Nukui等[32]的研究发现,血清中CC亚家族趋化因子配体17(CC chemokine ligand 17,CCL17)升高和血清CXC亚家族趋化因子配体9(CXC chemokine ligand 9,CXCL9)降低可作为慢性鸟类相关性HP患者肺功能恶化的重要预测因子。有研究表明,避免接触致敏原及全身类固醇激素治疗,经过多年随访发现f-HP中位生存期4.9~9.2年,BALF中淋巴细胞较少和高分辨CT提示蜂窝样改变常常提示预后欠佳[4-5,19]。
6 小结与展望
由于致敏原种类繁多,且许多患者不能明确致敏原,临床表现比较复杂,不少f-HP患者会误诊为特发性肺纤维化[33],2020年制定的循证性指南为HP诊断提供明确的影像学和病理学标准,有助于更好的区分f-HP与特发性肺纤维化,但f-HP发病机制、治疗及预后的生物标志物尚未完全明确,这些都需要进一步研究。
