垂体腺瘤经蝶窦入路术后继发迟发性低钠血症的危险因素
2022-07-18代永庆周林裕柏建兵
代永庆 周林裕 于 泓 柏建兵
低钠血症是垂体腺瘤经鼻蝶入路术后常见的并发症,发生率在1.8 %~35%[1],如不及时诊治,严重者可出现癫痫发作、精神异常等[2,3]。报道显示,术中破坏正常垂体导致的激素失衡可能是迟发型低钠血症的重要发病机制[1,3~5]。本文回顾性分析我院近10年经鼻蝶入路手术切除的垂体腺瘤的临床资料,探讨术后迟发性低钠血症的危险因素,为临床提供参考。
1 资料和方法
1.1 研究对象 回顾性分析2012年3月~2020年7月经鼻蝶入路手术切除的671例垂体腺瘤的临床资料。纳入标准:垂体腺瘤进行经鼻蝶入路手术治疗;肿瘤向上生长并穿过鞍背结节平面;首次手术;术后3 d内进行MRI检查;MRI可以识别垂体柄。排除标准:病理证实为非垂体腺瘤或伴有其他鞍区病变;肿瘤生长未达到鞍背结节平;术前放疗史。
1.2 迟发性低钠血症的诊断标准[4,5]术后3 d或之后血钠水平<135 mmol/L。
1.3 垂体功能减退的诊断标准 禁食12 h后进行垂体功能联合试验,静脉注射常规胰岛素(0.1 U/kg)、促甲状腺素释放激素(200μg)和促黄体生成素释放激素(100μg),0、30、60、90、120 min检测血清生长激素、皮质醇、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、催乳素、促甲状腺激素、促黄体生成素和促卵泡素。当相应激素没有出现正常反应时,被认为是缺乏的,定义为垂体功能减退。
1.4 影像学评估 手术前后使用MRI动态扫描鞍区。术前MRI冠状位测定肿瘤最大直径。术前和术后对比增强影像相同的冠状位测量肿瘤腔高度,两者差异为术后肿瘤腔高度变化,超过5 mm认为发生显著变化(图1)。应用术前MRI按改良Hardy分级进行垂体腺瘤分类[7]。术后48 h内复查MRI确定肿瘤的切除程度。术前、术后6~12个月及术后每2年行垂体功能联合试验评价垂体前叶功能。
1.5 手术方法 经蝶窦入路,在显微镜或神经内镜下切除肿瘤。硬脑膜切开后,正常解剖,鉴别肿瘤及周围假包膜。如果肿瘤较硬或被较厚的假包膜包围,则沿假包膜外缘进行切除。如果肿瘤质地柔软,则以分块的方式切除。尽可能切除假包膜以防止复发。垂体腺瘤的激素类型由术后病理检查确定。
1.6 围手术期处理和指标评估 术后每天监测血钠,术后接受0.9 %氯化钠溶液作为维持液。术前常规检查垂体功能,以确定功能低下以及是否需要激素替代。除库欣病外,术中静脉注射应激剂量的糖皮质激素,以防止与手术相关的下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能迅速下降。存在HPA轴和下丘脑-垂体-甲状腺轴功能障碍时,给予糖皮质激素和甲状腺素替代治疗。尿崩症应适量饮水,必要时口服去氨加压素。对于延迟性低钠血症,需要确定原因,如果是由抗利尿激素分泌失调综合征引起的,应限制液体摄入;如果是脑盐耗综合征,则进行治疗以纠正低血容量并补充钠。
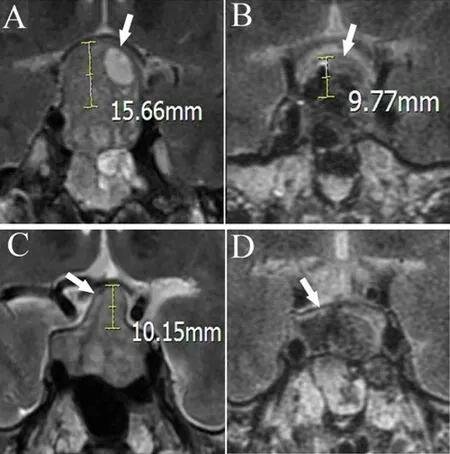
图1 MRI增强冠状位显示垂体腺瘤经蝶窦入路术后肿瘤腔高度变化
1.7 统计学分析 使用SPSS 15.0 软件分析;定量资料以x±s表示,采用t检验;定性资料采用χ2检验;应用多因素logistic回归模型分析迟发性低钠血症的危险因素;P<0.05 认为差异有统计学意义。
2 结果
2.1 术后迟发性低钠血症发生情况671例中,47例(7.0 %)术后发生迟发性低钠血症。发生时间在术后3~13 d,中位数7.5 d;血钠浓度114~131 mmol/L,平均(124.3 ±4.8 )mmol/L;治疗时间1~9 d,中位数3 d。
2.2 术后迟发性低钠血症的危险因素 单因素分析显示,性别、术后肿瘤腔高度变化、术前垂体功能减退、术后ACTH轴异常与术后迟发性低钠血症有关(P<0.05 ;表1)。多因素logistic回归分析显示,女性(OR=2.332 ;95%CI 1.117 ~4.869 ;P=0.024 )、术前存在垂体功能减退(OR=1.521 ,95%CI 1.278 ~2.974 ;P=0.041 )、术后ACTH轴异常(OR=1.740 ;95%CI 1.002 ~3.354 ;P=0.048 )、肿瘤腔高度显著变化(OR=4.574 ;95%CI 2.442 ~8.568 ;P<0.001 ;图1)是术后发生迟发性低钠血症的风险因素。
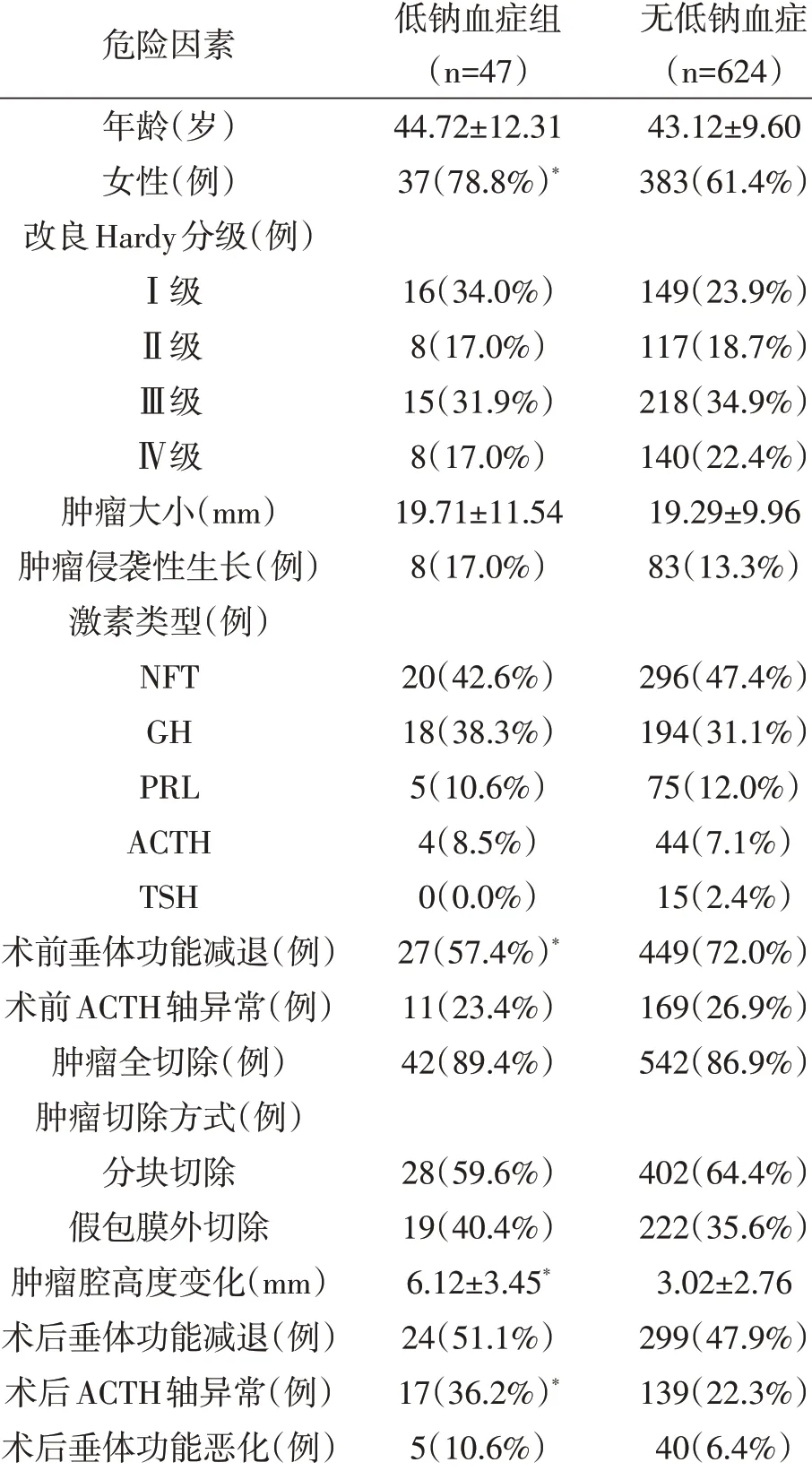
表1 本文671例垂体腺瘤经蝶窦入路术后继发迟发性低钠血症危险因素的单因素分析
3 讨论
3.1 垂体腺瘤术后迟发性低钠血症的发生率 低钠血症的临床表现具有多样性[2]。术后迷走神经刺激(头痛、压力、恶心)引起的抗利尿激素(antidiuretic hormone,ADH)分泌过多或手术导致ADH释放进入体循环,可能是主要的病理机制之一[7]。本文671例垂体腺瘤中,术后47例(7.0 %)出现迟发性低钠血症。这与既往研究基本一致[2,3~5,8]。
3.2 下丘脑-神经垂体系统因素 垂体腺瘤可延伸至海绵窦、鞍上间隙、蝶窦或斜坡。当垂体腺瘤生长时,可能会压迫垂体柄,导致其慢性变形,并可能导致垂体后叶位置的改变。ADH是神经垂体功能完整性的标志;然而,它的缺失并不一定意味着神经垂体功能受损。因此,垂体腺瘤术前很少出现尿崩症或抗利尿激素分泌异常综合征(syndrome of inappropriate antidiuretic hormone secretion,SIADH)。然而,在肿瘤切除后,ADH水平升高可能是术后低钠血症的一个原因[4,9]。术后垂体后叶会不受调节地释放ADH,导致体液潴留和尿钠排除增多[7]。有报道显示,即使ADH水平正常或较低,也会发生低钠血症[7,9]。在这种情况下,低钠血症是由心房利钠激素和脑利钠激素的作用导致的尿钠排放过多,而不是液体潴留,也称为脑性耗盐综合征。迟发性低钠血症的另一种可能机制是继发性肾上腺皮质功能不全[2,7]。尽管本文结果显示垂体腺瘤的激素类型与术后低钠血症没有明显相关性,但有研究表明,库欣病术后低钠血症的风险比泌乳素瘤高3倍,比无功能性腺瘤高2.8 倍[9]。本文结果表明,术后肾上腺功能不全是迟发性低钠血症的独立危险因素。皮质醇替代是否能预防术后低钠血症尚需进一步研究。此外,甲状腺功能减退可通过增加ADH水平和肾内机制导致低钠血症,对于术前有甲状腺功能减退的病人,可以适当补充甲状腺素以减少术后低钠血症。
3.3 肿瘤腔高度变化 最近,研究显示鞍膈下降可能是下丘脑-神经垂体束损伤的一个原因,可进一步导致术后SIADH[10]。然而,鞍膈薄或无鞍膈的病人没有鞍膈下降。我们测量手术前后肿瘤腔的高度,发现肿瘤腔高度显著变化与术后延迟性低钠血症的发生密切相关。测量肿瘤腔的高度比测量鞍膈的高度更容易,手术前后瘤腔高度的差异反映了肿瘤切除后,鞍膈、瘤囊、蛛网膜或扁平垂体组织在垂体腺瘤上方的下沉深度。这种下沉会拉扯、改变位置和形状,损害垂体柄,进一步导致SIADH。减少肿瘤腔的高度变化可能有助于减少对垂体柄的损害。因此,肿瘤切除后,肿瘤腔内应填充一定体积的明胶海绵或其他组织,以防止鞍膈降低,减少肿瘤腔内高度的变化,从而降低垂体柄的牵引程度。
3.4 性别 本文结果显示,女性性对于男性更易发生术后低钠血症。既往文献也有类似报道[11,12],但是具体原因尚不清楚。
总之,迟发性低钠血症是垂体腺瘤术后常见的并发症,尤其是女性、垂体功能减退的病人;肿瘤腔高度显著变化与术后迟发性低钠血症有关,建议肿瘤切除后填塞瘤腔。
