藤黄酸新型给药系统的研究进展
2022-07-18吕邵娃苏发丽郭玉岩李孟赵洋张欢李建民
吕邵娃 苏发丽 郭玉岩 李孟 赵洋 张欢 李建民



关键词藤黄酸;给药系统;生物利用度;临床应用
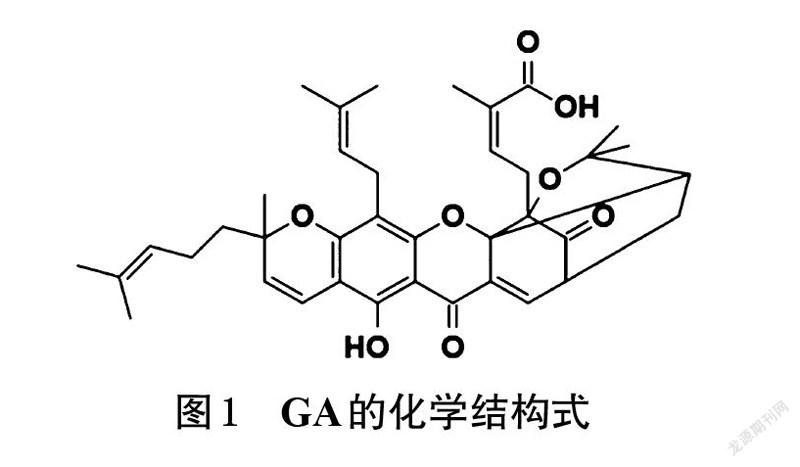
藤黄酸(gambogic acid,GA)是藤黄科植物藤黄树Garcinia hanburyi Hook. f.的主要活性成分[1] ,具体结构见图1。GA能够抑制多种肿瘤细胞的生长,如肺癌、肝癌、黑色素瘤、前列腺癌等[2-5]。GA具有溶解度低、半衰期短、稳定性差的缺点,从而限制了其在临床中的应用。相关研究发现,采用共价结合和物理包封法可获得具有靶向性、高渗透性、稳定性、生物兼容性、体内长循环等性质的新型GA给药系统。基于此,本研究对GA的新型给药系统进行综述,以期为GA的进一步开发及临床应用提供参考。
1 共价结合前药递送系统
为提高药物的稳定性、靶向性和溶解度等,将GA和药物载体以共价结合的方式连接在一起,形成前药递送系统,可避免药物在体内失活,增加药物的生物利用度,加强药物的靶向性,并降低药物的毒副作用。基于此,本文从聚合物前药递送系统、缺氧型前药递送系统等方面对不同类型的GA共价结合前药递送系统进行介绍。
1.1 聚合物前药递送系统
水溶性高分子载体聚乙二醇能够阻止脂质体与血清蛋白结合,减轻巨噬细胞的摄取作用,通过共价键与药物结合后,可延长药物的体内循环,并改变其体内分布[6]。Yu 等[7]开发了一种采用聚乙二醇-β-谷甾醇(PEG-SS)偶联物修饰的磷脂制备的GA 长循环脂质体。结果发现,与普通长循环脂质体相比,该制剂具有更好的长循环效果。Cai 等[8]通过酯键将甲氧基聚乙二醇(mPEG)-2000 连接到GA上,制备成两亲性聚合物-药物偶联物(GA-mPEG2000)胶束(制备过程具体见图2)。结果发现,与GA相比,该制剂具有更好的水溶性、抗肿瘤活性和稳定性,这可能是由于形成的胶束可保护GA不被酶解,从而使其缓慢释放至肿瘤细胞,并降低其对组织器官的毒副作用。
相关研究发现,低分子肝素(low-molecular weightheparin,LMWH)可通过肿瘤源性黏附因子、肝素结合性表皮生长因子、肝细胞生长因子、血管内皮生长因子和硫酸肝素蛋白多糖抑制肿瘤的侵袭、转移[9]。Yan 等[10]制备了GA接枝低分子肝素(GA-LMWH)(制备过程具体见图2),并在水溶液中自组装成胶束。进一步动物实验结果表明,与GA相比,GA-LMWH胶束不仅改善了肝癌模型小鼠的肝功能和病理形态,还显著延长了小鼠的寿命。
1.2 缺氧型前药递送系统
在缺氧条件下,具有缺氧敏感基团的药物可被激活,从而被释放出来。缺氧靶向近红外染料(Cy7)与GA共价结合后,可在水溶液中与表面蛋白自组装成新型“镶嵌型”纳米颗粒,该纳米颗粒最大的优点就是可以选择性地将负载的药物偶联物释放至缺氧的肿瘤细胞中,从而减少药物在肝脏中的非特异性积聚,进而提高抗肿瘤效果[11]。
1.3 磁场响应型前药递送系统
磁性Fe3O4纳米颗粒(MNP-Fe3O4)是一种具有良好化学稳定性、生物相容性和超顺磁性的纳米材料,已被广泛用于靶向性和缓释性药物载体的制备[12]。Zhang等[13] 使用二巯基琥珀酸(DMSA)修饰的氧化铁(DMSA-Fe3O4)磁性纳米颗粒与硼替佐米(BTZ)和GA聚合,得到化疗药物BTZ-GA/MNPs(制备过程具体见图3)。该药物可通过上调促凋亡蛋白的表达,下调抑凋亡蛋白的表达,诱导细胞凋亡,从而发挥较好的抗肿瘤作用。Wang 等[14]在氮气环境下,将Fe3+、Fe2+与氢氧化铵共沉淀制备得MNP-Fe3O4,再于4 ℃条件下通过机械吸收法将GA 与获得的MNP-Fe3O4 结合,即得GA-MNPFe3O4。当机体发生病变时,细胞膜的电位差可诱导GA-MNP-Fe3O4做出响应,从而释放GA,起到缓释和靶向作用。
1.4 多环境敏感型前药递送系统
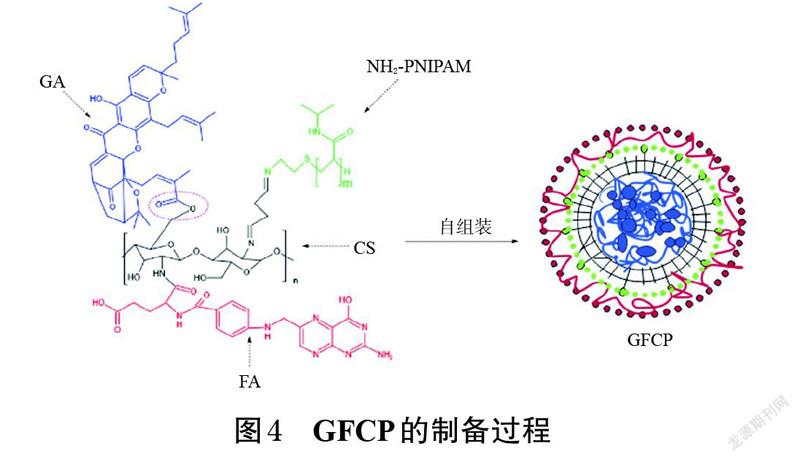
将多种响应型药物递送系统结合在一起是一种有效的治疗肿瘤的方法。Du 等[15]将叶酸-壳聚糖结合物(FA-CS)与端氨基热敏聚N- 异丙基丙烯酰胺(NH2-PNIPAM)络合,制备出壳聚糖接枝体(FA-CSPN),再将GA通过酯化作用与FA-CSPN 结合成多环境敏感型前药纳米胶束(GFCP)(制备过程具体见图4)。进一步对GFCP进行表征发现,该胶束具有较高的载药量,可靶向肿瘤,且对多种肿瘤微环境均具有响应性。
2 物理包封藥物递送系统
物理包封药物递送系统是采用乳化法、溶剂蒸发法、固相分散法、薄膜水合法、脂质插入法等物理制备方法将药物以非共价结合的方式包封于空白脂质体、纳米粒、胶束等药物载体中的新型给药系统。该给药系统制备简单、价格低廉,具有较好的应用前景。
2.1 纳米靶向药物递送系统
纳米结构脂质载体是固体和液体脂质的混合物,具有良好的生物相容性,且可在血液中长期停留,对肿瘤具有靶向性[16]。肿瘤穿透肽(RGERPPR)被证明对神经纤毛蛋白1 过度表达的肿瘤细胞具有高亲和力[17]。Liu等[18]采用乳化法和溶剂蒸发法制备了负载GA的非结合纳米脂质体(GA-NLC)。在此基础上,Huang 等[19]用RGERPPR 修饰GA-NLC,得到GA-NLC-RGE。结果发现,GA-NLC-RGE可显著抑制肿瘤生长。
电喷雾是一种制备直径从纳米到微米的单分散颗粒技术[20]。Yin 等[21]采用电喷雾技术制备了不同粒径的GA载药颗粒(GA-Ps),经药代动力学研究发现,不同粒径的GA-Ps 可靶向定位于不同器官,可用于靶向治疗各种恶性肿瘤(病灶)。
Fang 等[22]通过共轭亚油酸(LA)来修饰普朗尼克F68(pluronic F68,F68),以增加亲水-疏水相互作用,提高F68 纳米球的稳定性;将F68-亚油酸(F68-LA)偶联物与GA构建得到F68-LA/GA 纳米球。结果发现,该纳米球对人卵巢癌A2780 细胞具有较强的细胞毒性和促凋亡作用,可作为治疗卵巢癌的一种有前景的肿瘤靶向给药系统。
核-壳纳米颗粒(CS-NPs)结合了聚合物纳米颗粒、脂质体、胶束独特优势的同时,也解决了它们的一些局限性[23]。大多数CS-NPs 表现出受控释放行为[24]。Liu等[25]以苄酰胺化聚(γ-谷氨酸)(BzPGA)衍生物为核材料,全反式维甲酸两亲性透明质酸(HA)衍生物(HA-C6-ATRA)为壳材料,通过π-π堆积的非共價键相互作用,将GA封装于BzPGA中形成杂化纳米粒。结果发现,该纳米粒兼具稳定性和肿瘤靶向性,且抗肿瘤活性较强。
包载疏水性药物的内部核和外部亲水性壳构成的两亲性纳米粒[26],具有促进药物局部累积、延长药物体内循环的作用[27]。Zhang 等[28]采用单乳液法,将一定量的GA溶于氯仿中,与聚乙烯醇水溶液混匀、超声得到O/W型乳液,再于室温下搅拌,直至有机溶剂挥干,即得到负载GA的聚乙二醇聚己内酯纳米粒。结果发现,该纳米粒具有良好的稳定性、生物相容性和缓释特性,且肿瘤细胞对其吸收效果较好,具有时间依赖性。
2.2 生物聚合物降解胶束药物递送系统
生物聚合物降解胶束作为新型GA药物递送系统,解决了化疗药物水溶性、分散性和稳定性差的缺点[29-30]。Wang 等[31]用固体分散法将GA包封于单甲基聚乙二醇聚己内酯(MPEG-PCL)内形成载药纳米胶束。结果发现,该纳米胶束提高了GA的分散性和稳定性。相关研究表明,D-α-生育酚聚乙二醇1000 琥珀酸酯(TPGS)可提高抗肿瘤药物的溶解度,抑制P-糖蛋白介导的多药耐药[32]。聚合物泊洛沙姆407 具有生物相容性、生物降解性和低毒性;混合胶束具有稳定性好和载药率高的优点[33]。Saxena 等[34]采用薄膜水合法制备了负载GA的泊洛沙姆407/TPGS 混合胶束,结果表明,该混合胶束可使GA的释放持续4 d 以上,显著提高了GA的半衰期,增加了乳腺癌MCF-7 细胞及耐多药卵巢腺癌贴壁细胞(NCI/ADR-RES)对GA的摄取。
2.3 仿生纳米药物递送系统
作为外源性物质的纳米粒容易被免疫系统识别和清除,因此细胞膜仿生纳米药物递送系统逐步兴起。仿生纳米载体由合成共聚物和天然生物膜2 种材料组成,可延长药物体内循环,增加药物肿瘤部位蓄积[35]。Zhang 等[36]采用O/W乳液法制备了负载GA的PLGA纳米粒子(GA/PLGA NPs),然后采用脂质插入法将GA/PLGA 装载到表面修饰抗EGFR-iRGD 重组蛋白(anti-EGFR-iRGD)的红细胞膜纳米颗粒(RBCm-NPs)中,形成iE-RBCm-GA/PLGA NPs(具体制备过程见图5)。结果发现,该给药系统显著提高了GA对结直肠癌细胞的靶向能力和渗透性。这可能是由于红细胞膜与肿瘤细胞具有很好的生物兼容性,能够有效避免网状内皮系统的识别和吞噬作用,从而有效到达肿瘤部位。
2.4 氧化还原敏感型药物递送系统
阳离子氧化还原敏感型聚合物胶束(HECS-ss-OA)因缺乏肿瘤靶向性,在遇到血清蛋白介导的网状上皮系统时,易被聚集和消除[37]。HA因其具有电负性、低免疫原性、生物相容性、特异性而被用于屏蔽阳离子型壳聚糖胶束[38]。Xu等[39]将GA溶解于HECS-ss-OA 内核中形成(HECS-ss-OA)/GA,然后将HA 涂布于(HECS-ss-OA)/GA 外层,即得具有氧化还原敏感特性的HA(HECS-ss-OA)/GA。进一步研究表明,相较于未涂布HA 的(HECS-ss-OA)/GA,HA(HECS-ss-OA)/GA 表现出更高的细胞毒性。
3 结论
溶解性差、副作用多是小分子抗肿瘤药物的主要缺点,高效低毒的载体可以改善这类药物的缺点,并提高其生物利用度。目前已有的载体包括各种新型纳米粒和脂质体,对其表面进行修饰,能够提高药物的生物靶向性、载药量、渗透性。GA对多种肿瘤细胞的生长均有抑制作用,但其溶解度低、半衰期短,从而降低了其临床应用价值。通过对药物载体的设计可以解决GA存在的一系列缺点。在药物载体表面修饰肿瘤穿透肽,可增加GA对肿瘤细胞的靶向性和渗透性;在药物载体中引入多环境敏感型响应基团,可将GA靶向缓释至肿瘤部位;在药物载体表面修饰红细胞膜,可避免网状内皮系统对GA的识别和吞噬,并提高其生物兼容性。总之,药物载体的设计,较大程度地改善了GA的自身缺陷;GA药物载体中引入更多的响应基团可能会使其达到更好的抗肿瘤效果。
