多酚化合物LM49对大鼠离体胸主动脉的舒张作用及机制
2022-07-18张梦如高燕杨彩红赵承孝冯秀娥李青山
张梦如 高燕 杨彩红 赵承孝 冯秀娥 李青山

关键词多酚化合物;2,4′,5′-三羟基-5,2′-二溴二苯甲酮;血管环;舒张作用;钾通道;钙通道
高血压的全球发病率逐年升高,长期高血压会导致多种并发症。高血压病程的进展,可诱发冠状动脉粥样硬化,造成心脏损伤,严重威胁人类健康[1]。高血压发病后会出现血管张力异常。主动脉平滑肌的舒张对高血压的治疗尤为关键,诸多有效的高血压治疗药物最终都会直接或间接地引起血管舒张效应[1-2]。
海洋来源的多酚化合物具有抗炎、抗氧化、细胞毒、抑菌等多重生物活性[3-6],是海洋生物研究过程中发现的一类新型化合物。本课题组前期以海洋来源的卤酚化合物为先导化合物进行了结构优化和修饰,合成了系列多酚化合物。其中2,4′,5′-三羟基-5,2′-二溴二苯甲酮(LM49)具有显著的保护血管内皮细胞[7-8]、抗动脉粥样硬化[9]、保护缺血再灌注引发的心肌损伤[10]等药理作用,提示其对于高血压及心血管疾病的治疗具有重要研究价值。鉴于此,本研究选择本课题组前期获得的高活性多酚化合物LM49 为研究对象,考察其对大鼠离体胸主动脉的舒张作用,并进一步研究其作用机制,以期为LM49用于心脑血管疾病的治疗提供实验依据。
1 材料
1.1 主要仪器
SV-8 型离体组织器官恒温灌流装置购自成都泰盟软件有限公司;MLT0201/D 型高灵敏度张力传感器、PowerLab 数据采集分析系统购自埃德仪器国际贸易(上海)有限公司。
1.2 主要药品与试剂
多酚化合物LM49(批号20190315,纯度≥99%)为本课题组自制;乙二醇双(2-氨基乙基醚)四乙酸(EGTA,批号E8050)购自北京索莱宝科技有限公司;羟乙基哌嗪乙硫磺酸(HEPES,批号H7523,纯度≥99%)、去甲肾上腺素原料药(批号SML0305,纯度≥97%)、乙酰胆碱原料药(批号A6625,纯度≥99%)、左旋硝基精氨酸甲酯原料药(L-nitro-arginine methyleste,L-NAME,批号N5751,纯度≥98%)、吲哚美辛原料药(批号I7378,纯度≥98%)、四乙基胺(批号T0886,纯度≥99%)、4-氨基吡啶(批号A78403,纯度≥98%)、格列苯脲原料药(批号Y0001511,纯度≥99%)、BaCl2(批号202738,纯度≥99%)、硝苯地平原料药(批号N7634,纯度≥98%)、维拉帕米原料药(批号V4629,纯度≥99%)、毒胡萝卜素原料药(批号T9033,纯度≥98%)均购自德国Sigma 公司;其余试剂均为分析纯,水为双蒸水。
1.3 动物
本研究所用动物为健康SPF级SD大鼠,共80 只,雄性,体质量为250~300 g,由山西医科大学实验动物中心提供,实验动物使用许可证号为SYXK(晋)2019-0004。将大鼠分笼饲养(每笼3 只),饲养环境温度为(22±2)℃、相对湿度为40%~60%。饲养期间大鼠正常摄食和饮水,适应性饲养7 d 后进行实验。本研究经山西医科大学实验动物伦理委员会批准后实施,批准号为SYDL2021001。
2 方法
2.1 大鼠胸主动脉血管环的制备及处理
2.1.1 内皮完整血管环将大鼠麻醉后,脱臼处死,取其主动脉,放入4 ℃预冷的生理盐溶液(含144 mmol/LNaCl、5.8 mmol/L KCl、1.2 mmol/L MgCl2、2.5 mmol/LCaCl2、11.1 mmol/L 葡萄糖、5 mmol/L HEPES,pH=7.4)中充分分离。将分离干净的血管剪成3~4 mm的分段血管环,置于37 ℃充氧的10 mL浴槽中。将血管环的下端固定,上端连接张力传感器,采用PowerLab 数据采集分析系统记录血管环的张力变化。将基础张力调至2 g,浴槽内每间隔15 min 换1 次生理盐溶液,平衡稳定1 h。然后采用PowerLab 数据采集分析系统记录血管环的张力,即为血管环基础张力。
2.1.2 去内皮血管环取“2.1.1”项下分离的干净血管环,使用与主动脉内径相当的棉棒穿入血管内摩擦其内壁2 次,以求完全去除血管内皮。用KCl(60 mmol/L)生理盐溶液(含89.8 mmol/L NaCl、60 mmol/L KCl、1.2mmol/L MgCl2、2.5 mmol/L CaCl2、11.1 mmol/L 葡萄糖、5 mmol/L HEPES,pH=7.4)預收缩血管环2 次,以诱发血管环的最大收缩幅度。待其稳定达到坪值后(连续2次同样刺激所引起血管环的收缩幅度的差别小于5%),加入去甲肾上腺素(1×10-6 mol/L)使血管环收缩。待血管张力稳定后,加入乙酰胆碱(1×10-5 mol/L)检查血管环的内皮是否完整。以去甲肾上腺素刺激血管环收缩后的稳定张力为100%,计算乙酰胆碱引起血管环舒张的百分比:舒张血管百分比(%)=(去甲肾上腺素诱发的血管环最大收缩张力-加入乙酰胆碱后血管环张力)/(去甲肾上腺素诱发的血管环最大收缩张力-去甲肾上腺素诱发前血管环张力)×100%。该百分比值>70%视为内皮完整,<5%视为内皮去除完全[11]。待内皮功能检测完,更换生理盐溶液使血管环恢复至基础状态,然后采用PowerLab 数据采集分析系统记录血管环的张力,即为血管环基础张力。
2.2 LM49对大鼠血管环的舒张作用
取“2.1.1”项下内皮完整血管环,加入去甲肾上腺素(1×10-6 mol/L)刺激,使其收缩。待其张力稳定后,分为LM49 给药组和硝苯地平阳性对照组,按累积加药法每隔10 min加入药物,使LM49的终浓度为3×10-7、1×10-6、3×10-6、5×10-6、1×10-5 mol/L[溶剂二甲基亚砜(DMSO)的体积分数分别为0.000 3% 、0.001% 、0.003% 、0.005%、0.01%],硝苯地平的终浓度为1×10-10、3×10-10、1×10-9、3×10-9、1×10-8、3×10-8、1×10-7、3×10-7、1×10-6mol/L[12]。将血管环与张力换能器连接,采用PowerLab数据采集分析系统记录血管环的张力变化,并计算药物舒张血管百分比:药物舒张血管百分比(%)=(去甲肾上腺素诱发的血管环最大收缩张力-给药后血管环张力)/(去甲肾上腺素诱发的血管环最大收缩张力-血管环基础张力)×100%。每组平行考察6个血管环。
2.3 LM49对内皮完整和去内皮血管环张力的影响
取“2.1”项下内皮完整血管环和去内皮血管环,分别加入去甲肾上腺素(1×10-6 mol/L)或KCl(60 mmol/L)生理盐溶液刺激,使其收缩。待血管环张力稳定后,分为LM49 给药组和溶剂对照组(加入相应体积分数的DMSO),按照“2.2”项下方法给药。分别测定各组血管环的张力,并计算LM49 舒张血管百分比:LM49 舒张血管百分比(%)=(去甲肾上腺素或KCl 诱发的血管环最大收缩张力-给予LM49 后血管环张力)/(去甲肾上腺素或KCl 诱发的血管环最大收缩张力-血管环基础张力)×100%。每组平行考察6个血管环。
2.4 L-NAME和吲哚美辛对LM49 舒张血管环作用的影响
取“2.1.1”项下内皮完整血管环,分别用一氧化氮合酶抑制剂L-NAME(0.1 mmol/L)或环氧合酶抑制剂吲哚美辛(1×10-5 mol/L)预孵育20 min,作为L-NAME 预孵育组、吲哚美辛预孵育组;另设LM49 对照组,不加入L-NAME 或吲哚美辛预孵育。随后各组均加入去甲肾上腺素(1×10-6 mol/L)刺激血管环,使其收缩,记录其张力变化。待血管环张力稳定后,各组均按照“2.2”项下方法累积加入LM49,分别测定各组血管环的张力,并计算LM49 舒张血管百分比,分析L-NAME 和吲哚美辛对LM49 舒张血管环作用的影响。每组平行考察6 个血管环。
2.5 钾通道阻滞剂对LM49 舒张血管环作用的影响
取“2.1.1”项下内皮完整血管环,分别加入4 种钾通道阻滞剂——四乙基胺(5 mmol/L)、格列苯脲(1×10-5mol/L)、BaCl(2 0.1 mmol/L)、4-氨基吡啶(1 mmol/L)预孵育20 min,作为四乙基胺预孵育组、格列苯脲预孵育组、BaCl2预孵育组和4-氨基吡啶预孵育组;另设LM49 对照组(浓度设置同“2.2”项下),不加入四乙基胺、格列苯脲、BaCl2、4-氨基吡啶预孵育。随后各组均加入去甲肾上腺素(1×10-6 mol/L)刺激血管环,使其收缩,记录其张力变化。待血管环张力稳定后,各组均按照“2.2”项下方法累积加入LM49,分别测定各组血管环的张力,并计算LM49 舒张血管百分比,分析钾通道阻滞剂对LM49 舒张血管环作用的影响。每组平行考察6 个血管环。
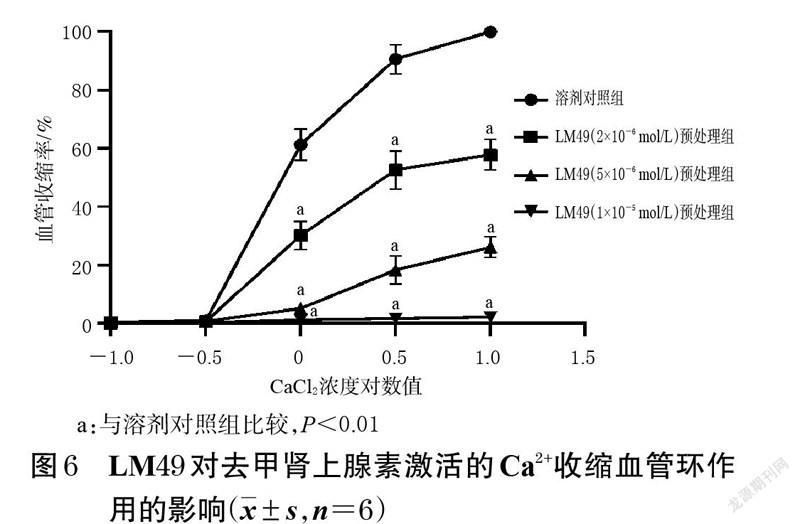
2.6 LM49 对去甲肾上腺素激活的Ca2+收缩血管环作用的影响
取“2.1.2”项下去内皮血管环,先用无钙生理盐溶液(含144 mmol/L NaCl、5.8 mmol/L KCl、1.2 mmol/LMgCl2、11.1 mmol/L 葡萄糖、5 mmol/L HEPES、0.5 mmol/LEGTA,pH=7.4)冲洗30 min,然后将血管环分为LM49预处理组和溶剂对照组。LM49 预处理组用不同浓度的LM49(2×10-6、5×10-6、1×10-5 mol/L,溶劑DMSO的体积分数分别为0.002%、0.005%、0.010%)对血管环进行预处理,溶剂对照组加入相应量DMSO 进行预处理。20min 后,各组分别加入去甲肾上腺素(1×10-6 mol/L)和钙通道阻滞药维拉帕米(1×10-6 mol/L),15 min 后累积加入CaCl(2 0.1、0.3、1、3、10 mmol/L)。记录血管环张力变化,并计算血管收缩率:血管收缩率(%)=(LM49 预处理组累积加入CaCl2后血管环张力-LM49 预处理组加入CaCl2前血管环张力)/(溶剂对照组累积加入CaCl2诱发的血管环最大收缩张力-溶剂对照组加入CaCl2前血管环张力)×100%。比较LM49 预处理组与溶剂对照组的收缩效应,分析LM49 对去甲肾上腺素激活的Ca2+收缩血管环作用的影响。每组平行考察6 个血管环。
2.7 LM49对KCl激活的Ca2+收缩血管环作用的影响
取“2.1.2”项下去内皮血管环,用无钙生理盐溶液冲洗30 min,换为无钙KCl(60 mmol/L)生理盐溶液(含89.8 mmol/L NaCl、60 mmol/L KCl、1.2 mmol/L MgCl2、11.1 mmol/L 葡萄糖、5 mmol/L HEPES、0.5 mmol/LEGTA,pH=7.4)预孵育10 min,然后分为LM49 预处理组和溶剂对照组。按照“2.6”项下方法给药,20 min 后,各组均累积加入CaCl2(0.1、0.3、1、3、10 mmol/L),记录血管环张力变化,并计算血管收缩率。比较LM49 预处理组与溶剂对照组的收缩效应,分析LM49 对KCl 激活的Ca2+收缩血管环作用的影响。每组平行考察6 个血管环。
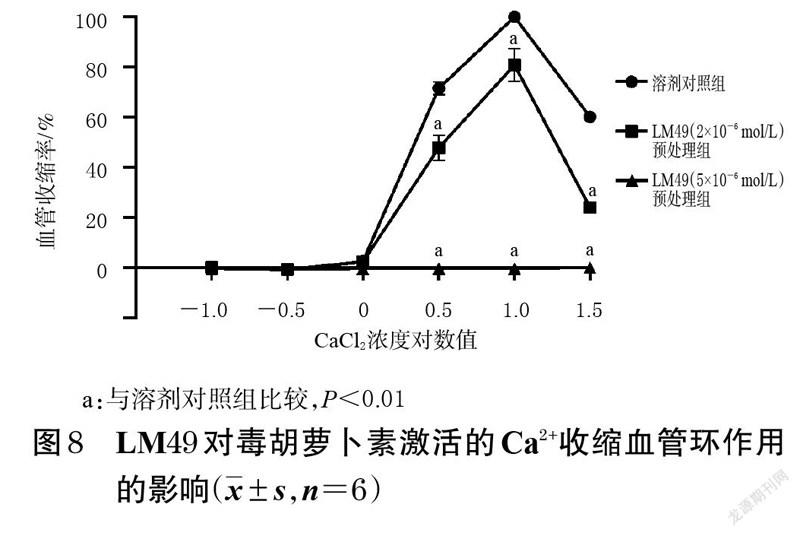
2.8 LM49 对毒胡萝卜素激活的Ca2+收缩血管环作用的影响
取“2.1.1”项下内皮完整血管环,用无钙生理盐溶液冲洗30 min,连续3 次用去甲肾上腺素(1×10-6 mol/L)诱导血管环收缩,然后加入肌浆网Ca2+-腺苷三磷酸(ATP)酶泵抑制剂毒胡萝卜素(1×10-6 mol/L)抑制肌浆网/内质网Ca2+泵活性。20 min 后,将血管环分为LM49 预处理组和溶剂对照组,LM49 预处理组分别用不同浓度的LM49(2×10-6、5×10-6 mol/L,溶剂DMSO的体积分数分别为0.002%、0.005%)对血管环进行预处理,溶剂对照组加入相应量的DMSO进行预处理。20 min 后,各组均累积加入CaCl(2 0.1、0.3、1、3、10、30 mmol/L),记录血管环张力变化,并计算血管收缩率。比较LM49 预处理组与溶剂对照组的收缩效应,分析LM49 对毒胡萝卜素激活的Ca2+收缩血管环作用的影响。每组平行考察6 个血管环。
2.9 统计学方法
采用SPSS 20.0 软件对数据进行统计分析。结果以x±s 表示。采用GraphPad Prism 8 软件绘制浓度对数值-舒张效应曲线,两组量效曲线间的比较采用双因素方差分析,采用Bonferroni’s test 检验比较两对应点间的差异。检验水准α=0.05。
3 结果
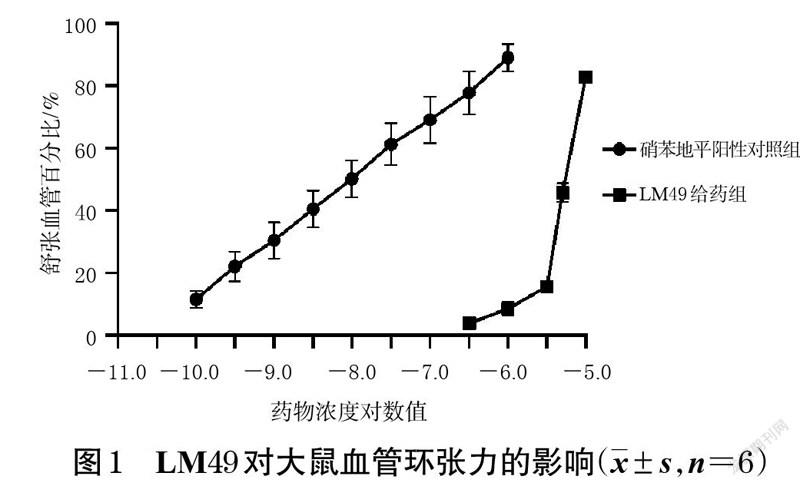
3.1 LM49对大鼠血管环的舒张作用考察结果
LM49 对去甲肾上腺素预收缩的血管环有较好的舒张作用,且有明显的量效趋势。结果见图1。
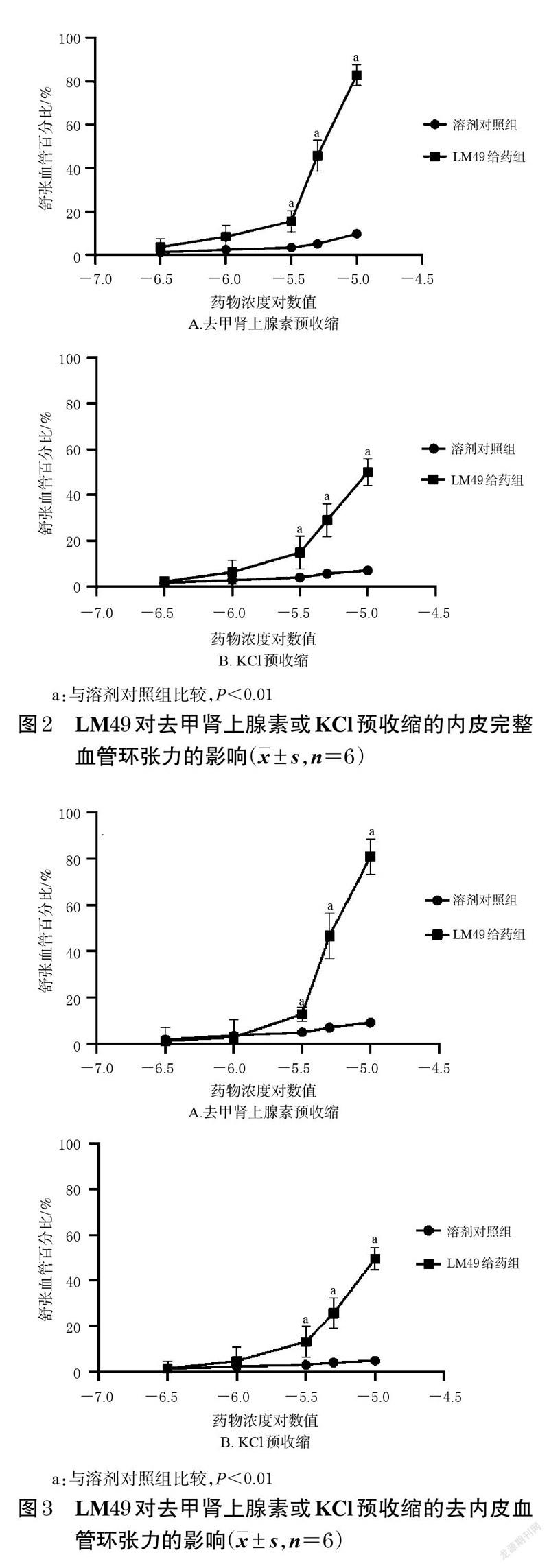
3.2 LM49对内皮完整和去内皮血管环张力的影响结果
与溶剂对照组比较,LM49 给药组经去甲肾上腺素或KCl预收缩的内皮完整和去内皮血管环在LM49 给药浓度为3×10-6、5×10-6、1×10-5 mol/L 时的舒张血管百分比均显著升高(P<0.01),提示LM49 对经去甲肾上腺素或KCl 预收缩的内皮完整和去内皮血管环均有舒张作用,且具有浓度依赖趋势。在不同浓度的LM49 作用下,内皮完整血管环与去内皮血管环的舒张血管百分比差异均无统计学意义(P>0.05),提示LM49 对血管环的舒张作用与血管环内皮是否完整无关。结果见图2、图3。
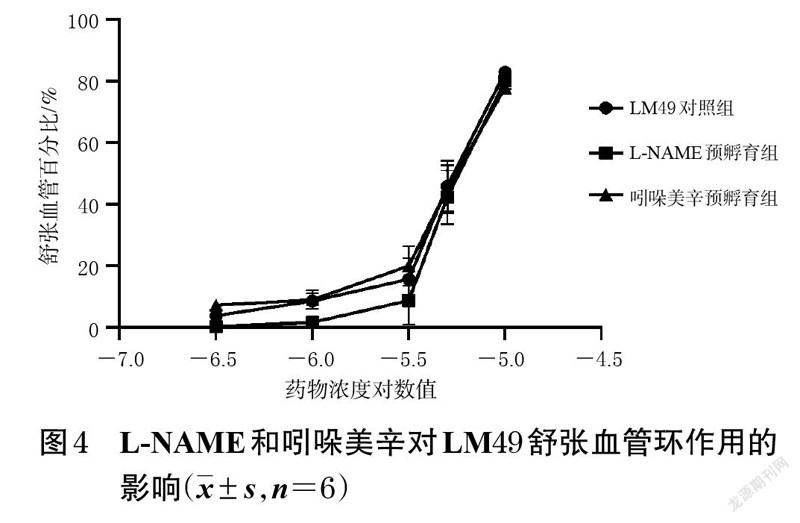
3.3 L-NAME和吲哚美辛对LM49 舒张血管环作用的影响结果
与LM49 对照组比较,L-NAME预孵育组和吲哚美辛预孵育组经去甲肾上腺素预收缩的内皮完整血管环在不同浓度LM49 作用下的舒张血管百分比差异均无统计学意义(P>0.05),表明LM49 舒张血管的作用不受L-NAME、吲哚美辛的影响。结果见图4。
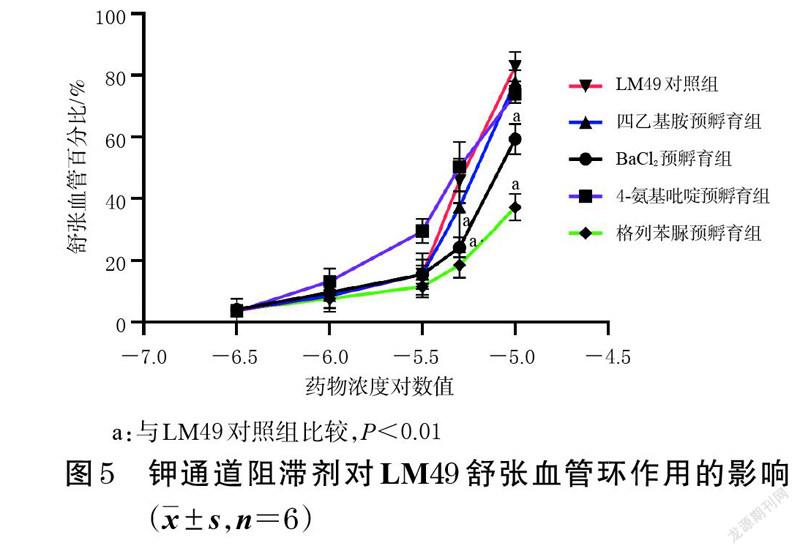
3.4 钾通道阻滞剂对LM49舒张血管环作用的影响结果
与LM49 对照组比较,四乙基胺预孵育组和4-氨基吡啶预孵育组经去甲肾上腺素预收缩的血管环在不同浓度LM49 作用下的舒张血管百分比差异均无统计学意义(P>0.05),而格列苯脲预孵育组和BaCl2 预孵育组经去甲肾上腺素预收缩的血管环在LM49 浓度为5×10-6、1×10-5 mol/L 作用下的舒张血管百分比均显著降低(P<0.01)。结果表明,格列苯脲和BaCl2 均可减弱LM49 对去甲肾上腺素预处理血管环的舒张效应。结果见图5。
3.5 LM49 对去甲肾上腺素激活的Ca2+收缩血管环作用的影响结果
与溶剂对照组比较,LM49 预处理组经去甲肾上腺素刺激的去内皮血管环在CaCl2浓度为1、3、10 mmol/L时的血管收缩率均显著降低(P<0.01)。结果见图6。
3.6 LM49对KCl激活的Ca2+收缩血管环作用的影响结果
与溶剂对照组比较,5×10-6、1×10-5 mol/L LM49 预处理组经KCl 预刺激的去内皮血管环在CaCl2 浓度为1、3、10 mmol/L 时,以及2×10- 4 mol/L LM49 预处理组经KCl 预刺激的去内皮血管环在CaCl2 浓度为3、10mmol/L时的收缩率均显著降低(P<0.01)。结果见图7。
3.7 LM49 对毒胡萝卜素激活的Ca2+收缩血管环作用的影响结果
与溶剂对照组比较,LM49 预处理组经去甲肾上腺素预刺激后加入毒胡萝卜素的内皮完整血管环在CaCl2浓度为3、10、30 mmol/L 时的血管收缩率均显著降低(P<0.01)。结果见图8。
4 讨论
本研究发现,LM49 具有血管舒张效应,且去除血管内皮后并不影响LM49 对大鼠离体主动脉环的舒张效应。一氧化氮合酶活性可反映血管内皮细胞功能和血管组织的舒张功能;环氧合酶介导血管内皮收缩因子的产生,影响血管内皮的收缩[13-14]。本研究发现,一氧化氮合酶抑制剂L-NAME及环氧合酶抑制剂吲哚美辛不能减弱LM49 的血管舒张效应,由此推断,LM49 对血管的舒张效应与内皮层的完整性无关,其可能直接作用于血管平滑肌。
钾通道在调节平滑肌紧张性的过程中至关重要,动脉的平滑肌细胞包含4 种不同类型的钾通道,分别是钙激活型钾通道、电压门控钾通道、ATP 敏感型钾通道和内向整流型钾通道[15]。当血管平滑肌细胞膜上的钾通道开放时,K+外流,引起膜电位的超极化,接着关闭电压门控钙通道使Ca2+内流减少,从而诱导血管扩张。本研究发现,ATP敏感型钾通道阻滞剂格列苯脲及内向整流型钾通道阻滞剂BaCl2可以明显抑制LM49 对大鼠主动脉血管环的舒张效应,表明LM49 可以通过激活ATP 敏感型钾通道和内向整流型钾通道,引发膜电位的超极化,进而诱导血管舒张。
在血管平滑肌的兴奋-收缩偶联过程中,高浓度的KCl可引发胞膜的去极化,使电压门控钾通道开放,促进Ca2+流入胞内,引起胞内Ca2+浓度增加,造成肌球蛋白轻链磷酸化,从而引发持续的平滑肌收缩[16]。本研究发现,LM49 能够直接抑制KCl引起的平滑肌收缩。此外,在无钙环境中,用高浓度的KCl 使主动脉去极化后,LM49 可以抑制该情况下由CaCl2 引起的平滑肌收缩。由此表明,LM49 可以抑制Ca2+通过电压门控钙通道内流。去甲肾上腺素作用于血管α1受体后,激活了G蛋白与磷脂酶C,产生三磷酸肌醇,引起肌浆网中的储钙释放,而后Ca2+通过受体操控钙通道流入胞内[17]。本研究发现,LM49 能够明显抑制去甲肾上腺素刺激引起的血管环收缩。这表明LM49 可拮抗Ca2+由受体操控钙通道流入胞内,从而介导其对血管的舒张效应。
當肌浆网中的储钙消耗后,会引起Ca2+通过钙库操纵性钙通道内流,这也是非兴奋细胞Ca2+内流的重要途径。毒胡萝卜素是常见的肌浆网Ca2+-ATP酶泵抑制剂,常用于减少胞内钙池中Ca2+,使钙库操纵性钙通道开放[18]。本研究发现,当加入去甲肾上腺素及毒胡萝卜素使钙池内Ca2+耗竭后,LM49 可以减弱CaCl2通过钙库操纵性钙通道引起的血管收缩。这表明LM49 可能参与了激活Ca2+-ATP酶,其舒张血管效应与钙库操纵性钙通道有关。
综上所述,LM49 对大鼠离体主动脉具有明确的舒张效应。其具体机制可能为诱导ATP敏感型钾通道、内向整流型钾通道开放,及抑制细胞外Ca2+通过电压门控钙通道、受体操控钙通道、钙库操纵性钙通道内流。
