紫色桑葚和白色桑葚总酚含量、抗氧化能力及代谢指纹图谱差异分析
2022-07-16刘晴晴李勇张明霞余向阳杨晨晔武国华
刘晴晴 李勇 张明霞 余向阳 杨晨晔 武国华

摘要: 為深入了解桑葚的营养价值,本研究重点比较了紫色桑葚和白色桑葚样品中总酚含量、抗氧化能力以及代谢图谱差异。结果表明,2种颜色的桑葚总酚含量和抗氧化能力存在明显差异,紫色桑葚抗氧化能力明显高于白色。基于LC-QTOF/MS的代谢组学分析结果表明,2种颜色的桑葚代谢图谱存在明显差异,共筛选出136种差异代谢物,包括类黄酮、花色苷、酚酸、氨基酸、核苷类、有机酸、糖类、脂类等。紫色桑葚样品中类黄酮、花青素物质含量比白色桑葚多。白色桑葚中常见酚酸含量(阿魏酸、二咖啡酰奎宁酸、香豆酸和绿原酸)明显高于紫色桑葚。紫色桑葚中糖醇和糖磷酸含量较高,而白色桑葚中二糖和三糖物质含量较高;紫色桑葚中葡萄糖酸、哌啶酸、黏液酸、琥珀酸等有机酸含量较高,而白色桑葚中奎尼酸、柠檬酸、苹果酸、马来酸含量较高,说明2种颜色的桑葚糖酸风味来源可能不同。紫色桑葚中亮氨酸、缬氨酸、异亮氨酸含量较高,而白色桑葚中与次级代谢物的合成前体相关的苯丙氨酸、色氨酸、络氨酸含量较高。此外,紫色桑葚中核苷类物质含量较高,而白色桑葚中生物碱及脂类物质含量较多。基于差异代谢物的代谢通路分析发现,紫色桑葚和白色桑葚差异代谢通路主要包括类黄酮代谢、亚油酸代谢、异奎宁生物碱合成、苯丙氨酸代谢等。
关键词: 桑葚; 代谢组学; 总酚含量; 抗氧化能力; 代谢通路
中图分类号: S663.9 文献标识码: A 文章编号: 1000-4440(2022)03-0813-08
Differences in total phenol content, antioxidant activity and metabolic fingerprint between purple mulberry and white mulberry
LIU Qing-qing 1,2,3 , LI yong 2,3 , ZHANG Ming-xia 2 , YU Xiang-yang 2 , YANG Chen-ye 4 , WU Guo-hua 1
(1.School of Biotechnology, Jiangsu University of Science and Technology, Zhenjiang 212000, China; 2.Jiangsu Key Laboratory for Food Quality and Safety-State Key Laboratory Cultivation Base, Ministry of Science and Technology, Nanjing 210014, China; 3.School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212000, China; 4.Central Laboratory, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China )
Abstract: To further understand the nutritional value of mulberry, the total phenol content, antioxidant activity and metabolic fingerprint in purple and white mulberries were compared. The results showed that there were significant differences in total phenol content and antioxidant capacity between the two colors of mulberry, and the antioxidant capacity of purple mulberry was significantly higher than that of white mulberry. The results of metabolomics analysis based on LC-QTOF/MS revealed that there were significant differences in metabolic profiles between purple and white mulberries. A total of 136 metabolites with significant difference were selected, including flavonoids, anthocyanins, phenolic acids, amino acids, nucleosides, organic acids, sugars, lipids, and so on. The contents of flavonoids and anthocyanins in purple mulberries were higher than those in white mulberries. The contents of common phenolic acids (ferulic acid, dicaffeoylquinic acid, coumaric acid and chlorogenic acid) in white mulberry were significantly higher than those in purple mulberry. The contents of sugar alcohol and sugar phosphoric acid in purple mulberry were higher, while the contents of disaccharide and trisaccharide in white mulberry were higher. The contents of organic acids such as gluconic acid, piperidic acid, muconic acid and succinic acid in purple mulberry were higher, while the contents of quinic acid, citric acid, malic acid and maleic acid in white mulberry were higher, indicating that the sugar and acid flavor sources in purple and while mulberries may be different. The contents of leucine, valine and isoleucine in purple mulberry were higher, while the contents of phenylalanine, tryptophan and tyrosine related to the synthetic precursors of secondary metabolites were higher in white mulberry. In addition, the content of nucleosides in purple mulberry was higher, while the contents of alkaloids and lipids in white mulberry were higher. Based on the analysis of metabolic pathways of differential metabolites, the important pathways included the flavonoid metabolism, linoleic acid metabolism, isoquinine alkaloid synthesis, phenylalanine metabolism, etc.
Key words: mulberry; metabolomics; total phenol content; antioxidant activity; metabolic pathway
桑葚是桑科桑属多年生木本植物桑树的果实,椭圆形,表面不平滑。桑葚未成熟时为绿色,逐渐成长变为白色、红色,成熟后为紫红色或紫黑色,味酸甜 [1] 。《本草新编》有“紫者为第一,红者次之,青则不可用”的记载 [2] 。古代医书《本草图经》中记载桑葚“其实椹,有白、黑二种,最干。” 由此我们可以看出桑葚品种并不单一。同样白桑葚也是桑葚的一种。而白桑葚果实颜色为白里透亮,吃起来果汁饱满,味道甜美。
桑葚中含有多种功能性成分,如芦丁、花青素、白黎芦醇等,具有良好的防癌、抗衰老、抗溃疡、抗病毒等作用 [3] 。现代医学研究结果表明,桑葚具有良好的体内、体外抗氧化能力,并对治疗糖尿病、贫血、高血压、高血脂、冠心病、神经衰弱等病症具有辅助功效 [4] 。作为药食同源的农副产品,桑葚除供日常食用外,在功能食品、医疗美容和医药领域的应用也受到越来越多的关注。植物果实中存在的天然产物如多酚、黄酮类化合物及花色苷等物质,可以起到保持人体健康、预防慢性疾病的作用,其中天然黄酮类及花青素类存在于绝大多数植物果实中,它在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要作用 [5] 。桑葚中除桑葚多糖外还富含其他活性成分,且最终得到不同颜色的桑葚可能是因为其中含有的花青素及黄酮类物质含量的差异造成的。
代谢组学是生物组学中新发展起来的一门学科 [6-7] ,是利用高通量化学分析技术对生物的小分子代谢物进行定性分析和定量分析,代谢组学允许同时表征大量的化学分子和生物材料,为植物源性食品提供详细、准确的代谢物构成分析 [8] ,且在营养科学 [9] 、植物代谢等方面具有广泛的应用。Roessner等 [10] 利用气相色谱-质谱(GC-MS)对马铃薯块茎中150种化合物进行了定量和定性分析。方贤胜等 [11] 利用高效液相色谱串联质谱广泛靶向代谢组学的方法,分析比较2种不同颜色种皮核桃的成分差异。赵君等 [12] 通过广泛靶向代谢组学的方法,分析2种不同花色的观赏向日葵的代谢物差异,发现花青素类物质可能是花呈现紫色的主要原因。
本研究以白色和紫色2种颜色的桑葚为研究对象,首先分析2种颜色的桑葚代谢物提取液中总酚含量及抗氧化能力差异,然后基于高效液相色谱飞行时间质谱(LC-QTOF/MS)的代谢组学方法对桑葚提取液中的代谢物种类进行测定,对其组成和含量差异进行比较分析,并从差异代谢物的角度,解释桑葚类黄酮、多酚类物质组成及桑葚颜色差异。研究结果将为桑葚在育种、加工等方面提供试验依据,同时为其作为新资源食品奠定基础。
1 材料与方法
1.1 试验材料与试剂
采集新疆喀什地区成熟、大小一致的紫色和白色桑葚(图1),每个样品包含10颗桑葚,2种颜色桑葚样品各包括8个平行样,将新鲜桑葚采摘后迅速置于液氮中,并保存于-80 ℃ 冰箱,待用。
植物总酚测定试剂盒、FRAP法总抗氧化能力测定试剂盒、ABTS法总抗氧化能力测定试剂盒均购于南京建成生物工程研究所。甲醇(德國merck公司产品)、乙腈(德国merck公司产品)、甲酸(美国fisher公司产品) 均为色谱纯。
1.2 仪器与设备
高速冷冻离心机(KDC-220HR, 中科中佳科学仪器有限公司产品),超纯水(Direct-Q5 UV,美国Millipore公司产品),LC-MS为高效液相色谱(ExionLC AD,美国SCIEX公司产品)串联三重四级杆质谱(AB SCIEX QTRAP 5500+, SCIEX中国公司产品),LC-QTOF-MS为高效液相色谱(岛津LC-20A,日本岛津公司产品)串联飞行时间质谱(AB SCIEX QTOF 5600+,美国SCIEX公司产品)。
1.3 样品预处理
将低温保存的桑葚样品进行低温冻干,用研磨仪研磨(30 Hz,2 min)至粉末状。准确称取桑葚样品粉末100 mg于10 ml的试管中,加入3 ml 80%甲醇水,震荡15 min后10 000 r/min 离心10 min,取上清液过0.22 μm有机微孔滤膜,用于LC-QTOF/MS仪器测定和总酚含量及抗氧化能力测定。
1.4 总酚含量及抗氧化能力测定
桑葚样品总酚含量和抗氧化能力测定采用总酚检测试剂盒。根据碱性条件下,酚类物质会将钨钼酸还原的原理,取50 μl样品提取液,与250 μl酶溶液混合,静置2 min,向混合液中加入250 μl钨钼酸反应液,温室孵育10 min后,在760 nm处测吸光度值,总酚含量以μmol/g 表示。抗氧化能力采用ABTS法和FRAP法进行测定。ABTS法:取10 μl样品待测液,向其加入20 μl酶溶液,再加入170 μl ABTS工作液,温室反应6 min后,在405 nm处测吸光度值,结果以μmol/g,Trolox表示;FRAP法:将5 μl样品待测液与180 μl FRAP工作液进行混合,37 ℃孵育5 min,在波长593 nm处测定吸光值以反映样品的抗氧化能力,抗氧化能力以μmol/g , FeSO4 表示。
1.5 代谢组学分析
本试验基于LC-QTOF/MS对桑葚样品代谢图谱进行检测,正电离模式流动相为0.1%甲酸/水(A)和乙腈(B),负电离模式流动相为5 mmol/L 甲酸铵(A)和乙腈(B)。流动相梯度洗脱程序为:0~ 3.0min,10%B;3.0~ 21.0 min,10%~ 95%B;21.0~ 28.0 min,95%B;28.0~ 28.1 min,10%B;28.1~ 34.0 min,10%B。QTOF/MS扫描模式为信息依赖型(IDA)全扫模式,质量扫描范围为50~ 1 000 m/z ,正、负电离模式的源电压分别为5 500 V和4 500 V,帘气、雾化器(gas1)和加热气体(gas2)的流动压力分别为172 KPa、345 KPa和345 KPa。碰撞能量( CE )分别为30 V和-30 V 。利用MS-DIAL软件对LC-QTOF-MS数据进行分析,基于Matlab软件对2种颜色的桑葚代谢图谱进行主成分分析(PCA),基于 t-test ( P < 0.05)和倍数变化( fold-change >1.50或<0.67)进行差异质谱峰筛选;通过分析保留时间、质量精度和同位素比值以及与自建数据库和公共数据库(包括MassBank、LipidBlast、GNPS、MetaboBASE)进行MS/MS相似性匹配来进行化合物鉴定;基于MetaboAnalyst软件对差异代谢物进行代谢通路分析。
2 结果与分析
2.1 总酚含量及抗氧化能力分析
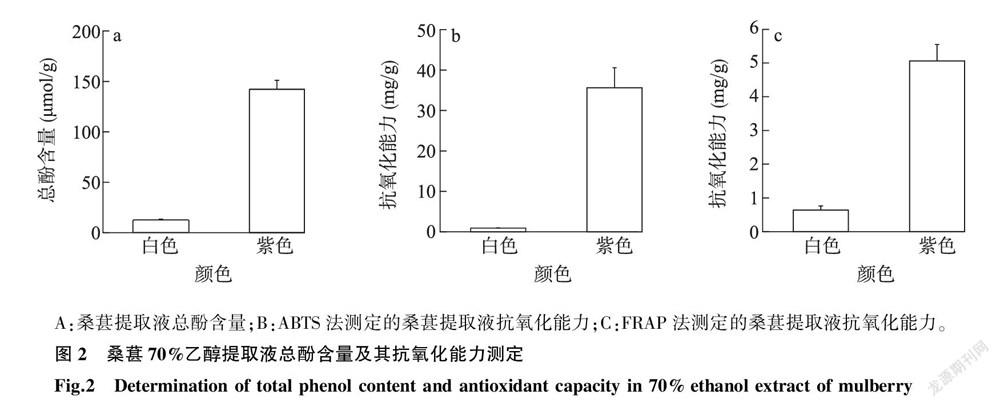
由图2可知,白色和紫色桑葚总酚含量及抗氧化能力差异明显,白色桑葚和紫色桑葚提取液中总酚含量分别是12.19 μmol/g 、142.24 μmol/g ,紫色桑葚样品的总酚含量与白色桑葚有明显差异( P < 0.05)。桑葚提取液的抗氧化能力变化趋势与总酚含量变化趋势一致,紫色桑葚样品的抗氧化能力为35.60 mg/g,Trolox(ABTS法测定)和5.06 mg/g,FeSO4 (FRAP法测定),白色桑葚样品的抗氧化能力为0.90 mg/g ,Trolox(ABTS法)和0.46 mg/g ,FeSO4 (FRAP法),其中紫色桑葚抗氧化能力是白色桑葚的39.5倍(ABTS法测定)和11.0倍(FRAP法测定)。结果表明,紫色桑葚总酚含量及抗氧化能力明显高于白色。酚酸、类黄酮是水果中酚类物质的主要存在形式,由此可以推测,紫色和白色桑葚中酚酸、类黄酮组成及含量存在明显差异。
2.2 基于代谢组学分析桑葚样品
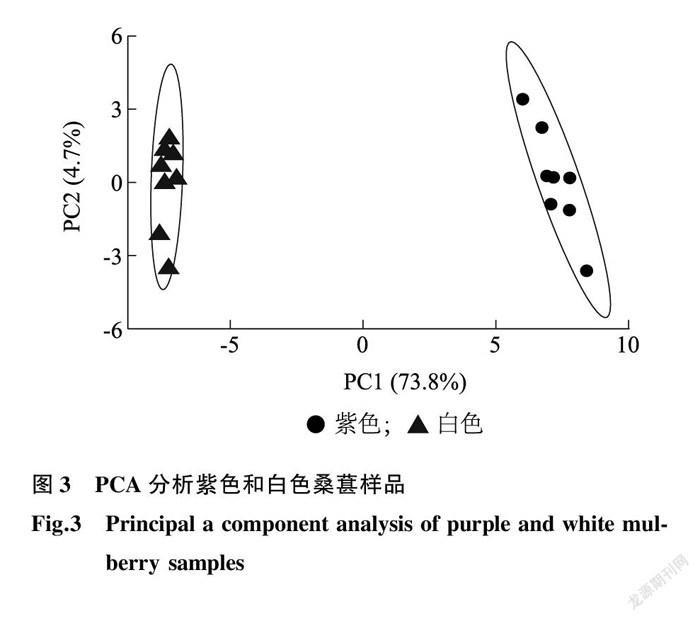
本研究以紫桑葚和白桑葚为材料进行非靶向代谢组学分析,并利用MS-DIAL 软件对质谱数据进行解卷积分析组合,得到不同组合的质谱峰信息,包括保留时间、分子离子峰、同位素质谱峰、二级质谱、峰面积等信息,将不同样品中质谱峰面积进行整合,构成质谱峰峰表。主成分分析(PCA)是一种常用的数据降维方法,它对数据中的原始变量进行线性组合,得到几个正交的成分(即主成分),对原数据的协方差阵进行解释,其属于无监督模式识别,在主成分分析投影图中,相近的样品会聚到一起,不相似样品的空间距离较远,数据分析之前进行归一化处理 [13] 。图3为利用主成分分析法分析2种桑葚代谢组学数据结果,由图3可以看出,第一主成分(PC1)贡献率为73.8%,第二主成分(PC2)贡献率为4.7%,同种颜色桑葚样品分布较为集中,表明每个样品内代谢物含量差异较小。而不同颜色桑葚样品的空间位置有明显不同,表明2组桑葚样品的代谢图谱存在明显差异。
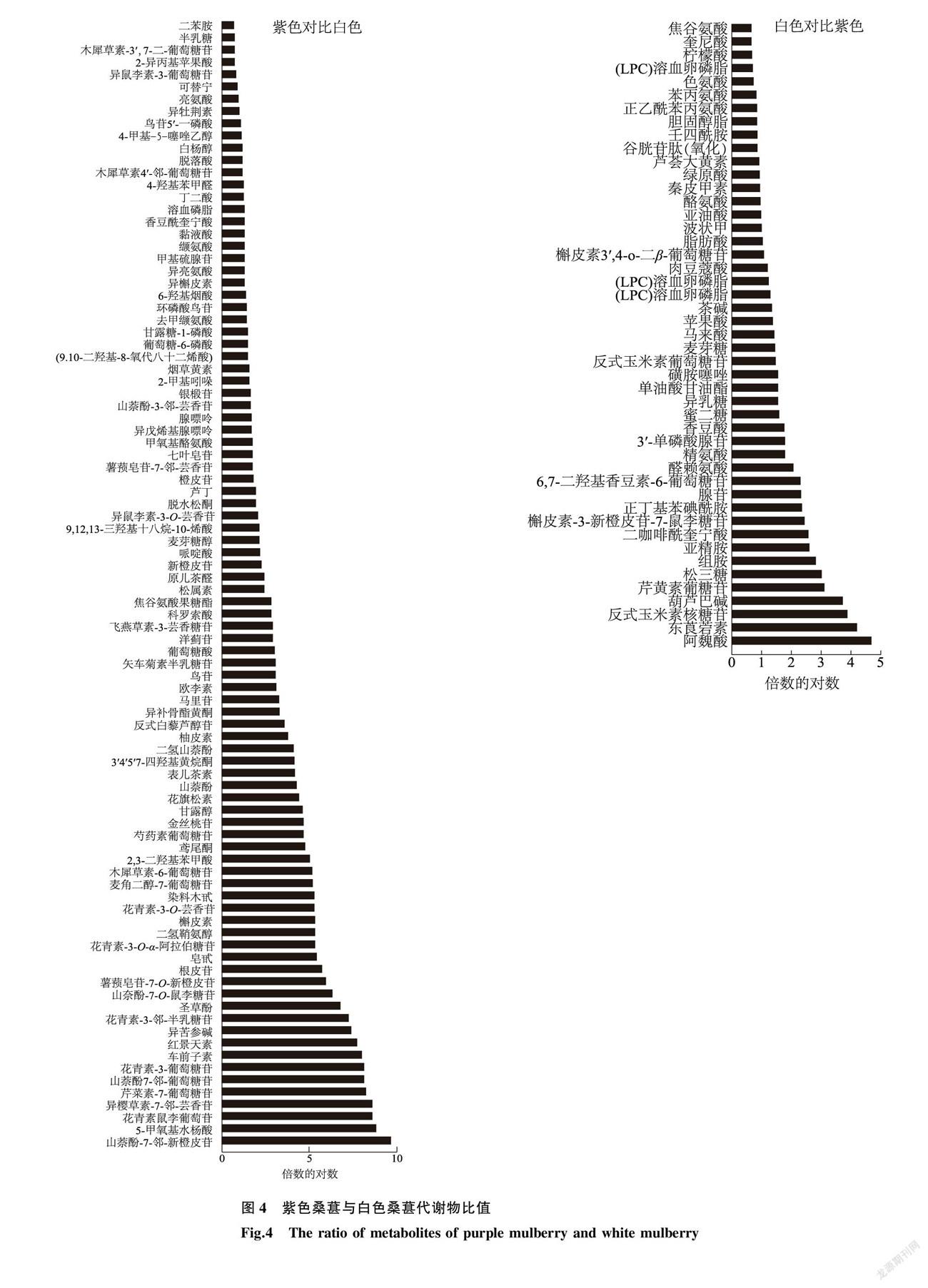
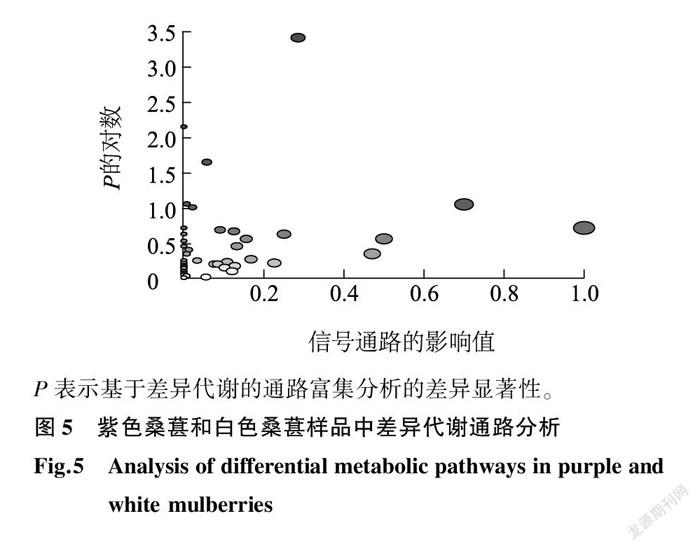
基于 t-test ( P <0.05)和倍数变化( fold-change >1.50或<0.67)进行差异质谱峰筛选,为了避免代谢物鉴定的假阳性问题,进一步对含有二级质谱的一级质谱进行定性,最终共鉴定出136种差异代谢物,包括氨基酸(13种)、有机酸(9种)、酚酸(6种)、类黄酮(48种)、花青素(5种)等。紫色桑葚的代谢物(89种)含量显著高于白色桑葚的代谢物(图4a),主要包括45种类黄酮、5种花色苷、5种氨基酸、6种核苷类、5种有机酸等,超过10倍的有34种,包括山萘酚-7- O -新橙皮苷、5-甲氧基水杨酸、花青素鼠李葡糖苷、异樱草素-7- O -芸香苷、芹菜素-7-葡萄糖苷、山萘酚-7- O -葡萄糖苷、花青素-3-葡萄糖苷、車前子素、红景天素、异苦参碱、花青素-3- O -半乳糖苷、圣草酚、山萘酚-7- O -鼠李糖苷、薯蓣皂苷-7- O -新橙皮苷、根皮苷、皂草甙、花青素-3- O - α -阿拉伯糖苷、二氢鞘氨醇、槲皮素、染料木甙、麦角二醇-7-葡萄糖苷、木犀草素-6- 葡萄糖苷、2,3-二羟基苯甲酸、鸢尾酮、芍药素葡萄糖苷、金丝桃苷、甘露醇、花旗松素、山萘酚、表儿茶素、3′4′5′7-四羟基黄烷酮、二氢山萘酚、柚皮素和反式白藜芦醇苷,其中山萘酚-7- O -新橙皮苷、香蜂草苷、芹菜素-7-葡萄糖苷、山萘酚-7- O -葡萄糖苷差异倍数最大,分别是白色桑葚的739.4倍、359.9倍、283.0倍、264.5倍。白色桑葚代谢物显著高于紫色的有47种,主要包括11种脂类、4种酚酸、4种胺类、8种氨基酸等(图4b),其中白色桑葚样中阿魏酸、反式玉米素核糖苷、葫芦巴碱等物质分别是紫色桑葚的25.0倍、14.4倍、12.9 倍。基于MetaboAnalyst软件对差异代谢物进行代谢通路分析,结果如图5所示,其中紫色桑葚、白色桑葚的代谢通路为类黄酮生物合成、黄酮和黄酮醇生物合成、亚油酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成、异喹啉生物碱生物合成和苯丙氨酸代谢等。
3 讨 论
试验结果表明,紫色桑葚和白色桑葚总酚含量和抗氧化能力存在明显差异,紫色桑葚抗氧化能力明显高于白色桑葚抗氧化能力。谭伟等 [14] 对红色葡萄和白色葡萄的总酚含量及抗氧化能力进行测定,发现红色葡萄果皮和种子中酚类物质含量均高于白色品种。汪荷澄等 [15] 对药桑、鞑靼桑和白桑进行总酚含量测定,发现白桑的总酚含量是最低的,这与我们的研究结果一致。紫色桑葚中的花色苷是影响桑葚颜色的主要因素,而花色苷亦是一种强有力的抗氧化剂 [16-17] 。郭艳等 [18] 的研究结果表明,桑葚抗氧化能力与花色苷含量呈显著的正相关。牛天羽等 [19] 对黑果桑、白果桑、野生蒙桑和栽培蒙桑桑葚中花色苷含量及抗氧化能力进行比较,发现蒙桑桑葚中花色苷含量和抗氧化能力明显高于黑桑和白桑桑葚,而白桑桑葚中花色苷含量和抗氧化能力最低,这与我们的试验结果基本一致。
本研究基于主成分分析对桑葚代谢图谱进行分析,发现2种桑葚代谢图谱存在明显差异。共鉴定到137种差异代谢物,主要包括氨基酸、有机酸、酚酸、类黄酮、花青素等。氨基酸是构成蛋白质的基本单位,在有机体内具有特殊的生理功能,是果蔬的重要营养成分,各种氨基酸含量及组成直接影响其营养价值,并与人类味觉密切相关,且不同种类的氨基酸在植物体内作用不同 [20] 。本研究中共筛选出13种差异氨基酸,其中紫色桑葚比白色桑葚多的氨基酸有5种,白色桑葚比紫色桑葚多的有8种。苯丙氨酸、色氨酸、络氨酸是合成次级代谢物(尤其是类黄酮、花青素、酚酸)的合成前体,与白色桑葚相比,紫色桑葚中这3种氨基酸含量均显著下降,推测其在次级代谢物合成中被大量消耗 [21] 。而亮氨酸、缬氨酸、异亮氨酸对组织蛋白质合成与分解有调节作用 [20,22] ,本研究得到紫色桑葚中这3种氨基酸含量明显高于白色桑葚。精氨酸是植物细胞中储存氮的氨基酸 [23] ,本研究发现白色桑葚精氨酸含量是紫色桑葚的3.4倍。
有机酸不仅被认为是植物碳骨架构建和能量供应所需的代谢资源,而且是影响果实口感和整体品质的主要化合物 [24] 。本研究共筛选出9种差异有机酸,其中紫色桑葚比白色桑葚多的有5种,包括葡萄糖酸、哌啶酸、黏液酸、琥珀酸、2-异丙基苹果酸,白色桑葚比紫色桑葚多的有4种,包括奎尼酸、柠檬酸、苹果酸、马来酸。三羧酸循环是联系三大物质代谢的枢纽 [25] ,柠檬酸和苹果酸为植物三羧酸循环的重要中间产物,它们也是影响水果风味品质的重要因素,而白色桑葚中柠檬酸、苹果酸含量比紫色桑葚多,紫色桑葚中琥珀酸含量比白色桑葚多,说明2种颜色桑葚中三羧酸循环代谢通路存在差异,累积中间产物不一致。黏液酸、细胞壁黏酸与细胞壁代谢有关,且黏液酸对果实软化会产生影响 [26] 。奎尼酸主要是果实有氧呼吸过程形成的代谢产物 [27] ,白色桑葚中奎尼酸含量是紫色桑葚的1.5倍。
糖类和脂类物质在水果的生长发育中起着重要作用。糖类是水果的重要组成部分,是生物体内新陈代谢不可缺少的营养物质和主要热量来源之一 [28] ,也是影响其口感和品质的重要因素。本研究共筛选出9种差异糖类物质,包括5种糖、2种糖醇和2个糖磷酸,其中4种糖在白色桑葚中含量比较高,包括麦芽糖、异乳糖、蜜二糖、松三糖,2种糖醇和2个糖磷酸在紫色桑葚中含量比较高,而测定的这几种糖和糖醇均有甜味,说明白色桑葚和紫色桑葚的甜味风味来源可能不一致 [29] 。脂类物质是一些水果和蔬菜中非常重要的生物活性化合物,本研究共筛选出13种差异脂类物质,其中紫色桑葚比白色桑葚多的有3种,白色桑葚比紫色桑葚多的有10种,说明紫色桑葚和白色桑葚在成熟期脂质代谢存在一定差异 [30] 。
植物产生大量的次生代谢产物,如类黄酮、生物碱、萜类、多酚类、醌类以及许多具有这些基团组合结构的化合物,这些代谢物对植物的生理作用在一定程度上发挥着重要的作用,且对人体有益 [31] 。此外,植物次生代谢物通过提供新的化学物质和化合物,在制药、食品和化妆品行业具有重要的潜在应用前景 [32] 。酚酸广泛存在于植物中 [33-34] ,是植物中的一种酚类物质,大约占植物中酚类物质的1/3,主要包括香豆酸、咖啡酸、阿魏酸、对羟基苯甲酸、香草酸和原儿茶酸等 [35-36] 。酚酸类化合物具有良好的抗氧化、抗动脉粥样硬化、抗炎和抗突变特性,具有良好的保健功效 [37] 。本研究共筛选出6种差异酚酸,紫色桑葚比白色桑葚多的有2种,包括5-甲氧基水杨酸和2,3-二羟基苯甲酸,白色桑葚比紫色桑葚多的有4种,包括阿魏酸、二咖啡酰奎宁酸、香豆酸和绿原酸,其中白色桑葚中阿魏酸含量是紫色的25倍。阿魏酸是一种常见于西红柿、甜玉米等水果和蔬菜中的植物化学物质,它来源于植物中苯丙氨酸和酪氨酸通过莽草酸途径的代谢 [38] 。阿魏酸能够激发果蔬自身抗性及延缓果蔬后熟作用 [39] ,它对癌症、糖尿病、心血管疾病和神經性疾病具有广泛的治疗作用。臧盛 [40] 以15种籽粒颜色不同的糜子壳粉为试验材料,发现白色糜子壳粉中香豆酸、阿魏酸含量明显高于紫色糜子壳粉,这与本研究结果一致。绿原酸(CGA)是中草药和水果中含量丰富的酚类化合物之一,具有天然抗氧化剂和自由基清除剂的特性。一般认为,与浅色果实相比,深色果实的绿原酸含量较高 [41] 。然而在本研究中,白色桑葚中绿原酸显著高于紫色( P < 0.05)。
类黄酮和花青素作为重要的次生代谢产物广泛分布于药用和食用植物中,为果蔬的气味和颜色的重要组成部分,是影响其口感和品质的重要因素,且对人体具有抗氧化、抗炎症、预防慢性非传染性疾病等功能 [42] 。本研究中共筛选出48种差异类黄酮,其中大部分黄酮类物质(45个)在紫色桑葚中含量较高,其中山萘酚-7- O -新橙皮苷、香蜂草苷、芹菜素-7-葡萄糖苷、山萘酚-7- O -葡萄糖苷等黄酮类化合物分别是白色桑葚的739.4倍、360.0倍、283.0倍和264.5倍。而白色桑葚比紫色桑葚含量高的类黄酮仅有3种,分别为槲皮素-3,4′- O -二 β -葡萄糖苷、槲皮素-3-新橙皮苷-7-鼠李糖苷、芹黄素葡糖苷,且它们在2种颜色桑葚中含量比值均小于10倍。另外,本研究中共筛选出5种差异花青素,它们均在紫色桑葚中含量较高,其中紫色桑葚中花青素鼠李葡萄苷、花青素-3-葡萄糖苷、矢车菊素半乳糖苷含量是白色桑葚中的362倍、255倍、139倍。由此可见,紫色桑葚中大部分类黄酮和花青素含量均高于白色桑葚。此外,类黄酮与花色苷的合成与积累和桑葚果实着色有关,紫色桑葚样品中类黄酮、花青素物质含量多,进一步导致紫色桑葚中的总酚和抗氧化能力比白色桑葚高。张琼予 [43] 以不同颜色桑葚为研究对象,检测桑葚中花色素苷的种类和含量,结果表明,黑果桑葚中花色素苷含量显著高于白果桑葚,这与本研究结果一致。苯丙烷素生物合成途径是产生酚酸和类黄酮的重要途径,紫色桑葚中酚酸类物质含量少、类黄酮物质含量多,因此推测相比于白色桑葚,紫色桑葚的苯丙烷素生物合成途径中类黄酮合成被促进,酚酸合成被抑制,而白色桑葚刚好相反。
参考文献:
[1] 梁世格. 马桑果急性中毒治疗体会[J]. 右江医学, 2000(3): 208-209.
[2] 潘春华. 立夏时节话桑葚[J]. 现代养生, 2018(5):9.
[3] 施青红,王向阳. 桑椹的功能成分及药理作用[J]. 食品与机械, 2007, 23(4): 153.
[4] 王 湛. 桑葚花色苷的提取及其抗乳腺癌作用研究[D]. 重庆:第三军医大学, 2011.
[5] CRECELIUS A C, HLSCHER D, HOFFMANN T, et al. Spatial and temporal localization of flavonoid metabolites in strawberry fruit ( Fragaria×ananassa ) [J]. Journal of Agricultural and Food Chemistry, 2017, 65(17): 3559-3568.
[6] HOLMES E, NICHOLSON J K, NICHOLLS A W, et al. The identification of novel biomarkers of renal toxicity using automatic data reduction techniques and PCA of proton NMR spectra of urine[J]. Chemometrics and Intelligent Laboratory Systems, 1998, 44(1/2):245-255.
[7] 徐 旻,林东海,刘昌孝. 代谢组学研究现状与展望[J]. 医学学报, 2005, 40(9): 769-774.
[8] WISHART D S. Metabolomics: applications to food science and nutrition research[J]. Trends in Food Science & Technology, 2008, 19(9): 482-493.
[9] TEBANI A, BEKRI S. Paving the way to precision nutrition through metabolomics[J]. Frontiers in Nutrition, 2019, 6: 41.
[10] ROESSNER U, WAGNER C, KOKKA J, et al. Simultaneous analysis of metabolites in potato tuber by gas chromatography-mass spectrometry[J]. The Plant Journal, 2000, 23(1): 131-142.
[11] 方贤胜,吴 涛,肖良俊. 基于广泛靶向代谢组学的浅黄色和紫色核桃内种皮成分差异分析[J].食品科学,2021,42(12):215-221.
[12] 赵 君,徐剑文,刘剑光,等. 观赏向日葵不同花色物质组成的代谢组学分析[J/OL]. 南京农业大学学报,2021,44(3):437-446.
[13] 李富恒,张晓雯,张永芳,等.不同发育阶段老山芹种子多组学联合分析[J].东北农业大学学报,2021,52(10):32-46.
[14] 谭 伟,唐晓萍,董志刚,等. 不同果皮颜色酿酒葡萄品种果实不同部位酚类物质含量比较及抗氧化能力分析[J]. 中国农学通报, 2015, 31(28): 252-258.
[15] 汪荷澄,蒲云峰,侯旭杰.新疆不同桑葚品种营养品质分析[J].农产品加工,2021(4):54-56.
[16] WANG M, LI J, RANGARAJAN M,et al. Antioxidative phenolic compounds from sage( Salvia officinalis )[J]. Journal of Agricultural and Food Chemistry,1998, 46: 4869-4873.
[17] BENZIE I F F, SZETO Y T. Total antioxidant capacity of teas by the ferric reducing antioxidant power assay[J]. Journal of Agricul-tural and Food Chemistry,1999,47: 633-636.
[18] 郭 艳,周小魏,吕佳欣,等. 不同大樱桃品种营养成分分析及体外抗氧化作用研究[J].中国果树,2021(9):55-58.
[19] 牛天羽,劉洪章,刘树英. 4种桑葚花色苷的超声提取及其抗氧化能力比较[J]. 西北农林科技大学学报(自然科学版), 2016, 44(3): 188-195,202.
[20] 张伟敏,魏 静,施瑞诚, 等. 诺丽果与热带水果中氨基酸含量及组成对比分析[J]. 氨基酸和生物资源, 2008(3): 37-41,45.
[21] 段书延. 钙胁迫与根域限制对葡萄生长发育和代谢产物的影响[D]. 上海:上海交通大学, 2019.
[22] 王 彬,蔡永强,郑 伟. 火龙果果实氨基酸含量及组成分析[J]. 中国农学通报, 2009, 25(8): 210-214.
[23] 高华君,杨洪强,杜方岭,等. 平邑甜茶幼苗生长过程中精氨酸和一氧化氮水平的变化[J]. 植物营养与肥料学报, 2008, 14(4):774-778.
[24] BAE H , YUN S K , JUN J H , et al. Assessment of organic acid and sugar composition in apricot, plumcot, plum, and peach during fruit development[J]. Journal of Applied Botany and Food Quality, 2014, 87(2):24-29.
[25] 邱宝莹,燕丽婷,宋卫华,等. 三羧酸循环医学理论教学改革的探讨与实践[J]. 特别健康(下), 2014(7):527-528.
[26] 刘世尧. 不同产区皱皮木瓜有机酸组成及主要活性成分分离纯化研究[D]. 重庆:西南大学, 2012.
[27] STEFANO B, MAARTEN H, ROBERTA T, et al. Metabolic responses to low temperature of three peach fruit cultivars differently sensitive to cold storage.[J]. Frontiers in Plant Science,2018,9:706.
[28] 张文婷,陆秋艳. 亚热带水果中糖组分的测定及分析[J]. 营养学报, 2019, 41(3):308-312.
[29] 刘建军,赵祥颖,田延军,等. 低热值甜味剂赤藓糖醇的研究现状及应用[J]. 中国酿造, 2006(12):1-3,16.
[30] SHASHIREKHA M N, MALLIKARJUNA S E, RAJARATHNAM S. Status of bioactive compounds in foods, with focus on fruits and vegetables.[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(10): 1324-1339.
[31] YAZAKI K. ABC transporters involved in the transport of plant secondary metabolites[J]. FEBS Letters, 2006, 580(4) : 1183-1191.
[32] MISHRA S, SAHU P K, AGARWAL V, et al. Exploiting endophytic microbes as micro-factories for plant secondary metabolite production[J]. Applied Microbiology and Biotechnology, 2021, 105(18) : 6579-6596.
[33]KHADEM S, MARLES R J. Monocyclic phenolic acids;Hydroxy-and polyhydroxybenzoic acids:occurrence and recent bioactivity studies[J]. Molecules, 2010, 15(11):7985-8005.
[34] 乔丽萍,傅 瑜,叶兴乾,等. 酚酸生物活性研究进展[J]. 中国食品学报, 2013, 13(10): 144-152.
[35] 郝 杰,张长虹,曹学丽. 七种谷物麸皮中的酚酸类成分分析[J]. 食品科学, 2010, 31(10): 263-267.
[36] KIM K H, TSAO R, YANG R, et al. Phenolic acid profiles and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions[J]. Food Chemistry, 2005, 95(3): 466-473.
[37] 徐 旻,林东海,刘昌孝. 代谢组学研究现状与展望[J]. 医学学报, 2005, 40(9): 769-774.
[38] SRINIVASAN M, SUDHEER A R, MENON V P. Ferulic acid: therapeutic potential through its antioxidant property[J]. Journal of Clinical Biochemistry & Nutrition, 2007, 40(2):92-100.
[39] 高兆銀,胡美姣,李 敏,等. 植物萃取物对芒果的保鲜效果[J]. 浙江农业科学, 2011(1):96-97.
[40] 臧 盛. 糜子壳多酚类物质抗氧化活性研究[D]. 杨凌:西北农林科技大学, 2010.
[41] LIM D W, HAN T, JUNG J, et al. Chlorogenic acid from hawthorn berry (Crataegus pinnatifida fruit) prevents stress hormone-induced depressive behavior, through monoamine oxidase b-reactive oxygen species signaling in hippocampal astrocytes of mice.[J]. Molecular Nutrition & Food Research, 2018, 62(15): e1800029.
[42] 张学明,齐晓光,陈玉波,等. 草莓类黄酮化合物的研究进展[J]. 北方园艺, 2020(1): 128-133.
[43] 张琼予. 桑椹花色素苷生物合成关键酶基因的克隆及表达差异分析[D]. 重庆:西南大学. 2012.
(责任编辑:陈海霞)
收稿日期:2021-09-16
基金项目:江苏省农业科技自主创新基金项目[CX(19)3006]
作者简介:刘晴晴(1997-),女,安徽阜阳人,硕士研究生,研究方向为畜牧食源性植物代谢组学分析。(E-mail)2862406513@qq.com
通讯作者:李 勇,(E-mail)liyong_213@163.com;武国华,(E-mail)ghwu@just.edu.cn
