不同浓度K+处理下枸杞K+通道相关基因表达水平分析
2022-07-15张得芳
于 倩,张得芳
(青海大学 a.农林科学院;b.青海省高原林木遗传育种重点实验室,青海 西宁 810016)
钾是植物生长发育必不可少的三大营养元素之一,在调节酶活性、膜电位、细胞内稳态和确保蛋白质稳定合成的过程中发挥着重要作用[1],当植物缺钾时生长速率会下降[2]。研究发现,钾离子是通过主动或者被动的方式从土壤运输到植物细胞中的,植物借助多种钾离子通道和转运蛋白使外源钾离子通过质膜进行转运。植物中存在低亲和性和高亲和性两种钾吸收系统[3]。低亲和性钾吸收系统主要由钾通道蛋白发挥作用,而后者主要通过钾离子转运蛋白[4]。根据α亚基构型的差异将钾离子通道蛋白划分为3 个家族:Shaker通道、TPK/KCO 通道和Kir-like 通道家族[5]。根据钾离子转运蛋白和通道蛋白结构和功能的不同分为3个转运蛋白家族,即KUP/HAK/KT 家族、HKT 家族和CPA 家族[6]。钾离子通道基因通过在植物中高度表达,使钾离子浓度升高、钠离子浓度降低[7],或将钠钾离子重新区域化[8],从而调节植物体内的Na+/K+平衡,以发挥植物耐盐的作用[9]。Voelker[10]、Czemplnski[11]、Becker[12]等通过对拟南芥中KCO/TPK基因的研究,确定其在叶、花、幼苗和根系中均有表达,对维持植株体内钾离子稳态、介导钾离子运输都有重要作用;在大豆中KCO基因的功能具有相似性,发挥维持钾离子动态平衡的作用[13];蔡元保等[14]、Wang 等[15]研究橡胶树、胡杨等植物中的TPK/KCO通道基因,证实其具有维持钾离子水平、影响离子转运的功能[16]。Zhang 等[17]、Wang 等[18]、司伟娜等[19]、吴胜男等[20]、Wang 等[21]在拟南芥、烟草、辣椒、番茄、大豆、小麦、桃、梨等植物中进行KUP/HAK/KT基因家族的研究结果表明,基因定位在根、茎、叶等器官中,不同植物之间存在差异,且在受到外界盐胁迫环境影响下,呈现不同模式的表达,控制钾离子转运吸收,使植物内离子环境保持稳定。
宁夏枸杞Lycium barbarum,茄科枸杞属灌木,在我国以宁夏、青海、天津地区栽培较多[22]。宁夏枸杞有很高的药用价值,早在《神农本草经》《本草纲目》《中国药典》《药性本草》等[23]古籍中均有记载,是中国特有的药食同源类中药材[24],果实中含多糖类、黄酮类、甜菜碱、维生素等有益化合物,具有滋阴补肾、益精明目、抗氧化[25]、抗衰老、抗疲劳、保护视力[26]等功效,在食品和医疗等行业应用广泛[27];其叶具有显著的降血糖[28]、提高记忆力[9]等作用,不仅可入药,还可用作茶叶或食用。此外枸杞耐盐碱、沙荒和干旱[30],常生于土层深厚的沟岸、山坡、田埂和宅旁,与黑果枸杞相比,种植条件更易调控设置,且已作为高收益、高效益经济树种在青海地区推广种植。低盐浓度下枸杞的光合作用[31]、渗透调节[32]等生长过程不会受到太大影响,叶片含水量相对增加,一定浓度的NaCl 胁迫能使叶片变厚、茎枝变粗、组织肉质化,还能够维持体内离子平衡[33]。因此,枸杞常被用于水土保持和造林绿化,具有较高的生态价值。
选取生长状况良好的宁夏枸杞栽培品种‘青杞1 号’组培幼苗为试验材料,设置不同浓度KCl胁迫处理,分析各处理下宁夏枸杞中钾离子通道基因的表达模式,研究相关基因(KCO1B、TPK1、KT1、Cluster-17443.15033、Cluster-17443.69422和Cluster-17443.10870基因)的表达特征,为今后研究枸杞应对盐胁迫的调节机制提供数据支持。
1 材料与方法
1.1 供试材料与设计
选用青海枸杞良种‘青杞1 号’组培幼苗作为试验材料,其中,‘青杞1 号’是通过辐射育种从宁夏枸杞中选育出的枸杞良种。先将组培苗根部洗净用清水培养7 d,再分别用0、100、150、200、250、300、350 mmol/L KCl 溶液处理7 d,使其适应该浓度下盐胁迫环境,待幼苗有明显形态变化后采集幼苗根部进行后续试验。
1.2 RNA 提取和反转录
采用天根RNA prep pure 多糖多酚植物总RNA 提取试剂盒(天根生化,北京)对试验材料进行RNA 提取。利用1%的琼脂糖凝胶电泳对提取的RNA 进行检测,确定RNA 的完整性。使用Fast King cDNA 第一链合成试剂盒(天根生化,北京)对提取、检测后的RNA 进行反转录,反应条件为:42℃下15 min、95℃下3 min。
1.3 引物的获得和筛选
利用课题组前期建立的枸杞转录组数据中GO注释的结果,筛选出与钾离子吸收和转运有关的基因。根据转录组数据序列,利用Primer3 Input进行PCR 引物设计(表1),引物由金唯智生物工程有限公司合成。
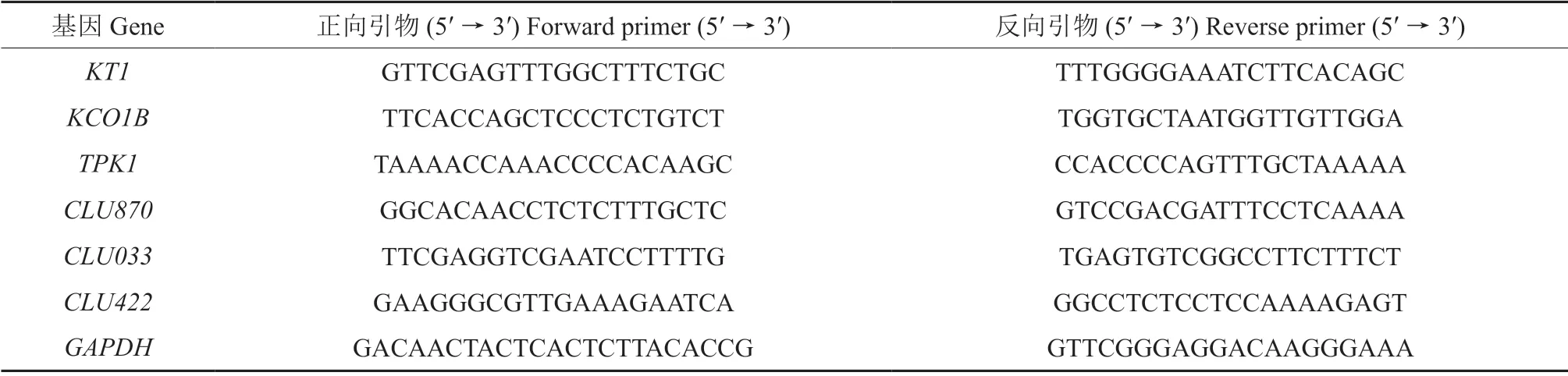
表1 引物序列信息表Table 1 Primer sequence information
使用BIO-RAD S1000 Thermal Cycler PCR 仪(伯乐生命医学产品有限公司,上海)进行PCR扩增,验证枸杞中KCO1B、TPK1、KT1、Cluster-17443.15033、Cluster-17443.69422和Cluster-17443.10870基因的引物特异性。反应体系均为20 μL,并利用1%琼脂糖凝胶电泳检测扩增结果。
1.4 荧光定量PCR
使用SuperReal 彩色荧光定量预混试剂(SYBR Green)(天根生化,北京),加入引物和模板,反应在BIO-RAD CFX Connect real-time system 实时荧光定量PCR 仪(伯乐生命医学产品有限公司,上海)中进行。反应体系为:2×SuperReal Color PreMix 10 μL、正向引物0.6 mL、反向引物0.6 μL、cDNA 模板2 μL、RNase-Free ddH2O 6.8 μL。采用三步法进行Real time PCR 反应,先在95℃下进行酶的活性化反应3 min,再进行PCR反应,95℃下30 s、60℃下30 s、72℃下1 min,整体循环35 次,最后在程序中设定“Melt Curve 65℃ to 95℃,increment 0.5℃ for 0.05 s+Plate Read”形成熔解曲线。采用Excel 2010 和SPSS 23.0 软件对数据结果进行处理和分析。
2 结果与分析
2.1 枸杞幼苗K+处理后表型变化
经过不同浓度的KCl 处理7 d 后,‘青杞1号’组培幼苗产生不同程度的形态变化。对照组0 mmol/L 处理后,幼苗的长势良好,叶片舒展,植株无倒伏;100~300 mmol/L 浓度KCl 处理后,植株长势仍无明显不良状况;而在350 mmol/L处理组处理后,幼苗植株出现明显倒伏,叶片有明显变薄、发黄、蜷缩以及掉落等情况(图1)。

图1 0 和350 mmol/L K+处理7 d 后幼苗形态Fig.1 Seedling morphology after 7 days of treatment with 0 mmol/L and 350 mmol/L K+
2.2 基因与引物筛选结果
从GO 注释结果中挑选出123 个与钾离子吸收或转运有关的基因,其中有15 个基因注释结果为具有钾离子通道的功能,利用NCBI 进行BLAST同源性比较,进一步筛选出9 对具有钾离子通道功能的基因,其中有2 对基因与从GO 注释中筛选出的有钾离子通道功能的基因重合,还有2 对基因的来源种类不属于植物。再针对筛选出的基因设计引物并进行引物的特异性验证,筛选出可用于下一步试验的基因:TPK1、KT1、KCO1B、Cluster-17443.10870、Cluster-17443.15033和Cluster-17443.69422基因。利用1%的琼脂糖凝胶电泳检测PCR 扩增产物,结果见图2,筛选出的基因均能扩增得到单一、明亮条带,引物特异性良好。

图2 PCR 扩增结果Fig.2 PCR amplification
2.3 不同K+浓度下不同基因在‘青杞1 号’中的相对表达量和趋势分析
KCO1B、TPK1、KT1、Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033基因的相对表达量变化如图3所示。

图3 不同K+浓度下基因的相对表达量Fig.3 Relative expression of genes under different concentrations of K+
在‘青杞1 号’中,150 和200 mmol/L K+处理浓度组中KCO1B基因的表达量高于对照组,分别为2.13 倍和2.10 倍,100、250、300、350 mmol/L浓度K+处理下KCO1B基因的表达量都要低于对照组,分别为0.98 倍、0.66 倍、0.14 倍和0.72 倍,P<0.05。随着K+处理浓度的增加,KCO1B基因在‘青杞1 号’中的表达量总体呈先上升后下降再上升的趋势,在150 mmol/L 时基因的相对表达量达到最高,随后在250 mmol/L 处理下表达量迅速降低,300 mmol/L 浓度时降至最低。
TPK1基因在100 mmol/L K+处理下其表达量是对照组的1.10 倍,在150、200、250、300 和350 mmol/L K+处理下,分别是对照组的7.21 倍、6.70 倍、4.05 倍、6.32 倍和22.94 倍,P<0.05。随着K+处理浓度的增加,TPK1基因在‘青杞1 号’中的表达量总体呈先上升后下降再上升的趋势,在升到150 mmol/L 时基因表达量开始下降,升到300 mmol/L 之后迅速升高。
KT1基因在100、250 和300 mmol/L K+处理组KT1基因的表达量低于对照组,分别为0.71 倍、0.59 倍 和0.27 倍,150、200 和350 mmol/L K+处理下KT1基因的表达量为对照组的1.24 倍、1.86倍和1.21 倍,P<0.05。随着K+处理浓度的增加,KT1基因表达量总体呈先上升后下降再上升的趋势,在200 mmol/L 时表达量升至最高,然后开始降低,300 mmol/L 浓度处理时基因表达量降到最低。
Cluster-17443.10870基因在150、200 和350 mmol/L K+处理条件下,基因的表达量高于对照组,分别是对照组的1.37 倍、1.67 倍和2.68 倍,在100、250 和300 mmol/L 的K+处理下基因表达量为对照组的0.10 倍、0.85 倍和0.20 倍,P<0.05。随着K+处理浓度的增加,Cluster-17443.10870基因的表达量总体呈先上升后下降再上升的趋势,在100 mmol/L 时表达量最低,升至200 mmol/L 后基因的表达量又逐渐下降。
Cluster-17443.69422基因的表达量在100、150、200、250 和350 mmol/L K+条件处理下高于对照组,分别为对照组的2.24 倍、4.82 倍、6.35倍、1.40 倍和4.66 倍,而在300 mmol/L K+浓度处理下其表达量为对照组的0.66 倍,P<0.05。随着K+处理浓度的增加,Cluster-17443.69422基因表达量总体呈先上升后下降再上升的趋势,在200 mmol/L 浓度处理下表达量最高,300 mmol/L浓度处理下的基因表达量最低。
Cluster-17443.15033基因在100、150、200、250 和350 mmol/L K+处理下,其表达量为对照组的1.03 倍、3.05 倍、3.81 倍、4.06 倍 和5.89 倍,而在300 mmol/L 浓度条件下,表达量与对照组基本一致,P<0.05。随着K+处理浓度的增加,Cluster-17443.15033基因表达量总体呈先上升后下降再上升的趋势,在250 mmol/L 浓度时基因的表达量开始下降,300 mmol/L 浓度时基因的表达量最低。
3 结论与讨论
3.1 结 论
随着K+处理浓度的增加,‘青杞1 号’中的KCO1B、TPK1、KT1、Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033基因总体都为先上升后下降再上升的趋势。其中,Cluster-17443.10870基因在K+处理浓度变化至100 mmol/L 时有一定程度的下降;KCO1B基因在150 mmol/L 时表达量达到最大;KT1基因和Cluster-17443.69422基因在200 mmol/L 时表达量达到最大;TPK1基因、Cluster-17443.10870基因和Cluster-17443.15033基因在350 mmol/L 时表达量才达到最大。
在宁夏枸杞中,350 mmol/L K+处理条件下各组基因的表达量都出现突然上升状态,预测此时K+通道活性已达到过饱和状态;在100 mmol/L K+处理时,有多数基因的表达量低于对照组,预测此浓度下钾通道功能受抑制。其他浓度下各组基因的表达量都在中间处理浓度(150、200 和250 mmol/L)时达到最大值,其中200 mmol/L K+处理时有3 组基因达到最大值,150 mmol/L 处理时有2 组,250 mmol/L 处理时有1 组;而在最低(100 mmol/L)或最高(300 mmol/L)浓度处理时基因的表达量达到最小值,其中100 mmol/L K+处理时有2 组,300 mmol/L K+处理时有4 组。随着K+处理浓度的增加,相关基因的表达量总体呈现出先升后降再升或先升后降的变化趋势。
3.2 讨 论
钾是植物生长所必需的营养元素之一,对植物的生长发育、缓解盐等方面有着重要作用[34-35]。在植物中,KCO、TPK、KT等离子通道基因主要起到维持植物内离子平衡、控制钾离子转运吸收等功能,一般在100 mmol/L K+环境下基因表达量维持稳定[36],在300 mmol/L 时钾离子通道表达量饱和,其转运速率可达500 mmol/L[37]。数据显示,宁夏枸杞在150~200 mmol/L 浓度的KCl 处理下表达量最高,在超过300 mmol/L 的胁迫处理下仍可吸收外界钾离子,与其他植物略有差异。
对黑果枸杞在不同浓度K+胁迫处理下钾离子通道基因表达模式分析进行对比后发现[38],KCO1B基因在宁夏枸杞中与黑果枸杞中的表达模式相同,均为先上升后下降再上升的趋势,但与黑果枸杞相比,在0、100、150、200 和250 mmol/L浓度K+条件下,KCO1B基因在宁夏枸杞中的表达量都更高,在300 mmol/L 浓度的K+条件下,基因在宁夏枸杞中的表达量低于黑果枸杞。随着K+处理浓度的增加,TPK1基因在宁夏枸杞中的表达量均为上调表达,总体呈上升趋势。但在黑果枸杞中,TPK1基因的表达量呈先下降后上升再下降的趋势,除300 mmol/L 处理外,宁夏枸杞中TPK1基因表达量均高于黑果枸杞,且在0、200 和250 mmol/L 浓度的K+条件下,基因在宁夏枸杞与黑果枸杞中的表达量无显著差异。KT1基因在宁夏枸杞中的表达量随K+浓度的增加总体呈现出先上升后下降再上升的趋势,处理浓度下降到300 mmol/L 后基因表达量又上升,预测此时因浓度过高基因不表达。黑果枸杞中,表达趋势为先下降后上升再下降,且表达量峰值时二者处理浓度不同。在100、150、200 和350 mmol/L K+处理下,宁夏枸杞的KT1基因表达量均高于黑果枸杞,在0 和150 mmol/L 浓度K+处理条件下,基因在宁夏枸杞与黑果枸杞中的表达量无显著差异。Cluster-17443.10870基因在宁夏枸杞中的表达量随着K+处理浓度的增加总体呈现出先上升后下降再上升的趋势。在黑果枸杞中基因的表达量呈现先下降后上升再下降的趋势,表达量均在100 mmol/L时最低。Cluster-17443.69422基因在宁夏枸杞中的表达量总体呈现先上升后下降再上升的趋势,200 mmol/L 时达到最大后逐渐下降,说明其通道活性已达到饱和。黑果枸杞中,表达量趋势变化相同且均为上调表达,但除300 mmol/L 浓度外,其表达量均低于宁夏枸杞。Cluster-17443.15033基因在宁夏枸杞中随着K+处理浓度的增加,其表达量总体呈先上升后下降再上升的趋势,均为上调表达,在250 mmol/L 浓度处理时基因表达量最高。在黑果枸杞中,Cluster-17443.15033基因表达量趋势变化也为先上升后下降再上升,在150 mmol/L浓度处理时达到峰值。Cluster-17443.15033基因在宁夏枸杞中的表达量普遍大于黑果枸杞。
植物对钾离子的吸收转运是一个较为复杂的过程,受多种因素的影响,在不同植物中也有不同的表达方式[39]。KCO1基因属于两孔钾离子通道家族,是钾离子外排通道基因,在对拟南芥、烟草、大麦等植物的研究中发现其与植物耐盐性有关,过量表达能增强植物的耐盐性[40]。陈丹丹[41]对桑树进行低钾处理后发现,桑苗在低钾胁迫下的变化趋势为先上升后下降,波动变化幅度不大,与其在宁夏枸杞中的表达模式相似。董禄禄[42]和李宁宁[43]对长叶红砂进行不同浓度的KCl 处理以及转RtKCO1酵母和转RtKCO1拟南芥对KCl 响应的研究表明,该基因在不同浓度处理下表达量呈现先下降后上升再下降的趋势,与宁夏枸杞和黑果枸杞均不相同,且过表达RtKCO1基因能够提高拟南芥对低钾的耐受性。TPK1基因定位在液泡膜上,受钙离子激活,是选择性钾离子通道基因[44]。烟草NtTPK1和NtTPK2基因在根、茎、叶、花中均有表达,且在外界盐胁迫下会表达量增加[45],许力等[46]等对烟草品种K326 中的钾离子通道基因NtTPK进行研究后发现,NtTPK基因在烟草茎中的表达量最高,低钾会抑制基因表达,与对照相比,NtTPK基因的相对表达量随低钾处理时间延长呈下降趋势,在处理24 h 时达到最低。王树芳[47]以‘甜査理’草莓为试验材料,对钾离子通道FaTPK1基因在草莓果实发育及品质形成中的功能进行研究发现,草莓TPK1基因在液泡膜中普遍表达,并在调控果实成熟和品质形成中起着重要作用,低钾有利于钾离子的吸收。王菲菲[48]研究证实,胡杨TPK1基因也定位在液泡膜上,且在盐胁迫下根尖部分的钾离子外流不明显,细胞质中的钾离子浓度基本稳定,但细胞壁和液泡中的钾离子浓度有所下降。KT/HAK/KUP家族基因是植物中成员数量最多的高亲和钾离子转运家族,能从极低水平的钾素环境中富集钾离子[49]。宋毓峰等[50]利用生物信息学方法对两种烟草中KUP/HAK/KT 转运体家族研究发现,林烟草和绒毛状烟草中均含有19 个基因家族成员且定位于细胞质膜上,在低钾胁迫下为上调表达;宋志忠等[51]对不同发育时期桃花的KT/HAK/KUP家族基因表达模式进行研究发现,KUP1和KUP5基因的表达水平从花蕾期至盛开期被持续诱导[52],KUP11在桃花开放全过程中表达量最高并抑制败落期的表达量,且KUP11基因的表达水平与钾离子吸收呈正相关。晁毛妮等[53]对大豆KT/HAK/KUP家族基因的研究表明其定位于细胞质膜上,参与植物根部、花和种子对钾离子的吸收过程。许赛赛等[54]对马铃薯的HAK/KUP/KT基因家族进行逆境胁迫下的表达模式研究结果与大豆相同,在质膜上表达发生低钾胁迫时,StHAK基因的表达量普遍发生变化,其中StHAK11、StHAK13和StHAK14为明显上调表达。研究筛选的KCO1B、TPK1、KT1、Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033这6 个基因,在宁夏枸杞中均为先上升后下降再上升。在黑果枸杞中[38],KT1基因和Cluster-17443.10870基因的表达量变化与之相反,呈先下降后上升再下降的趋势,其他基因在两种枸杞间表达趋势类似,相对表达量普遍为在宁夏枸杞中更高。根据宁夏枸杞转录组GO 注释库描述发现的Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033基因均与K+的吸收和转运有关,但其具体功能还未知,需要后期试验进一步深入研究。
综合这些基因在不同植物中的表达分析,草本植物中钾离子通道相关基因的表达往往一开始会受到抑制,表达量呈下降趋势,浓度升高后表达量开始上升;枸杞中基因相对表达量的变化趋势在一定浓度范围内与大部分木本植物相同,随着K+浓度升高而上调表达,但在较高浓度处理下枸杞中钾离子通道相关基因的表达量开始下降,而处理浓度达到极值后再大幅上升。在不同浓度KCl 处理下表达量呈先升高后降低再升高的波动变化,钾离子调控更加稳定,在不同程度的盐胁迫下,枸杞的钾离子吸收转运可维持植株内离子环境的动态平衡,能够更好地发挥耐盐碱作用。
本研究对宁夏枸杞中部分钾离子通道基因进行表达模式特征分析,研究基于宁夏枸杞转录组GO 注释筛选出的KCO1B、TPK1、KT1、Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033这6 个钾离子通道相关基因在不同浓度盐胁迫下的表达量变化,确定了KCO1B、TPK1、KT1基因在宁夏枸杞中的表达模式,也为后续对尚未确定类别的3 个基因(Cluster-17443.10870、Cluster-17443.69422和Cluster-17443.15033)的研究做了理论基础。本试验研究成果可为后续研究枸杞中钾离子通道相关基因的调控机制,以及在不同枸杞中的表达差异提供理论数据,也为盐胁迫下枸杞钾离子吸收转运的相关研究提供参考。
