猕猴桃AcNPR1 基因克隆及抗病响应表达分析
2022-07-15东燕飞刘欣瑞彭雪张羽秦公伟
曲 东燕 飞刘欣瑞彭 雪张 羽秦公伟
(1.陕西理工大学 生物科学与工程学院,陕西汉中 723000;2.陕西理工大学 陕西省资源生物重点实验室,果树资源保护与开发研究所,陕西汉中 723001)
猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl.)木质藤本果树,其果实富含膳食纤维、维生素C 等益于人体健康的功能营养成分,且经济价值较高,具有良好的市场发展前景[1]。目前,我国猕猴桃的栽培种植面积和产量越居世界第一。然而由丁香假单胞菌猕猴桃致病变种(Pseudomonas syringaepv.actinidiae,Psa)引起的猕猴桃溃疡病正严重影响着中国及世界各国猕猴桃产业的发展[2],该病害传播速度快、传播途径多样、防治难度极大,病原菌主要通过危害猕猴桃树干、枝条、叶片及花的生长发育,导致猕猴桃果实大量减产甚至毁园,因此激活植物的固有防御系统提高猕猴桃抗病能力或选育猕猴桃抗病品种是降低猕猴桃溃疡病危害的有效办法。目前有关猕猴桃抗病机理的研究报道较少,因此挖掘猕猴桃抗病相关的关键基因,对于了解猕猴桃的抗病机制具有重要作用,对于猕猴桃抗病育种的工作具有一定的现实意义。
病程相关基因非表达子1(Nonexpressor of Pathogenesis-Related genes,NPR1)隶属于NPR1基因家族[3],是水杨酸(Salicylic acid,SA)介导的植物系统获得性抗性(Systemic acquired resistance,SAR)以及茉莉酸(Jasmonic jcid,JA)和乙烯(Ethylene,ET)介导的植物诱导获得抗性(Induced systemic resistance,ISR)的一个主要调控因子,是植物多种抗病性信号传导途径的交叉点[4]。当植物受到病原菌侵染时,NPR1 特异性结构域能够与WRKY 等转录因子结合激活植物免疫系统,作用于相关抗病基因,使基因表达水平上调,从而增强植物抗病能力[5]。NPR1基因包含一个N-末端BTB/POZ结构域、一个中心锚蛋白重复结构域ANKs(Ankyrin repeats)和一个C-末端反式激活结构域,其中BTB-POZ 结构域参与NPR1蛋白的同源二聚的形成[4,6-7],而ANKs与冗余的TGACG 序列元件结合转录因子TGA2、TGA5和TGA6相互作用共同激活植物抗性基因的表达,从而提高植物抗病能力[8-10]。NPR1基因及其同源基因已经在拟南芥(Arabidopsis thaliana)[11-12]、水稻(Oryza sativa)[13-14]、苹果(Malus domestica)[15]、葡萄(Vitis vinifera)[16-17]等多种植物中被分离克隆,过表达At-NPR1基因的水稻中发现当水稻感染白叶枯病、稻瘟病时,At NPR1基因表达量明显提高[18];过表达At NPR1基因的小麦提高了其对镰刀菌赤霉病的抗病能力[12],在水稻中过表达Os NPR1基因后,不仅提高了水稻白叶枯病抗病性[14],而且提高了水稻对草食动物的敏感性。在双子叶植物中也发现,过表达At NPR1基因的柑橘加强了柑橘对黄龙病、溃疡病的耐受[19],在苹果中过表达Malus NPR1基因,苹果中PR 基因被激活,提高了苹果树对细菌和真菌病原菌的抗性[15],NPR1基因参与了植物免疫系统的调节。
越来越多的研究证据表明NPR1是SA 的受体[20]。在拟南芥中NPR1基因是SA 诱导PR(Pathogenesis-Related,PR)基因表达和抵抗病原体所必需的[4]。当植物未感染病原菌时,SA 水平较低,NPR1主要存在于通过分子间二硫键形成的低聚物中;当植物感染病原菌后,SA 水平升高,NPR1低聚物被还原为单体以响应病原体感染期间SA 积累增加引起的氧化还原变化[21]。
鉴于NPR1蛋白在植物防御反应中发挥重要的作用,而猕猴桃NPR1基因在抗病中的功能研究目前报道较少,故本研究选用高感病品种‘红阳’和抗病品种‘徐香’猕猴桃为材料[22],克隆Ac NPR1基因序列,利用生物信息学方法对Ac-NPR1蛋白的理化性质,二、三级结构、亚细胞定位等特性进行预测分析,用DNAMAN 和MEGA 7.0 进行氨基酸多序列比对和进化关系的分析与构建。利用实时荧光定量PCR 分析猕猴桃Ac NPR1基因组织表达情况,以及猕猴桃溃疡病致变种(Psa)、水杨酸加病原菌(SA+Psa)处理不同时间基因的表达量变化,旨在为初步明确猕猴桃Ac NPR1基因在抗病中的作用机制提供初步的理论基础。
1 材料与方法
1.1 植物材料与处理
试验材料源自陕西省汉中市城固县自然好猕猴桃专业合作社猕猴桃园,移栽于陕西理工大学资源生物重点实验室的嫁接2 a生高感病品种‘红阳’猕猴桃(Actinidia chinensisvar.chinensis‘Hongyang’)、抗病品种‘徐香’(Actinidia deliciosavar.‘Xuxiang’)猕猴桃幼苗,试验于2021年3月进行。
分别取‘红阳’猕猴桃和‘徐香’猕猴桃的茎、花、叶片,装入无菌的样品管内标记,放入液氮速冻,并保存于-80 ℃冰箱备用。将‘红阳’猕猴桃和‘徐香’猕猴桃幼苗分为3组,喷洒水为第1组(对照组,CK)、先水对叶片进行喷洒,1周后用丁香假单胞杆菌猕猴桃致变种(Pseudomonas syringaepv.actinidiae,Psa)菌液(陕西理工大学资源生物重点实验室分离鉴定保存菌种,Genbank 序列登录号 MW404385,菌液浓度108cfu/m L)进行喷洒处理为第2组(Psa)、先用水杨酸(2.5 mmol/L)对叶片进行喷洒预处理,1周后用丁香假单胞猕猴桃致变种液喷洒叶片为第3组(SA+Psa),预处理方法参照文献[23];处理后分别在0 h、6 h、12 h、24 h、48 h、72 h 5个时间点取样,装入无菌的样品管内,用记号笔标记采取样品的处理和时间,立即放入液氮中进行速冻,转入-80 ℃冰箱保存待用,每个样品重复3 次。
1.2 RNA提取及cDNA合成
采用TransZol Plant 试剂(TransGen Biotech)提取不同处理时期样品RNA,经电泳检测(1%琼脂糖凝胶)合格,Thermo NanoDrop 2000分光光度计测定各样品的浓度以及OD260/OD280、OD260/OD230值;后 反 转 录 为cDNA(TransScript One-Step gDNA Removal and cDNA Synthesis Supermix,TransGen Biotech)并保存于-20 ℃冰箱备用。
1.3 猕猴桃Ac NPR1 基因的克隆及测序
根据猕猴桃数据库(http://kiwifruitgenome.org/)中注释为Regulatory protein NPR1蛋白基因的序列(编号Acc15406),利用Primer 6.0软件设计引物,Ac NPR1基因上下游引物见表1。分别为ATGGCAAATTCTGC 和TTACGACAATTTTCTAATCTTGTAATTC。以Psa菌液处理12 h的猕猴桃叶片cDNA 为模板,利用高保真酶进行PCR,退火温度为60 ℃,PCR 产物检测(1%琼脂糖凝胶)、胶回收(E.Z.N.A.○RGel Extraction Kit)、载体连接等方法参照本实验室方法[24],选取阳性克隆送北京擎科生物有限公司(西安测序部)进行测序。
1.4 AcNPR1 序列的生物信息学分析
利用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)在线分析开放阅读框,通过SMART 在线分析Ac NPR1蛋白序列的保守结构域(https://smart.embl-heidelberg.de/);利用DNAMAN 9.0 软件对猕猴桃Ac NPR1 蛋白质与其他物种NPR1 蛋白质进行比对分析;使用Clutsal Xv1.83 程序进行多序列比对,然后将比对结果输入到MEGA 7.0 软件中,利用邻接法(neighbor-joining,NJ)构建系统发育树,Bootstrap 值 取1 000 次;利 用ExPASy-ProtParam tool 在线软件(http://web.expasy.org/protparam/)进行蛋白质理化性质分析;利用Expasy中的ProtScale 在线软件(http://web.expasy.org/protscale/)分析Ac NPR1蛋白质的亲水性和疏水性;利用NetPhos v3.1(http://www.cbs.dtu.dk/services/NetPhos/)在线工具对猕猴桃Ac NPR1蛋白进行潜在的磷酸化位点预测分析;利用SOPMA 数据库(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)得 到Ac NPR1 可能的二级结构;利用SWISS-MODEL(http://swissmodel.expasy.org)进行同源建模,构建Ac-NPR1的三级结构域模型;通过TMPred(https://embnet.vital-it.ch/software/TMPRED_form.html)预测该蛋白跨膜区域;通过CELLO2GO 在线分析工具(http://cello.life.nctu.edu.tw/cello2go/)预测亚细胞的可能定位。
1.5 AcNPR1 基因实时荧光定量分析
荧光定量反应程序及反应体系按照荧光定量试剂盒(Perfectstart Green qPCR Supermix,全式金生物,北京)说明完成,采用美国ABI Step One-Plus实时荧光定量PCR 仪系统进行实时荧光定量分析。荧光定量上、下游引物分别为5′-CACAAGGCTTAGACTCAGA-3′和5′-CAAGCACTTCAGACACAAC-3′。内参基因上下游引物分 别 为5′-CTGTGAAACTGCGAATGGCTC-3′和5′-TTCCAGAAGTCGGGGTTTGT-3′。采用3次生物学重复,不同材料中目的基因的相对表达量采用2-ΔΔCT方法计算。利用SPSS 21.0统计分析软件进行数据处理。
2 结果与分析
2.1 Ac NPR1 基因克隆以及序列分析
以病原菌Psa处理12 h后的‘红阳’、‘徐香’猕猴桃叶片为试验材料,提取总RNA 反转录后进行PCR 扩增,克隆至T 载体并送样测序,得到‘红阳’Ac NPR1基因序列全长为1 770 bp(Gen-Bank登录号为MW881148)(图1-A)。经测序发现‘徐香’Ac NPR1基因序列只有个别碱基与‘红阳’不同(未列出)。本研究进一步对‘红阳’序列进行生物信息学分析,利用NCBI 网站中ORF Finder在线工具分析该序列开放阅读框,发现该基因序列开放阅读框长为1 770 bp,可编码589个氨基酸;利用SMART 分析该蛋白序列的保守结构域,结果表明在第64位至第190位,第266位至361位,第371位至575位区域间分别含有N 端保守的BTB-POZ、锚蛋白重复结构域An Ks、C端NPR1_like_C 植 物NPR1 蛋 白 所 共有的保守结构域(图1-B)。
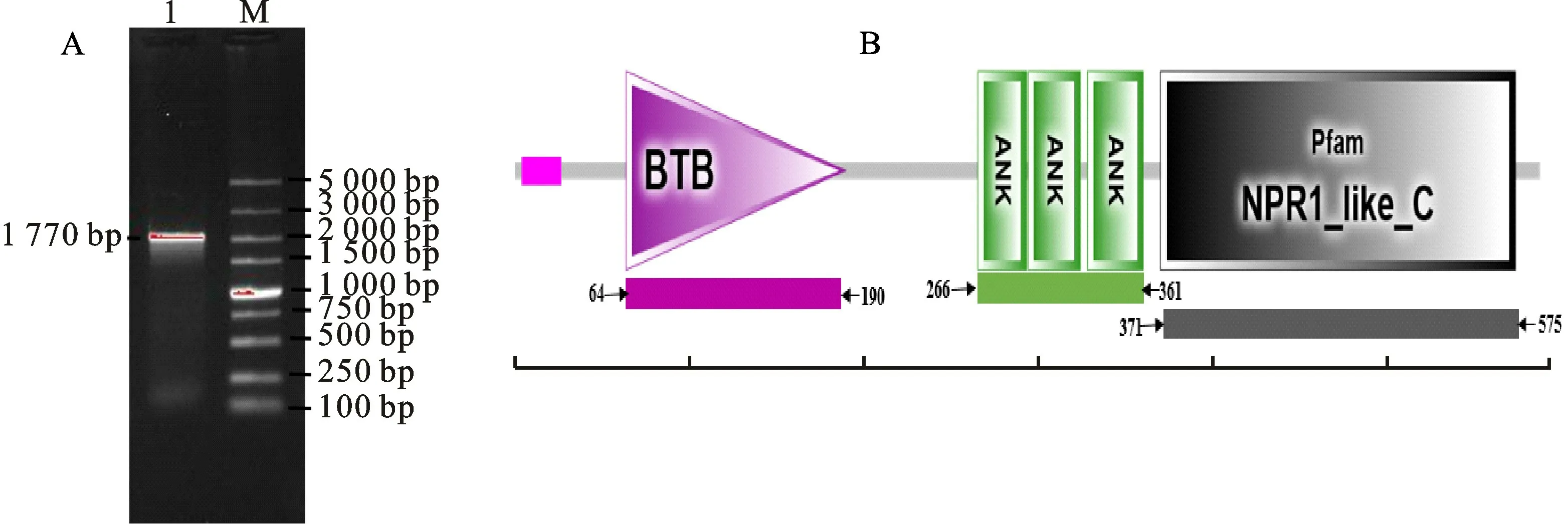
图1 ‘红阳’AcNPR1 基因PCR 扩增(A)和AcNPR1蛋白的保守结构域(B)Fig.1 The PCR amplified product of AcNPR1 gene(A)and the conserved domain of AcNPR1 protein(B)in‘Hongyang’
2.2 AcNPR1蛋白的理化性质及磷酸化位点分析
利用在线工具ProtParam 分析Ac NPR1基因编码的蛋白分子式为C2895H4639N799O889S29,分子质量为65 792.24 ku,理论等电点(pI)为6.27,其中异亮氨酸和丝氨酸的使用频率最高,均占所有氨基酸的10.9%;然后依次为丙氨酸,含量最少的为色氨酸,占所有氨基酸的0.2%。Ac NPR1蛋白的不稳定指数为43.75;总平均亲水性为-0.245,脂肪系数为89.56。ProtScale在线软件分析蛋白质的亲水性和疏水性,发现该蛋白为亲水性蛋白(图2-A);利用NetPhos对该蛋白的磷酸化位点进行分析,发现Ac NPR1蛋白均具有丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Try)磷酸化位点(图2-B)。通过TMPred 预测该蛋白跨膜区域,跨膜结构域预测结果显示猕猴桃Ac NPR1蛋白可能为一个跨膜蛋白,分别在第5~26、115~134、160~182、193~216个氨基酸处含有4个从内到外的跨膜结构域(图2-C)。
2.3 AcNPR1蛋白二、三级结构特征和亚细胞定位预测分析
通过SMOPA 数据库得到二级结构预测结果表明,AcNPR1蛋白质二级结构主要是由α螺旋、β折叠、延伸链、无规则卷曲所组成,占据比例分别为53.14%、3.57%、7.47%、35.82%(图3-A);其中α螺旋和无规则卷曲所占比例较高,为其主要的二级结构元件。通过SWISS-MODEL软件预测Ac NPR1蛋白质三级空间结构模型,含有α螺旋至少35个,β折叠至少7个,无规则卷曲至少25个,主要是以螺旋为基本结构单元形成的平行或反向平行螺旋结构(图3-B)。利用CELLO2GO 在线分析工具对Ac NPR1蛋白亚细胞的可能定位进行预测分析,结果显示,猕猴桃Ac NPR1 蛋白亚细胞定位最可能位于细胞核(表1)。

表1 亚细胞定位预测Table 1 Prediction of AcNPR1 protein in‘Hongyang’
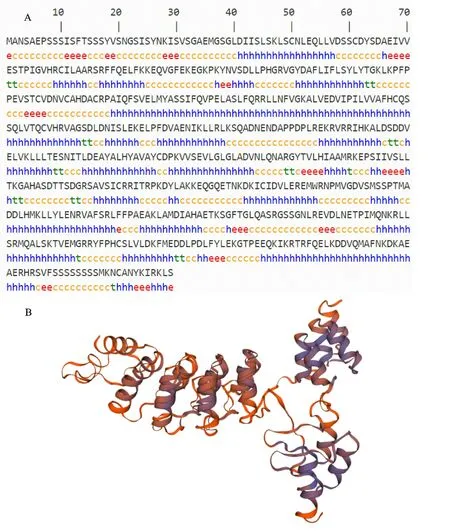
图3 ‘红阳’猕猴桃AcNPR1蛋白质的二级结构(A)、三级结构(B)预测Fig.3 Prediction of secondary(A)and tertiary structure(B)of AcNPR1 protein in‘Hongyang’
2.4 AcNPR1 基因编码的氨基酸序列的比对分析
利用DNAMAN 7.0软件,将克隆得到的‘红阳’猕猴桃Ac NPR1基因编码的氨基酸序列与在NCBI网站上获取其他物种的NPR1氨基酸序列进行序列比对(图4),结果表明猕猴桃Ac NPR1氨基酸序列与茶树(XP_028062623.1)、葡萄(XP_002274045.1)、银白杨(XP_034927243.1)、酸枣(XP_015882955.1)、烟草(XP_016442273.1)和胡桃(XP_018835840.1)的NPR 类转录因子保守结构域一致性较高。在N 端包含BTB_POZ结构域、Ank2保守域,C 端有NPR1_Like_C 结构域,与大多数物种NPR1 蛋白序列相似,蛋白相似性分别为83.94%、79.63%、78.10%、76.27%、75.62%和74.28%。

图4 ‘红阳’猕猴桃AcNPR1 与不同物种NPR1 转录因子氨基酸序列多重比对Fig.4 Multiple alignment of amino acid sequences of AcNPR1 in‘Hongyang’and NPR1 transcription factors in different species
采用 MEGA 7.0 软件分析8 个物种的NPR1蛋白序列与‘红阳’猕猴桃Ac NPR1 蛋白序列进行系统进化分析并构建进化树(图5),结果显示NPR1蛋白被大致分为两组,‘红阳’猕猴桃Ac NPR1蛋白与银白杨、簸箕柳、大豆、葡萄、酸枣、茶树聚为一组,‘红阳’猕猴桃Ac NPR1 蛋白与茶树CsNPR1 蛋白亲缘关系最近。
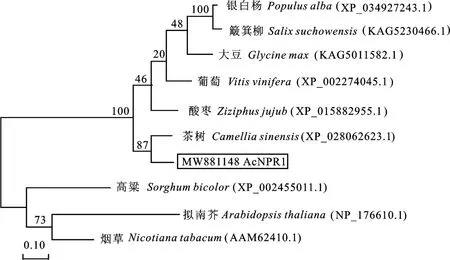
图5 ‘红阳’猕猴桃AcNPR1蛋白系统进化树分析Fig.5 Phylogenetic tree analysis of AcNPR1 protein in‘Hongyang’
2.5 AcNPR1 基因表达分析
利用实时荧光定量PCR 对‘红阳’和‘徐香’不同组织中的茎、叶、花Ac NPR1基因表达模式进行分析。结果表明,Ac NPR1基因在‘徐香’品种不同组织的表达量从大到小依次为叶、花、茎(图6-A);在‘红阳’品种同样是在叶片中的表达量最高,其次是茎,表达量最小的为花(图6-B);两品种Ac NPR1基因均在叶片中表达量最高。
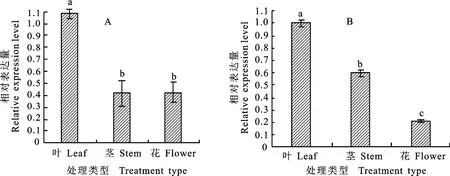
图6 ‘徐香’猕猴桃(A)和‘红阳’猕猴桃(B)AcNPR1 基因组织表达分析Fig.6 Expression analysis of AcNPR1 gene in different tissues of‘Xuxiang’(A)and‘Hongyang’(B)
以正常生长处理组(CK)为对照,分析Psa以及SA+Psa处理下不同抗性品种猕猴桃在不同处理时间下Ac NPR1基因表达水平变化情况。结果表明,在Psa处理下,0 h 时‘红阳’品种中Ac NPR1基因相对表达量低于对照,而‘徐香’中Ac NPR1基因相对表达量迅速上升至对照的3.7倍;6 h后两品种中Ac NPR1基因相对表达量均呈现先升高后下降的趋势(图7),‘红阳’和‘徐香’品种分别在48 h和24 h时基因相对表达量达到最大,Psa处理下‘红阳’Ac NPR1基因相对表达量始终低于‘徐香’(图7-A)。在SA+Psa处理下,0 h时‘红阳’品种中Ac NPR1基因相对表达量略高于对照,而‘徐香’中Ac NPR1基因相对表达量迅速升高至对照的2.9倍;之后‘徐香’Ac NPR1基因相对表达量均呈现先升高后下降的趋势,在24 h时基因相对表达量达到最大为对照的7.7倍,‘红阳’Ac NPR1基因相对表达量在6 h至48 h内波动变化,72 h达到最大,为对照的1.6倍,且该处理下‘红阳’基因表达量始终低于‘徐香’(图7-B)。不同处理下,‘徐香’品种Ac-NPR1基因相对表达量高于‘红阳’,且‘徐香’中基因相对表达量达到最高的时间早于‘红阳’。
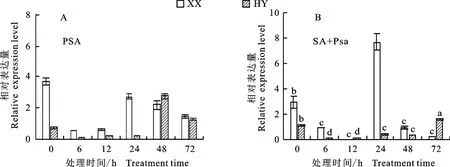
图7 病原菌(A)、SA加病原菌(B)处理下两品种叶片AcNPR1 基因表达量Fig.7 Expression of AcNPR1 gene in leaves of two varieties under Psa(A)and(SA+Psa)(B)treatment
3 讨论
NPR1基因是介导植物免疫系统的重要调控因子[20],病原菌侵染时其特异性结构域与转录因子相结合激活植物免疫系统,相关抗病基因如PR 基因表达量上调,从而提高植物抗病能力。本研究以病原菌侵染12 h 后的高感病品种‘红阳’和抗病品种‘徐香’猕猴桃叶片为试验材料,克隆得到两个品种猕猴桃AcNPR1基因序列,对‘红阳’Ac NPRN1基因进行生物信息学分析发现,该基因完整开放阅读框(ORF)大小为1 770 bp,编码589个氨基酸,含有典型的BTB/POZ结构域、ANK 锚蛋白重复序列和NPR1_like_C 3个结构域,多重序列比对发现其与已报道的茶树、葡萄、烟草等物种中NPR1类蛋白保守结构域一致,系统进化树分析显示Ac NPR1蛋白与茶树亲缘关系最近。
在拟南芥、水稻、番茄以及小麦中过量表达At NPR1基因能够提高植物对细菌和真菌的抗性[4,11-13];在水稻中过量表达OsNPR1基因提高了水稻对细菌性枯萎病的抗病性[14];与之类似,在两个苹果栽培品种中过表达MalusNPR1基因后,发现其激活了PR基因增强了其对火疫病及两种苹果的重要真菌病原体的抗性[15]。研究表明,毛花猕猴桃(Actinidia eriantha)接种猕猴桃溃疡病病原菌后发现,Ae NPR1基因被诱导上调表达,从而提高了毛花猕猴桃的抗病性[25]。本研究中在猕猴桃溃疡病致变菌侵染猕猴桃后,抗病品种‘徐香’和高感病品种‘红阳’中Ac NPR1基因表达量均被上调,表明Ac NPR1基因在猕猴桃抵御溃疡病过程中发挥了一定作用;并且‘红阳’品种Ac NPR1基因表达量始终低于抗病品种‘徐香’,抗病性不同的猕猴桃品种在响应病原菌胁迫的抗病机制方面存在差异,抗性品种为了抵御病原菌造成的伤害,会迅速启动抗性反应,在抗病品种‘徐香’中AcNPR1基因被迅速诱导表达,参与了植物对病原菌的早期抗性反应,从而启动下游与抗病相关基因的表达,这与水稻、百合和猴面花中NPR1基因表达结果一致[14,26-27]。
水杨酸(SA)是一种酚类植物激素,能够作用于植物的生长发育过程,也是植物免疫系统的主要调控激素之一,在植物抵御生物营养性和半生物营养性病原菌方面起着重要作用[28]。SA 介导的系统获得性抗性(Systemic Acquired Resistance,SAR)是植物的一种广谱抗病机制,NPR1是其关键调节因子之一,是将SA 信号转化为PR相关基因表达所必需的[29]。研究表明,外源SA、JA 等可以诱导NPR1基因或其同源基因表达从而激活植物抗病反应[30-32]。本研究中经SA 预处理后,在抗病品种‘徐香’和高感病品种‘红阳’中Ac NPR1基因表达水平均升高,表明SA 对诱导Ac NPR1基因表达从而激活猕猴桃抗病反应具有一定作用,与上述报道中结果一致。此外,侯珲等[33]的研究表明轮纹病抗病苹果品种的抗性基因更容易受到SA 的诱导表达,这与本研究结果类似,在抗病品种‘徐香’中Ac NPR1基因表达变化受SA 诱导影响较大。SA 预处理过的抗病品种‘徐香’Ac NPR1基因表达量约是未做SA 预处理组的2倍,而感病品种‘红阳’则相反;这表明不同抗性猕猴桃品种间NPR1响应SA 诱导表达的调控机制可能存在差异。研究表明,SA 含量影响植物抗病反应的发生、强度及快慢,SA、病原菌的诱导可以使植物体内SA 水平升高,不同抗性品种间SA 水平的差异可能造会成抗性反应及NPR1等相关抗性基因表达的差异。但是,抗病信号传递途径是一个非常复杂的体系,不同抗病性品种间Ac NPR1基因表达为什么会呈现出差异,需要后续进一步深入研究。
