姜黄素类似物H8对糖尿病大鼠肾脏炎症和氧化应激的改善
2022-07-15李嘉丽高雪玲袁晓环
王 猛,张 蒙,杨 威,李嘉丽,高雪玲,袁晓环
(牡丹江医学院生命科学学院,黑龙江 牡丹江 157011)
随着我国社会经济的发展,人民生活质量日渐提高,高糖高脂饮食、营养过剩、缺乏运动等不良习惯导致糖尿病 (diabetes mellitus,DM) 患病率呈现出迅猛增长的趋势[1]。根据2015年至2017年中华医学会的一项全国糖尿病流行病学调查显示,我国18岁以上人群糖尿病患病率已经达到11.2%。糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症之一,同时也是引起终末期肾病(ESRD)的主要原因。流行病学研究表明,到2030年全球范围内DM患者将超过3亿人,其中DN患者就将达到1亿人[2]。糖尿病肾病不仅给患者带来巨大痛苦还会造成巨额医疗费用支出,由于该病的发病机制非常复杂,一旦发展到终末期,往往比其他肾脏疾病的治疗更加棘手,因此,迫切需要寻找一种对糖尿病肾病有效的防治手段[3]。姜黄素( curcumin,Cur) 是从姜黄等姜科植物中提取的一种黄色酚类化合物,具有抗炎、抗氧化、抗纤维化以及抗肿瘤等多种药理作用,应用前景十分广泛,且已用于糖尿病肾病的治疗,但姜黄素依然存在不足之处,表现为溶解度不高、稳定性差、代谢较快等问题,这导致了其生物利用度较低[4]。本实验室以姜黄素为母体研发了姜黄素类似物H8,其分子量更小,性质也更稳定,相较于姜黄素有较高的生物利用度。已有前期实验表明H8具有改善胰岛素敏感性和糖代谢的作用[5]。本实验通过建立2型糖尿病大鼠模型,探讨姜黄素类似物H8对糖尿病肾脏炎症和氧化应激损伤的改善作用及机制,旨在为糖尿病肾病损伤的预防和治疗提供新的思路和方法,也为糖尿病肾病损伤的新药开发提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 由辽宁长生生物技术有限公司提供的30只健康清洁级雄性SD大鼠(160~200 g),生产许可证号:SCXK(辽)2015- 0001。大鼠维持饲料(辽宁长生生物技术股份有限公司),高脂饲料(每100 kg含大鼠维持饲料73.6 kg,猪油15 kg,蛋黄粉10 kg,胆固醇1 kg,胆酸钠0.1 kg,丙硫氧嘧啶0.1 kg,北京小黍有泰生物有限公司)。饲养于牡丹江医学院生命科学学院动物室,12 h光昼交替,温度维持为20 ℃。本校伦理审查会已批准此次动物实验的各项操作。
1.1.2 试剂 H8(牡丹江医学院生命科学学院),STZ、伊红、苏木素染色液(北京Solarbio公司),柠檬酸、柠檬酸三钠(天津恒兴有限公司),羧甲基纤维素钠CMC-Na(上海aladdin公司),mRNA提取试剂盒(美国Omega公司),RNA逆转录试剂盒(美国Roche公司),兔源一抗TNF-α(北京Bioss公司),鼠源一抗IL-6、兔源一抗IL-17、兔源一抗TGF-β1、兔源一抗NF-κB、兔源一抗 βactin(美国Abcam公司),ECL特超敏显色液(韩国Biosharp公司),SYBR Green(美国Origene公司),过氧化氢酶(CAT)试剂盒、总超氧化物歧化酶(T-SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-PX)试剂盒、丙二醛(MDA)试剂盒(南京建成生物技术有限公司)。
1.1.3 仪器 包埋机、石蜡切片机、生物显微镜(德国Leica公司),台式高速离心机(美国Sigma公司),血糖仪(美国Roche公司),全自动生化分析仪(美国Beckman Coulter公司),超微量蛋白核酸测定仪(美国Thermo公司),荧光定量PCR仪(美国Bio-Rad公司),超灵敏多功能成像仪(美国Genera Electric公司),紫外可见分光光度计(北京普析通用仪器有限公司)。
1.2 方法
1.2.1 模型建立与分组 将30只大鼠按照随机数字法分为对照组、模型组及H8组,n=10。对照组给予正常维持饲料饲养,模型组和H8组则给予高脂饲料饲养。8周后,模型组和H8组大鼠腹腔注射STZ(25 mg/kg)溶液;对照组大鼠腹腔注射等剂量的柠檬酸缓冲液。48 h后连续3 d测定大鼠空腹血糖,若血糖值大于11.1 mmol/L则表示成功建立2型糖尿病模型。配置浓度为6 mg/mL的H8溶液(溶于1% CMC-Na),H8组大鼠以H8(6 mg/kg)溶液每日灌胃;对照组和模型组以等量1% CMC-Na溶液每日灌胃,干预4周。在处死大鼠前第3天将各组大鼠置于代谢笼中1 d,禁食且不禁水,收集24 h尿液,离心(3000×g,20 min),取上清液备用。末次给药后禁食14 h,称重,麻醉后以眦眼法取血,离心(5000×g,10 min),取上清液备用。
1.2.2 生化指标检测 全自动生化分析仪测定血清中CR、UR、UA水平和尿液中UmAlb、UNAG,血糖仪测定GLU水平。
1.2.3 Real-time PCR法检测肾组织TNF-α、IL-6、IL-17、TGF-β1、NF-κB基因的表达 提取大鼠肾组织总mRNA,使用逆转录试剂盒将RNA逆转录为cDNA,然后进行real-time PCR。反应程序为95 ℃预变性5 min,95 ℃变性30 s,53 ℃~60 ℃退火30 s,扩增40个循环。引物列表详见表1。

表1 基因引物序列表
1.2.4 Western blot法检测肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB蛋白的表达 提取大鼠肾组织总蛋白,进行聚丙烯酰胺电泳,转膜、封闭后加入相应一抗 ( Anti-TNF-α 1∶1000、Anti-IL-6 1∶1000、Anti-IL-17 1∶1000、Anti-TGF-β 1∶1000、Anti-NF-κB 1∶1000抗体),在4 ℃环境下孵育过夜,用TBST洗膜后用相对应的二抗(辣根酶标记的山羊抗兔抗体1∶10000、辣根酶标记的山羊抗小鼠抗体1∶10000) 常温孵育,再次洗膜后,于膜上均匀滴加ECL显色液显色,分析各组结果的灰度值。
1.2.5 肾组织病理形态学检测 取大鼠肾组织置于10%甲醛溶液中固定,梯度乙醇溶液脱水,包埋后切片,厚度约为5 μm,进行HE染色、PAS染色,中性树脂封片,于正置显微镜下观察肾组织病理形态学变化。
1.2.6 肾组织氧化应激损伤检测 检测肾组织中过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)的含量,取大鼠肾组织研磨并制成10%的组织匀浆。计算匀浆液浓度后,采用紫外分光光度法,按照试剂盒说明书操作,测定各组光密度(OD)值。
1.3 统计学分析采用GraphPad Prism 5.0统计学软件进行统计学分析,计量资料以“均数±标准差”表示,采用单因素方差分析法进行多组间比较,采用LSD-t检验进行事后两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体重和生化指标的测定结果与对照组比较,模型组大鼠体重减轻,血清中GLU、CR、UR、UA水平均升高(P<0.05,P<0.01,P<0.001);与模型组比较,H8组大鼠体重无明显变化,血清中GLU、CR、UR、UA水平均降低(P<0.05,P<0.01),见表2。

表2 各组大鼠体重及血液生化指标
与对照组比较,模型组大鼠尿液中UmAlb、UNAG水平均升高(P<0.01);与模型组比较,H8组大鼠尿液中UmAlb、UNAG水平均降低(P<0.01),见表3。

表3 各组大鼠尿液生化指标
2.2 各组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB基因表达水平的测定结果与对照组比较,模型组大鼠肾组织TNF-α、IL-6、IL-17、TGF-β1、NF-κB mRNA表达增加(P<0.05,P<0.01,P<0.001),与模型组比较,H8组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB mRNA表达减少(P<0.05,P<0.01,P<0.001),见图1。

图1 各组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB mRNA表达情况
2.3 各组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB 蛋白表达水平的测定结果与对照组比较,模型组大鼠肾组织TNF-α、IL-6、IL-17、TGF-β1、NF-κB蛋白表达增加(P<0.05,P<0.01,P<0.001);与模型组相比,H8组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB蛋白表达减少(P<0.05,P<0.01,P<0.001),见图2。
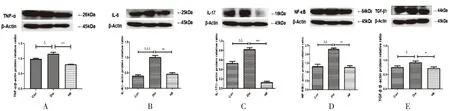
图2 各组大鼠肾组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB 蛋白表达情况
2.4 各组大鼠肾组织中CAT、T-SOD、GSH-PX、MDA含量的测定结果与对照组比较,模型组大鼠肾组织中CAT、T-SOD、GSH-PX水平降低,MDA水平升高(P<0.05,P<0.01,P<0.001),与模型组比较,H8组大鼠肾组织中CAT、T-SOD、GSH-PX水平升高,MDA水平降低(P<0.05,P<0.01),见图3。
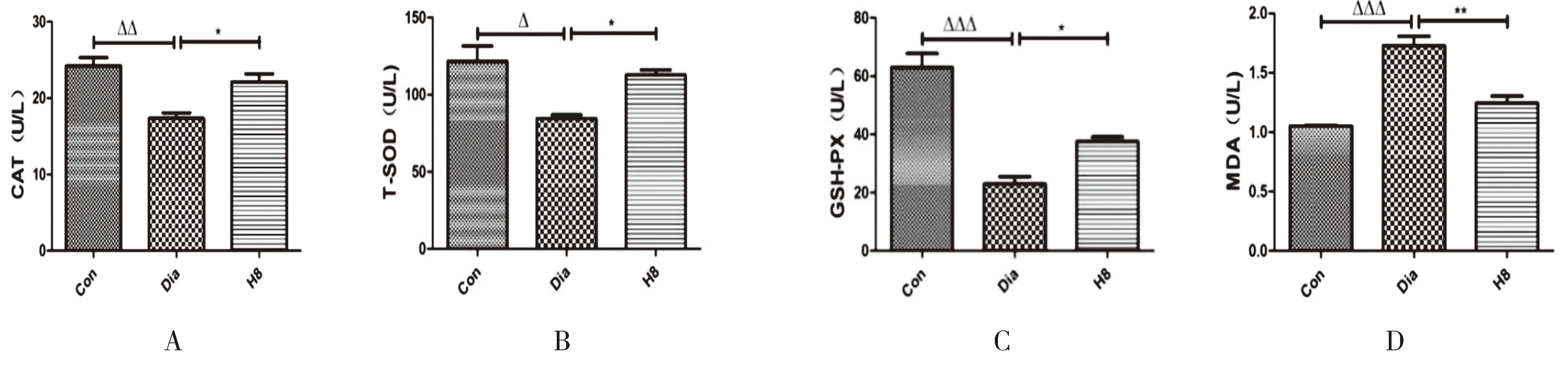
图3 各组大鼠肾组织中CAT、T-SOD、GSH-PX、MDA的含量
2.5 各组大鼠肾组织病理形态学变化HE染色结果显示,对照组大鼠肾组织中细胞数量正常,肾小球各项形态健康;与对照组相比,模型组大鼠肾组织中细胞数量减少,球囊腔明显扩大;与模型组相比,H8组大鼠肾组织中细胞数量增加,球囊腔轻度扩大,见图4。

图4 各组大鼠肾组织HE染色图(×400)
PAS染色结果显示,对照组大鼠肾小球结构与形态均正常,无显著病理改变;与对照组相比,模型组大鼠肾组织中系膜基质增多,球囊腔扩大;与模型组相比,H8组大鼠肾组织中系膜基质增多情况有所改善,球囊腔轻度扩大,见图5。

图5 各组大鼠肾组织PAS染色图(×400)
3 讨论
糖尿病肾病是一种较为严重的糖尿病并发症,其发生机制主要与血液中持续的高糖水平有关,高血糖可导致肾脏出现局部炎症及氧化应激损伤,肾小球、肾小管的增生肥大标志着早期DN的形成,肾脏功能发生异常,进一步导致肾小球硬化和肾小管间质纤维化等不可逆损伤的出现,最终造成终末期肾功能衰竭[6]。本实验室前期已通过实验探究了不同浓度的H8对大小鼠糖尿病的影响,基于前期实验结果,故选用6 mg/kg剂量的H8进行此次实验研究[7]。本实验结果显示,与对照组相比,模型组大鼠血清中CR、UR、UA水平升高,尿液中UmAlb、UNAG水平升高,肾脏组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB基因及蛋白水平过表达,CAT、T-SOD、GSH-PX水平降低,MDA水平升高,且肾小球形态异常,肾组织存在明显的病理形态学损伤。与模型组相比,经H8给药后的糖尿病大鼠血清中CR、UR、UA水平降低,尿液中UmAlb、UNAG水平降低,炎症和氧化应激损伤情况减轻,肾小球形态趋于正常,肾组织病理形态学损伤减轻,提示姜黄素类似物H8可对糖尿病大鼠肾脏起保护作用。
在临床中常用UmAlb、UNAG、CR、UR、UA作为检测肾功能的指标。肾小球损伤后其基膜通透性降低,白蛋白过量排出,因此尿微量白蛋白水平是判断早期肾脏病变的重要标准[8]。肾小管上皮细胞的溶酶体中存在大量尿N-乙酰-β氨基葡萄糖苷酶,其排泄较为稳定,而肾急性损伤发生时会增加该酶的活度,导致其在尿中的水平升高[9]。肾小球滤过率(glomerular filtration rate,GFR)可用来诊断早期肾功能衰退情况,其中血肌酐是评价GFR的重要指标,血肌酐值较高往往标志着肾脏功能损伤[10]。尿素主要由肾小球滤过以尿液的形式排出体外,在机体代谢循环稳定时,血清中尿素的浓度由肾脏功能决定,所以血尿素值也可以反应GFR的情况[11]。机体内约70 %的尿素都经由肾脏排出,若体内血尿素含量异常升高,可说明肾小球滤过能力下降,提示肾脏功能出现损伤。血尿酸在肾中经重吸收作用,绝大部分均由肾小球滤过而从尿液中排出体外,当GFR降低时,血尿酸排出能力下降,其在血清中的浓度也将异常升高。本实验结果显示,H8组大鼠UmAlb、UNAG、CR、UR、UA水平相较于模型组均降低,提示H8可以发挥对肾脏损伤的保护作用。
有研究表明核转录因子NF-κB信号通路是炎症反应发生的重要途径之一,该通路的过渡激活与机体内持续性的高血糖环境相关,体内的高糖环境将产生过量的晚期糖化终产物,这可促进NF-κB及其下游炎症信号如TNF-α、IL-6、TGF-β1的过表达,加重炎症反应发生[12]。IL-17作为早期炎性反应启动因子,可诱导激活T细胞、上皮细胞从而产生IL-6等炎性细胞因子来放大炎症反应[13]。本实验结果显示,H8组大鼠肾脏组织中TNF-α、IL-6、IL-17、TGF-β1、NF-κB的基因及蛋白水平较模型组均下降,提示为H8可以通过改善糖尿病大鼠肾脏组织炎症反应来发挥其对肾脏损伤的保护作用。
氧化应激(Oxidative Stress,OS)是一种机体内氧化反应与抗氧化反应不平衡,从而导致氧自由基产生过多的现象,这将造成体内的过氧化环境,该环境下会破坏细胞修复进程,导致细胞损伤,氧化应激反应与晚期糖化终产物也同样是机体衰老、炎症发生等慢性疾病的重要诱因。抗氧化系统可清除氧自由基,机体的氧化损伤程度可以由CAT、T-SOD、GSH-Px等酶类抗氧化物的活性来反应[14]。氧自由基可与细胞膜中的多不饱和脂肪酸发生反应,引发脂质过氧化作用,并形成脂质过氧化酸MDA,其不但能攻击线粒体并造成线粒体损伤,也能对生物膜造成损害。且有研究表明早期DN患者的肾脏中MDA水平显著增高,肾脏对抗氧化反应功能的异常,MDA水平可反应机体中细胞氧化损伤的程度[15]。本实验结果显示,与模型组相比,H8组大鼠肾脏组织中CAT、T-SOD、GSH-PX的水平升高且MDA水平下降,表明 H8 可改善糖尿病大鼠肾脏的氧化损伤程度。
综上所述,姜黄素类似物H8可对糖尿病大鼠肾脏产生保护作用,其一方面可以通过改善肾脏炎症起作用,另一方面则可能与改善肾脏氧化损伤相关。
