吉林省牛病毒性腹泻病毒与牛肠道病毒混合感染的流行病学调查
2022-07-15胡俊英张芷源胡卉琪常晓冉王浴光米日古丽买吐送王新平吉林大学动物医学学院吉林长春30062教育部人兽共患病研究重点实验室吉林长春30062
董 坤,胡俊英,张芷源,章 凡,胡卉琪,常晓冉,王浴光,米日古丽·买吐送,王新平,2*(.吉林大学 动物医学学院,吉林 长春 30062;2.教育部人兽共患病研究重点实验室,吉林 长春 30062)
牛病毒性腹泻(bovine viral diarrhea,BVD),又称黏膜病 (mucosal disease,MD),是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起动物的一种呈现多临床类型表现的传染病,临床上以腹泻、消化道黏膜发炎、坏死和糜烂为典型特征[1-2]。母牛在怀孕前3个月内感染BVDV可引起胎牛对病毒产生免疫耐受,这种犊牛出生后虽然血清抗体呈阴性,但可终身携带病毒,并不断向周围环境排毒,是最危险的传染源,给该疫病的防控带来困难。此外,BVDV感染无论呈显性感染还是隐性感染均可产生免疫抑制作用,导致感染动物的抵抗力下降,进而增强对其他疫病的易感性。目前,国内已有多个省市自治区报道有牛病毒性腹泻的暴发流行[3-6]。
牛肠道病毒(bovine enterovirus,BEV)感染是国内近年来新发的动物传染病,临床上以消化道和呼吸道症状为主要特征[7-8]。引起肠道病毒感染的病原体为小RNA病毒科、肠道病毒属中的成员。该病毒直径25~30 nm呈二十面体结构。根据病毒的最新分类,肠道病毒属包含12个肠道病毒种和3个鼻病毒种,其中E种和F种肠道病毒引起牛的感染[9-10]。BEV感染最早于1959年首次由MOLL等[11]报道,之后许多国家也先后报道本病的暴发流行[12-14]。国内李英利等[7]于2011年首次从腹泻的犊牛体内分离出F种肠道病毒;邢泽黎等[15]于2012年从吉林省某发病牛场分离出国内首株E种肠道病毒HY12,并建立了检测BEV抗原的双抗体夹心ELISA方法[16]。之后也有报道其他地区的BEV感染[17-18]。
由于BVDV与BEV感染临床上均以腹泻为主要特征,临床表现极其相似,难以区分,当发生混合感染时,难以做出确切诊断,给疫病的诊断与净化增加了困难。目前,国内有关BVDV的报道虽然很多,但与BEV混合感染情况尚不清楚,急需进行相应的流行病学调查。本研究应用检测BVDV与BEV抗原的双抗体夹心ELISA方法,分别对吉林省不同地区牛群BVDV与BEV感染进行流行病学调查,发现吉林省不同地区、不同年龄及不同品种的牛群均存在BVDV与BEV混合感染情况。
1 材料与方法
1.1 样品采集及检测粪便样品共计738份,采自 2019-2020年吉林省不同地区的牛场,其中长春204份、延边192份、白山153份、白城72份、四平117份。样品的检测采用BVDV及BEV双抗体夹心ELISA检测试剂盒[16,19]。根据检测结果,确定BVDV、BEV及两者混合感染的流行病学情况。
1.2 主要试剂、仪器及细胞抗BVDV CC13B毒株E2基因的兔源多克隆抗体、抗BEV HY12毒株VP1基因的鼠源多克隆抗体由本实验室制备与保存;罗丹明标记羊抗鼠二抗、FITC标记的羊抗兔二抗购自Sigma;DMEM购自Gibco(美国)公司;胎牛血清(FBS)购自海克隆生物公司;DNA Marker、Taq DNA聚合酶、M-MLV反转录酶等购自TaKaRa生物技术有限公司;PCR扩增仪购自杭州博日科技有限公司;电泳仪购自上海天能科技有限公司。
1.3 引物的设计与RT-PCR检测根据基因文库收录的BVDV与BEV部分标准毒株核苷酸序列,分别以保守区设计特异性引物,用于扩增目的基因序列。引物(表1)由上海生工有限公司合成。将处理好的样品接种于MDBK细胞后,应用反转录试剂盒提取细胞总RNA并反转录成cDNA,于-80℃保存备用。以cDNA作为模板,特异性引物扩增病毒的目的基因。PCR反应程序如下:95℃ 5 min;95℃ 30 s,54℃ 30 s,72℃ 30 s,共计35个循环;72℃ 10 min。
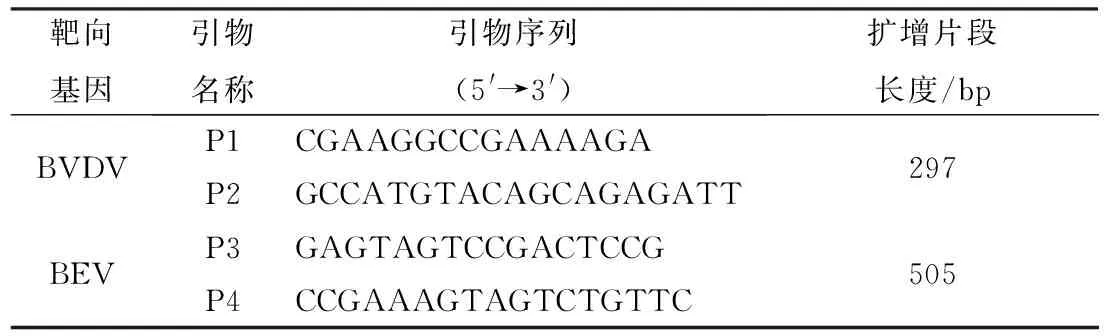
表1 引物信息
1.4 免疫学检测应用IFA试验对部分阳性样品进行免疫学鉴定,具体过程如下:选择代表性BVDV/BEV混合感染样品,接种MDBK细胞,同时设阴性对照。待细胞出现40%左右的病变后,使用甲醇于-20℃冰箱固定20 min;PBS-T洗涤后,以抗HY12毒株鼠源多克隆抗体和抗CC13B毒株兔源多克隆抗体作为一抗,于37℃孵育60 min;PBS-T洗涤后,加入罗丹明标记羊抗鼠二抗和FI-TC标记的羊抗兔二抗孵育35 min;PBS-T洗涤后,经DAPI核染色,封片置于荧光显微镜下观察。
2 结果
2.1 吉林省不同地区BVDV与BEV单一感染的检测结果对2019-2020年采集于吉林省不同地区的738份粪便样品进行BVDV和BEV的检测与分析,结果在738份样品中,检测出BVDV感染率为21.68%(160/738),BEV感染率为14.23%(105/738)。其中,长春BVDV感染率最高为42.65%(87/204),延边、白山、白城、四平BVDV感染率分别为17.71%(34/192),11.76%(18/153),12.50%(9/72),10.26%(12/117)。白城地区BEV感染率最高为20.83%(15/72),长春、延边、白山、四平地区BEV感染率分别为18.63%(38/204),8.33%(16/192),15.03%(23/153),11.11%(13/117)。上述结果表明,吉林省不同地区的牛群均存在BVDV与BEV感染(图1)。
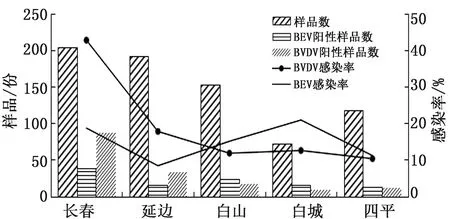
图1 吉林省不同地区牛群BVDV、BEV单一感染检测结果
2.2 不同地区BVDV与BEV混合感染的检测结果对上述BVDV与BEV检测结果运用统计学方法进行分析,结果显示,吉林省BVDV/BEV混合感染率为7.99%(59/738)(图2)。为了解BVDV/BEV混合感染在吉林省不同地区分布情况,对检测结果进一步进行分类。结果显示,长春混合感染率最高,为14.71%(30/204);四平混合感染率最低,为3.42%(4/117);延边、白山、白城混合感染率为3.65%(7/192),7.84%(12/153),8.33%(6/72)。表明BVDV/BEV混合感染在吉林省不同地区之间存在差异(图3)。
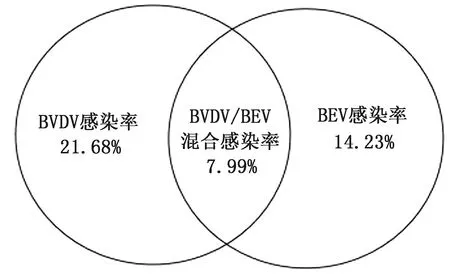
图2 BVDV和BEV单一与混合感染率检测结果

图3 吉林省不同地区BVDV和BEV混合感染率检测结果
2.3 不同品种的牛群BVDV与BEV感染结果为了解不同品种BVDV与BEV感染情况,对不同品种牛群进行检测(表2)。其中,荷斯坦牛的BVDV与BEV单一及混合感染率均最高,延边牛BEV感染率最低(8.33%)。利木赞牛及其他牛群的BVDV感染最低(10.26%),其BVDV与BEV的混合感染率也最低(3.42%)。上述结果表明,吉林省不同品种的牛群存在BVDV与BEV的单一与混合感染。
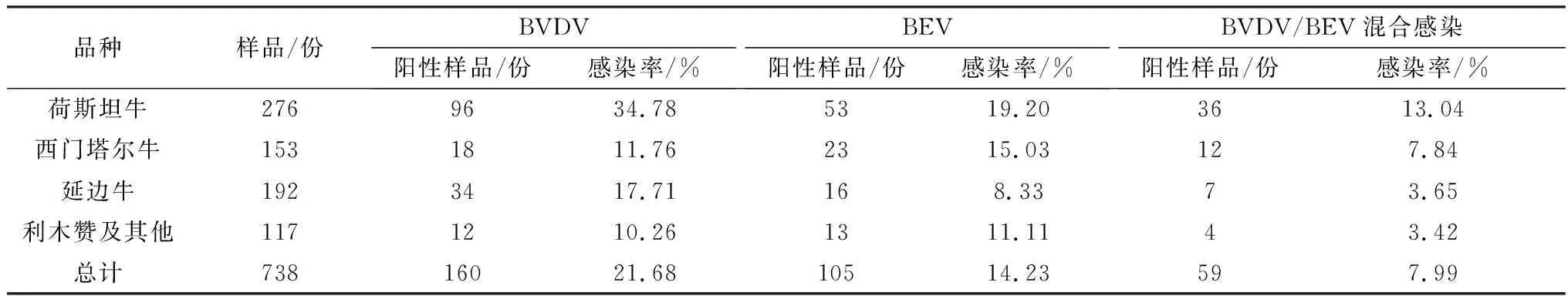
表2 不同品种牛群BVDV与BEV的感染情况
2.4 不同年龄牛群BVDV和BEV混合感染结果为了解不同年龄牛群对BVDV/BEV混合感染的情况,将上述结果运用统计学方法进行分析(图4),结果显示,犊牛混和感染率最低为3.39%(2/59),育成牛混和感染率为8.47%(5/59),青年牛混和感染率为30.51%(18/59),成年牛混和感染率为57.63%(34/59),表明各年龄的牛群均存在不同程度的BVDV和BEV混合感染。
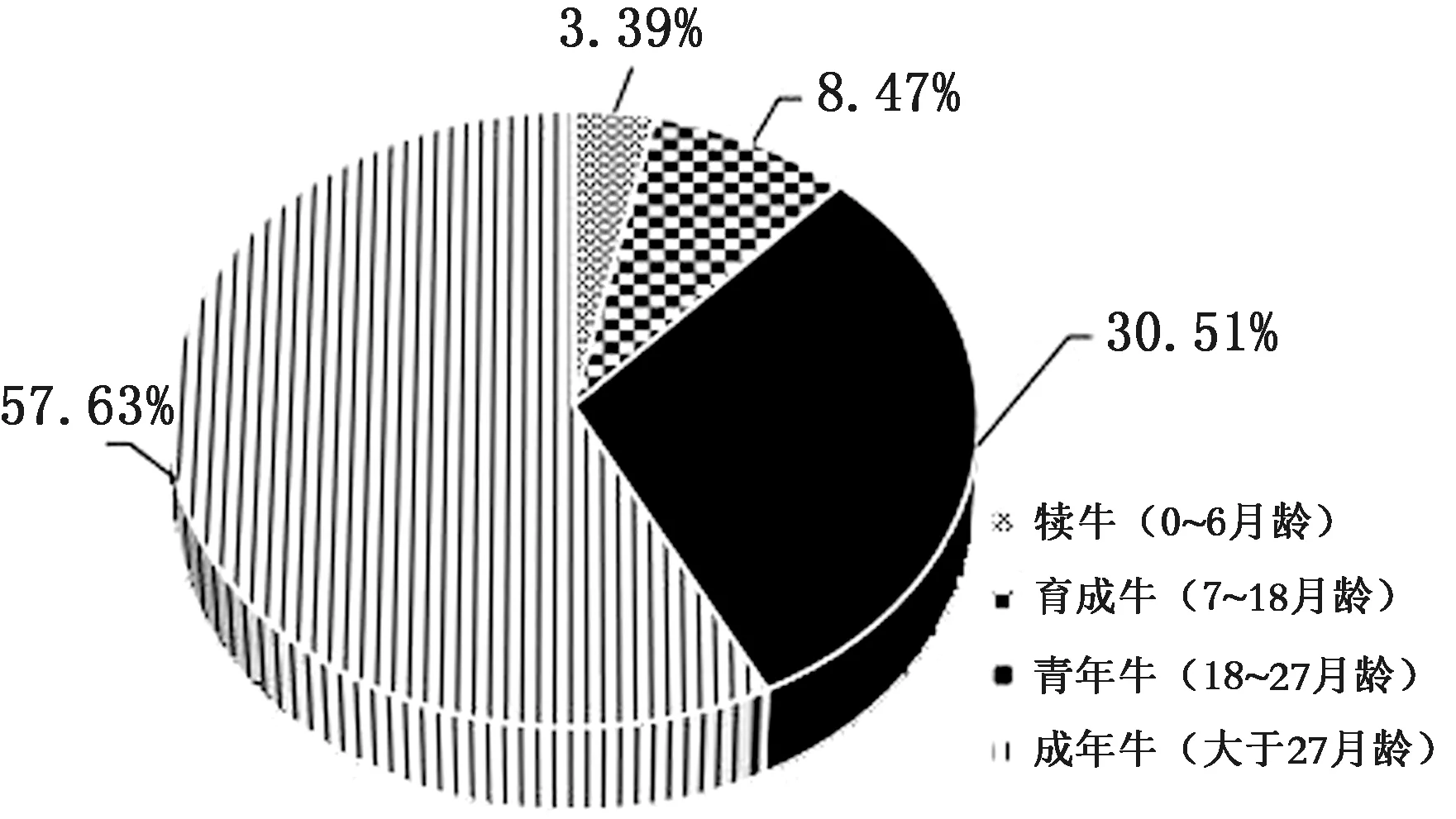
图4 吉林省不同年龄段BVDV和BEV混合感染率
2.5 BVDV与BEV感染的RT-PCR鉴定随机选取ELISA检测为阴性与阳性的样品,应用设计的BVDV与BEV特异性引物,进行RT-PCR扩增。结果PCR分别扩增出与预期大小相符的目的片段,BVDV片段大小为297 bp,BEV的片段大小为505 bp。部分代表性BVDV/BEV混合感染的样品中可同时检测出大小为297,505 bp的片段(图5)。
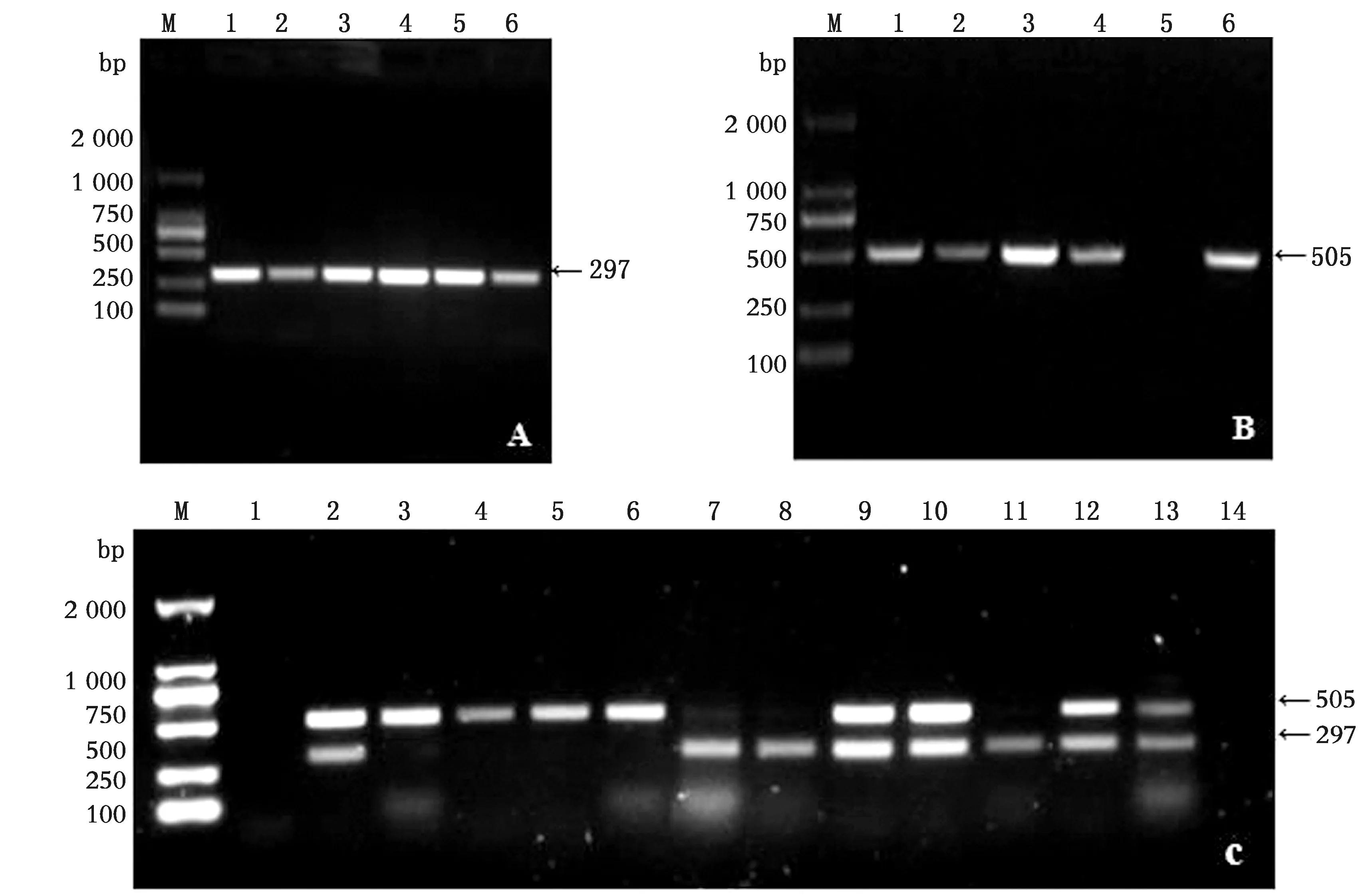
A.RT-PCR扩增BVDV结果(M.DL2000 DNA Marker;1~6.BVDV阳性样品);B.RT-PCR扩增BEV结果(M.DL2000 DNA Marker;1~4,6.BEV阳性样;5.BEV阴性样品);C.一步式RT-PCR扩增BVDV/BEV结果(M.DL2000 DNA Marker;1,14.BVDV及BEV阴性样品对照;2,7,9~10,12~13.BVDV/BEV混合感染的阳性样品;3~6.BEV阳性样品;8,11.BVDV阳性样品)图5 RT-PCR鉴定BVDV与BEV感染结果
2.6 BVDV与BEV混合感染的免疫学鉴定为验证BVDV与BEV混合感染结果,选择代表性样品接种MDBK细胞进行病毒分离,同时应用检测BVDV与BEV的IFA试验进行免疫学鉴定。结果显示,可同时从BVDV与BEV双阳性样品接种的细胞中检测到BVDV和BEV抗原信号。感染BVDV的细胞浆内呈绿色荧光,感染BEV的细胞胞浆内呈红色荧光。同时感染BVDV与BEV的细胞呈黄色荧光(图6),进一步证明吉林省牛群存在BVDV与BEV混合感染情况。

A.BVDV CC13B抗体检测结果;B.肠道病毒HY12抗体检测结果;C.DAPI染色接毒细胞核结果;D.免疫荧光确证BVDV与BEV混合感染结果图6 代表性BVDV与BEV混合感染样品接种MDBK细胞后免疫荧光鉴定结果 (×20)
3 讨论
近年来,国内临床上以腹泻为主要特征的疫病与日俱增,给养牛业造成了严重的经济损失。 BVDV与BEV作为引起牛群呈现腹泻的重要病原体,如发生混合感染可使疫病变得更加复杂,引起更为严重的疾病与经济损失。国内外学者认为BVDV或BEV感染后易与其他病原微生物发生混合感染,导致牛群死亡率增加。研究发现,牛腹泻性疾病难以根除是由于BVDV与轮状病毒、冠状病毒、大肠杆菌、沙门菌及其他病原微生物发生混合感染所致[20-21]。宋维彪等[22]对青海省海北州展开了牦牛感染BVDV、BEV的病原学调查与分析,采用RT-PCR方法对当地采集的382份粪便样品进行检测,结果发现青海北州地区的牦牛中存在较高的BVDV/BEV混合感染。陈新诺等[23]对青藏高原地区牦牛感染BVDV和BEV的情况进行了分子流行病学调查,结果显示,青海省湟中县138份腹泻牦牛粪便样品也存在较高的BVDV与BEV混合感染现象。但是,国内其他地区的牛群是否存在BVDV/BEV混合感染现象尚不清楚。
本研究采用BVDV、BEV双抗体夹心ELISA抗原试剂盒[16,19],对吉林省5个地区的样品进行检测,结果显示BVDV感染率为21.68%,BEV感染率14.23%,BVDV/BEV混合感染率为7.99%。进一步分析发现荷斯坦牛与西门塔尔牛具有较高的BVDV/BEV混合感染率(7.84%~13.04%),而延边牛、利木赞及其他牛群混合感染率为3.42%~3.65%。对不同年龄段牛的检测结果显示,犊牛、育成牛、青年牛及成年牛混合感率为3.39%~57.63%,说明随着年龄的增长,BVDV/BEV感染率逐渐升高。此外,本研究以PCR与免疫荧光试验对部分ELISA检测结果进行了鉴定,试验结果与ELISA检测结果一致。上述结果填补了吉林省BVDV/BEV混合感染的流行病学本底空白,为今后防控及净化奠定了理论基础。
流行病学调查是疫病防控的重要环节与前提。本研究检测吉林省不同地区的样品,发现不同地区、不同年龄与品种的检测结果存在差异,这可能与当地养殖场规模大小、免疫程序以及病毒本身变异及多样性有关。不同品种之间的BVDV、BEV感染情况有一定差异性,这可能是由于地区间自然地理、生物安全及饲养方式不同所致。依据本研究的调查结果,推测犊牛BVDV/BEV存在混合感染的原因可能是怀孕动物感染犊牛所致。有关成年牛BVDV/BEV混合感染率较高,一方面可能是由于动物感染BVDV后有免疫耐受现象并产生免疫抑制作用,导致感染动物的抵抗力下降,造成更易感染BEV[24];另一方面,牛群接触病原微生物的不断积累,病毒变异及多样性,使BVDV/BEV混合感染机率增加。本研究探究了吉林省牛群BVDV与BEV单一及混合感染的流行分布情况,为吉林省乃至全国牛腹泻性疫病的防控及净化提供了重要的流行病学依据。
