两种螺旋藻剂型的体外模拟消化研究
2022-07-14秦欣谭应宏徐青山陈再德骆其君
秦欣,谭应宏,徐青山,陈再德,骆其君,*
(1.宁波大学海洋学院,浙江 宁波 315211;2.云南省微藻重点实验室,云南 丽江 674100)
钝顶螺旋藻(Spirulina platensis)含有多种营养物质,是目前所知营养成分最全面、最均衡的天然食品之一,是一种高蛋白、低脂肪的高营养功能性食品,蛋白质含量高达60%~70%[1]。此外,还有抗氧化[2]、抗肿瘤[3]、降血压[4]等生物活性。因此,螺旋藻被联合国粮农组织评价为“21世纪人类最佳营养品”[5]。养殖螺旋藻采收后,经喷雾干燥加工为初级产品——干粉,干粉进一步加工为商品——螺旋藻片剂,螺旋藻片剂是目前重要的产品形式。
体外模拟消化是一种以合适的消化条件来仿生人体消化道运行的反应[6],具有成本较低、可控性高、周期短、易操作的特征。近年来,在食品安全、食品营养以及食品加工等领域得到广泛的应用[7]。林路秀等[8]应用体外消化模型分析了海藻(紫菜和海带)水煎液中的无机金属形态和生物可给性。陈再德等[9]通过构建体外模拟消化模型探究了不同温度烘烤的坛紫菜的消化效果。
目前涉及螺旋藻的研究焦点在于养殖技术及加工。螺旋藻产品在人体整个消化过程中的营养物质和功能活性的变化少有报道。杨卫杰等[10]通过模拟体外胃肠消化对比了螺旋藻营养制剂蛋白消化速率和消化程度。若通过人体试验或者相关的动物实验来探究螺旋藻的整个消化和吸收过程较为困难,而应用体外模拟消化的解决了这一难题。本文以螺旋藻粉剂和片剂为原料,构建体外模拟消化模型,比较水解、酸解、高温和高压蒸汽等方式的处理对消化的影响,从而为螺旋藻产品的消化利用及加工产品的形式提供参考。
1 材料与方法
1.1 材料与试剂
螺旋藻粉剂(BE201906-3,简称粉剂)、螺旋藻片剂(规格每片0.5 g,执行标准Q/LBE003S,简称片剂):丽江程海保尔生物开发有限公司;唾液淀粉酶(300 U~1 500 U)、胃蛋白酶(≥250 U)、胰酶(4×USP)、胆汁盐:美国 Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、领苯二甲醛、β-巯基乙醇(均为分析纯):上海麦克林生化科技有限公司;三氯乙酸(分析纯)、十二烷基硫酸钠(分析纯)、考马斯亮蓝-G250、苯酚(分析纯)、甲醇(分析纯)、盐酸(分析纯)、硼酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
1-16K低温高速冷冻离心机、Varioskan Flash酶标仪:美国Thermo Fisher Scientific公司;DHG-9123A烘箱:宁波江南仪器厂;MQT-60R摇床:上海旻泉仪器有限公司;瑞士Salvis WB20恒温水浴锅:成都华衡仪器有限公司;T3L-385B烤箱:美的集团股份有限公司。
1.3 试验方法
1.3.1 样品预处理
水解、酸解、高温及高压蒸汽处理粉剂和片剂,设置不经过以上方式处理为对照组(CK)。分别取0.5 g粉剂和0.5 g片剂以料液比1∶20(g/mL):于100℃蒸馏水煮沸处理(水解组,WJ);于100℃的0.01 mol/L HCl下酸解处理20 min(酸解组,SJ);于120℃高温处理20 min(高温组,GW);于103.4 kPa、121.3℃高压蒸汽处理20 min(高压蒸汽组,ZQ)。所有试验均设置3组平行,并避光操作。
1.3.2 体外模拟消化
配制1.29 μg/mL的唾液(pH6.80±0.05)、3.97 μg/mL胃液(pH1.20±0.05)、15 μg/mL 肠液以及 40 μg/mL 胆汁盐溶液[9,11-12]。
体外口腔消化:分别称取0.5 g经水解、酸解、高温及高压蒸汽处理后的粉剂和片剂,置于50 mL的锥形瓶中,加入12.5mL唾液(37℃预热10 min),调节pH值至 6.80±0.05,充分混合后于恒温摇床(37℃、150 r/min)消化5 min,完成后,立即置于70℃水浴5 min终止反应,样品于4℃、10 000 r/min离心10 min,上清液于-80℃下保存待测。
体外口胃连续消化:经唾液消化后的消化液用1 mol/L HCl调节其pH值至1.20±0.05,并将其转入锥形瓶中,加入15 mL胃液(37℃预热10 min),充分混合后于恒温摇床(37℃、150 r/min)消化4 h,消化完成后,样品处理同上。
体外口胃肠连续消化:经胃液消化后的消化液用1 mol/L NaOH调节其pH值至7.00±0.05,并将其转入锥形瓶中,加入37.5 mL肠液和10 mL胆汁盐,充分混合后于恒温摇床(37℃、150 r/min)消化5 h,完成后,样品处理同上。
1.3.3 营养指标物质含量测定
游离氨基酸含量参考文献[13]的方法测定;可溶性蛋白含量参考文献[14]的方法测定;可溶性糖含量参考文献[15]的方法测定;还原糖含量参考文献[16]的方法测定。
译者交互隐形与译本呈现 ………………………………………………………………… 任东升 王 芳(6.69)
1.3.4 抗氧化活性的测定
DPPH自由基清除率的测定参考文献[17]的方法,稍作修改。配制0.2mmol/L DPPH乙醇溶液,取100 μL待测样品加入到100 μL的DPPH乙醇溶液中,室温(25℃)下避光反应30 min,于517 nm波长处测定吸光度。
1.4 数据处理
采用Microsoft Excel 2010处理数据,并使用SPSS 22.0进行数据分析,Origin 2019进行绘图。
2 结果与分析
2.1 不同方式处理对螺旋藻游离氨基酸含量的影响
不同方式处理对螺旋藻游离氨基酸含量的影响见图1。
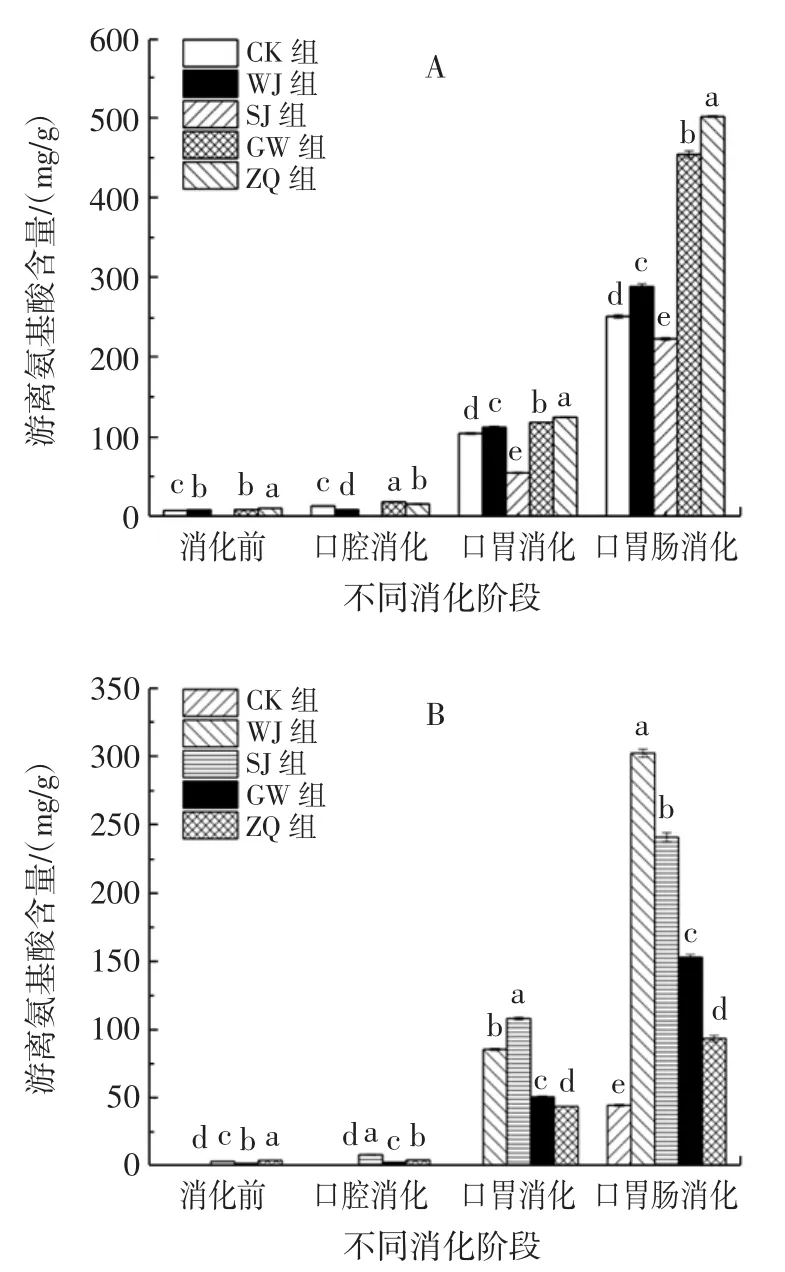
图1 体外模拟消化过程中的螺旋藻游离氨基酸含量Fig.1 Free amino acid content of Spirulina platensis in simulated digestion in vitro
由图1A可知,粉剂在消化前和口腔消化阶段的SJ组中检测不到游离氨基酸含量,可能是因为酸解处理对螺旋藻粉剂原有的游离氨基酸破坏较大,使之变成另外的形式存在,未到达检测限。粉剂在消化前,ZQ组释放游离氨基酸含量最高(10.30 mg/g),GW、WJ组含量次之,但均高于CK组。在口腔消化阶段,各处理组游离氨基酸含量较消化前增加,其中,CK组达到13.32 mg/g,GW组为CK组的1.37倍,为各处理组中最高。在口胃消化阶段,各处理组游离氨基酸含量较口腔消化阶段增加,游离氨基酸含量在54.79 mg/g~124.00mg/g,ZQ组在各处理组中含量最高(124.55mg/g),为CK组的1.20倍,GW组和WJ组含量次之,SJ组含量最低。在口胃肠消化阶段,游离氨基酸含量较口胃消化阶段增加,且各处理组含量差异显著(P<0.05),游离氨基酸含量在222.92 mg/g~501.65 mg/g。ZQ、GW组游离氨基酸含量分别达到501.65、454.22 mg/g,为CK组的2.00、1.80倍,SJ组含量最低。综上可知,粉剂在消化过程中游离氨基酸释放效果为ZQ>GW>WJ>CK>SJ,且游离氨基酸释放主要在胃肠道中。
由图1B可知,片剂的CK组在口胃连续消化阶段才检测到游离氨基酸含量,这是因为在其他消化阶段的游离氨基酸含量极低,未到达检测限。片剂在消化前,各处理组的游离氨基酸含量差异显著(P<0.05),其中,ZQ组游离氨基酸含量为各处理组中最高,SJ组和GW组含量次之。在口腔消化阶段,游离氨基酸含量有所增加,其中SJ组游离氨基酸含量达到最高,ZQ组含量次之。说明口腔消化对片剂的效果较低,可能是由于片剂处于一个未崩解的状态,以及口腔消化环境温和、消化时间较短的原因。在口胃连续消化阶段,游离氨基酸含量较口腔消化后骤增,其中SJ组游离氨基酸含量最高,WJ含量次之,而GW组和ZQ组含量较低。在口胃肠连续消化阶段,游离氨基酸含量较口胃消化后骤增,各处理组之间显著差异(P<0.05),且都高于CK组含量。WJ组含量最高(302.27 mg/g),为CK组的6.72倍,说明不同方式处理能促进片剂的消化,使其释放大量的游离氨基酸。综上,片剂消化效果为WJ>SJ>GW>ZQ>CK。
2.2 不同方式处理对螺旋藻可溶性蛋白含量的影响
不同方式处理对螺旋藻可溶性蛋白含量的影响见图2。
由图2A可知,粉剂在消化前,GW组可溶性蛋白含量与CK组含量接近,WJ组次之,而SJ组和ZQ组含量较低,远远低于CK组。说明SJ组和ZQ组处理方式对螺旋藻蛋白有抑制分解作用。在口腔消化阶段后,各处理组可溶性蛋白含量变化不大,趋势与消化前一致。在口胃消化阶段,与口腔消化阶段相比,可溶性蛋白含量整体均呈上升趋势。各处理组无显著差异(P>0.05),说明胃消化环境能够促进可溶性蛋白的释放,可能是由于胃酸性环境对螺旋藻细胞壁具有破坏作用,导致螺旋藻蛋白的析出。在口胃肠消化阶段,GW组可溶性蛋白含量达到最高(19.56 mg/g),WJ组仅次于GW组,均高于CK组。综上可知,粉剂在消化过程中可溶性蛋白量释放效果为GW>WJ>SJ>ZQ>CK。
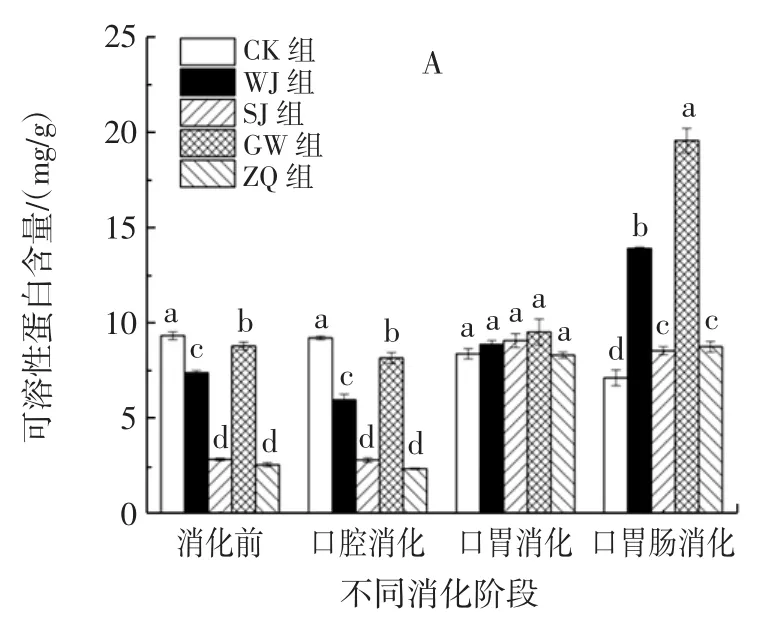

图2 体外模拟消化过程中的螺旋藻可溶性蛋白含量Fig.2 Soluble protein content of Spirulina platensis in simulated digestion in vitro
由图2B可知,片剂在口胃肠消化阶段检测不到CK组、SJ组和ZQ组的可溶性蛋白含量,这是因为以上处理组的可溶性蛋白降低至低于检测限。片剂在消化前,各处理组的片剂可溶性蛋白含量显著差异(P<0.05)。CK组为各处理组含量最高,而ZQ组和SJ组含量较低。说明经不同方式处理后对片剂蛋白具有破坏作用,高压和酸解处理对螺旋藻蛋白影响最大。在口腔消化阶段,片剂可溶性蛋白含量总体较消化前下降,变化趋势与消化前类似。在口胃消化阶段,片剂可溶性蛋白含量较口腔消化后有所增加。其中WJ组和SJ组无显著性差异(P>0.05),分别为CK组的1.90倍和1.82倍,ZQ组含量最低。在口胃肠消化阶段,WJ组含量达到14.56 mg/g,为CK组的3.10倍。SJ组和GW组含量均高于CK组,而ZQ组含量最小,说明水解处理片剂有利于螺旋藻的消化。综上,片剂可溶性蛋白释放效果在WJ处理时最好。
2.3 不同方式处理对螺旋藻可溶性糖含量的影响
不同方式处理对螺旋藻可溶性糖含量的影响见图3。
由图3A可知,粉剂在消化前,WJ组和CK组可溶性多糖含量无显著差异(P>0.05),SJ组和ZQ组含量较低,分别为CK组的29.92%和23.51%,说明酸水解和高压蒸汽处理抑制可溶性多糖含量释放。在口腔消化阶段,各处理组可溶性多糖含量增加。GW组含量与CK组无显著差异(P>0.05),ZQ组含量增加较少,仅为CK组的30.99%。在口胃连续消化阶段,各处理组可溶性糖含量增加幅度较小,其中GW组含量达到各处理组中最高,为CK组的1.27倍,ZQ组含量最低,为CK组的62.94%。说明胃部消化对促进粉剂可溶性糖的释放作用不大。在口胃肠连续消化阶段,各处理组可溶性糖含量骤增。WJ组和SJ组含量远远高于CK组,GW组含量次之,ZQ组含量最低。综上可知,粉剂在消化过程中可溶性糖释放效果为SJ>WJ>GW>CK>ZQ。
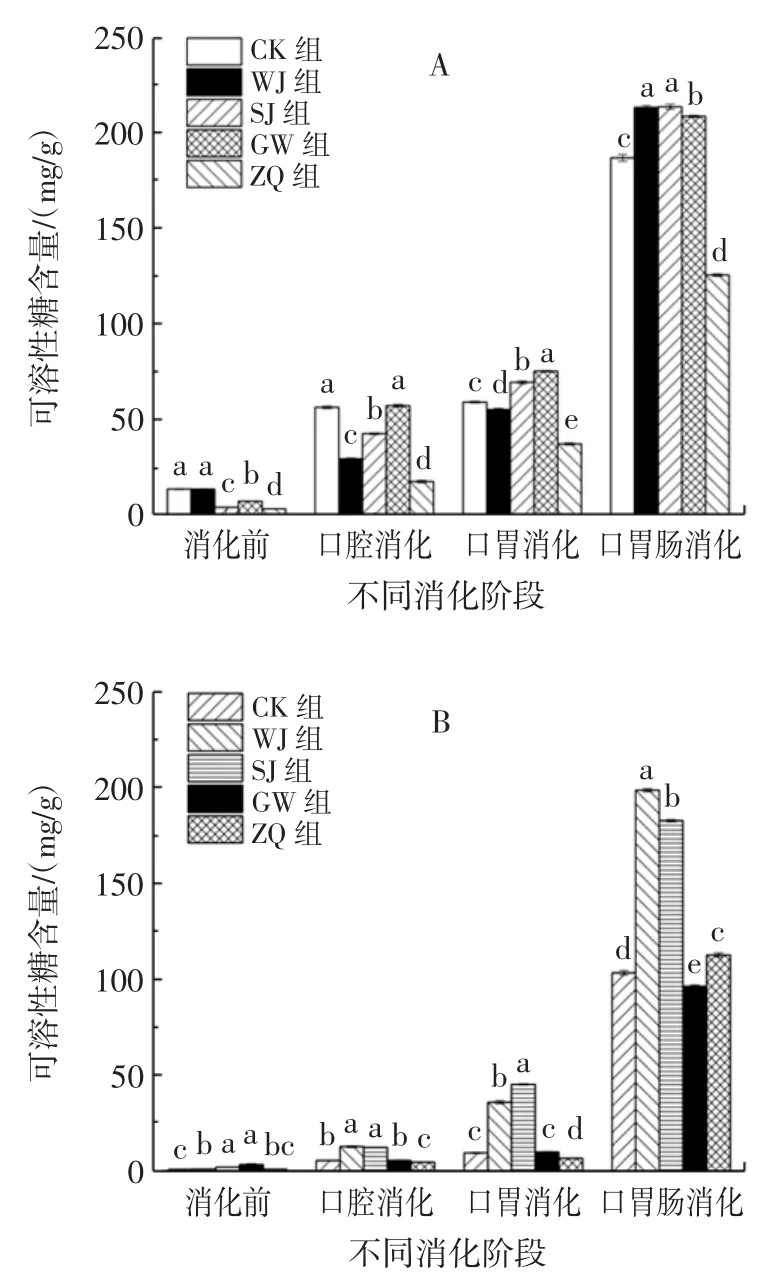
图3 体外模拟消化过程中的螺旋藻可溶性糖含量Fig.3 Soluble sugar content of Spirulina platensis in simulated digestion in vitro
由图3B可知,片剂在消化前,GW组可溶性多糖含量最高,其他处理组含量较低,说明高温处理可大大促进片剂可溶性糖的释放。在口腔消化阶段,各处理组片剂可溶性糖含量均增加,WJ组和SJ组分别为CK组的2.31倍和2.23倍,GW组与CK组无显著差异(P>0.05),ZQ组含量次之。在口胃消化阶段,各处理组可溶性糖含量较口腔消化均增加,其中SJ组含量变化最明显,为CK组的4.75倍,WJ组含量次之,ZQ组含量最低。在口胃肠消化阶段,可溶性糖含量骤增,WJ组含量达到最高(198.72 mg/g),SJ组次之。综上,片剂消化后可溶性糖释放效果为WJ>SJ>ZQ>CK>GW。
2.4 不同方式处理对螺旋藻还原糖含量的影响
不同方式处理对螺旋藻还原糖含量的影响见图4。
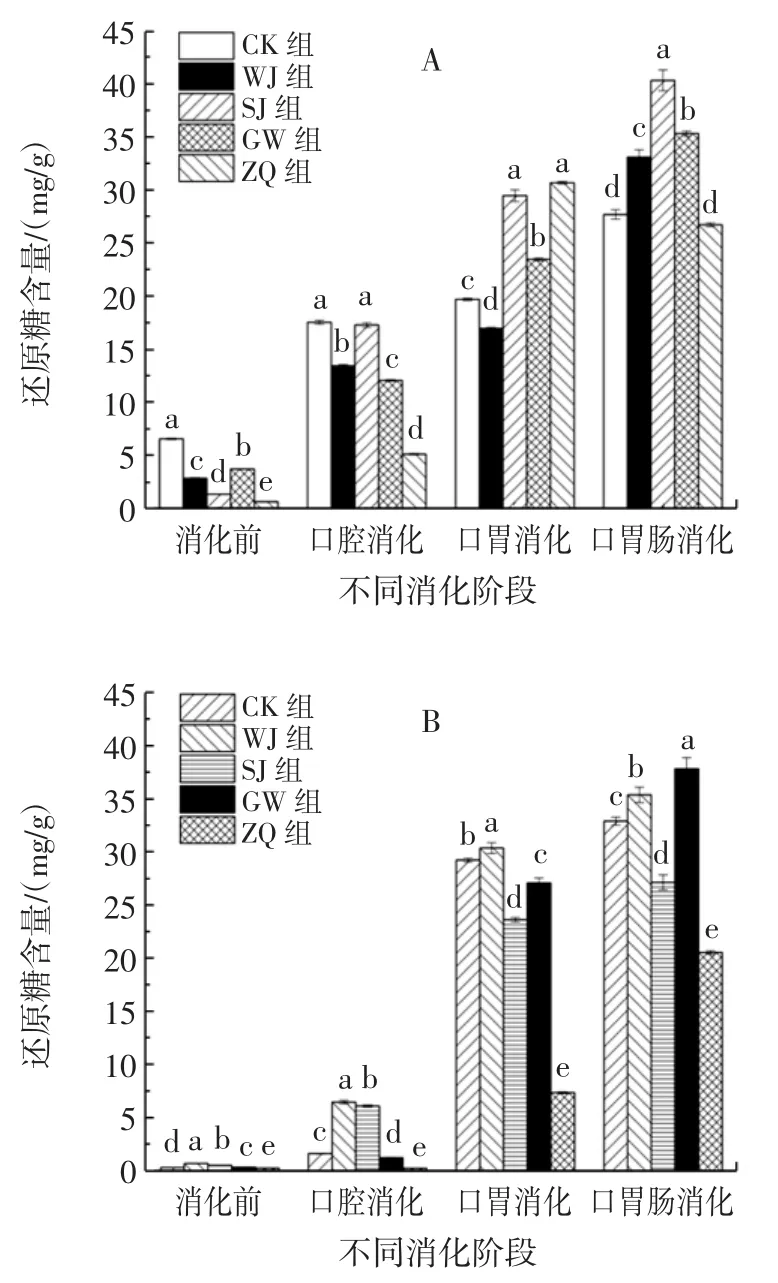
图4 体外模拟消化过程中的螺旋藻还原糖含量Fig.4 Reducing sugar content of Spirulina platensis in simulated digestion in vitro
由图4A可知,粉剂在消化前,各处理组还原糖含量显著差异(P<0.05),CK组含量最高,其他处理组含量较低,其中ZQ组含量最低。说明经不同方式处理后,粉剂的还原糖含量受到不同程度的影响。在口腔消化阶段,各处理组还原糖含量均增加,SJ组和CK组无显著差异(P>0.05),WJ组和GW组含量均低于CK组,ZQ组含量最低(5.12 mg/g)。在口胃消化阶段,还原糖含量较口腔消化后均增加,其中ZQ组含量为各处理组中最高,为CK组的1.56倍,SJ组含量次之。在口胃肠消化阶段,粉剂的还原糖含量较口胃消化后增加,此时,SJ组含量最高,GW、WJ组含量次之,ZQ组含量与CK组无显著差异(P>0.05)。综上可知,粉剂消化过程中还原糖释放效果为SJ>GW>WJ>CK>ZQ。
由图4B可知,片剂在消化前,各处理组还原糖含量较低,并显著差异(P<0.05),WJ组为CK组的2.22倍,为各处理组中含量最高。在口腔消化阶段,还原糖含量较消化前均增加,WJ组增加幅度最大,为CK组的4.01倍,SJ组含量次之,为CK组的3.78倍,ZQ组含量变化不大。在口胃消化阶段,各处理组还原糖含量均增加,CK组、GW组增长幅度较大,仅次于WJ组,但ZQ组含量增加不明显,为各处理组中最低。在口胃肠消化阶段,还原糖含量较口胃消化后均增加,GW组、WJ组均高于CK组,ZQ组仍为各组中最低,说明高温和水解对片剂消化释放还原糖有促进作用,而高压蒸汽处理并不利于片剂的消化。综上片剂消化过程中还原糖释放效果为GW>WJ>CK>SJ>ZQ。
2.5 不同方式处理对螺旋藻DPPH自由基清除率的影响
在抗氧化机制中,DPPH自由基清除率是一个重要的指标。不同方式处理对螺旋藻DPPH自由基清除率的影响见图5。

图5 体外模拟消化过程中的螺旋藻DPPH自由基清除率Fig.5 DPPH-scavenging rate of Spirulina platensis in simulated digestion in vitro
由图5A可知,粉剂在消化前,各处理组的DPPH自由基清除率差异明显,CK组的DPPH自由基清除率达到51.60%,SJ组和GW组无显著性差异(P>0.05),但均低于CK组,ZQ组DPPH自由基清除率最低。在口腔消化阶段,整个处理组对DPPH自由基清除效果变化不大,CK组DPPH自由基清除率为各处理组中最大。在口胃消化阶段,各处理组的DPPH自由基清除率均升高,CK组DPPH自由基清除率达到62.35%,此时,SJ组仅次于CK组,达到58.00%,其他各处理组之间无显著差异(P>0.05)。在口胃肠消化阶段,较口胃消化后的DPPH自由基清除率均上升,此时DPPH自由基清除率在63.19%~71.59%,SJ组的清除率最高。
由图5B可知,片剂在消化前,各处理组间差异不明显(P>0.05),DPPH自由基清除率在8.65%~14.42%之间。在口腔消化阶段,DPPH自由基清除率较消化前增加,此时SJ组的抗氧化效果达到最大(23.79%),高于CK处理组,WJ组与CK组无显著差异(P>0.05),而ZQ组DPPH自由基清除率却只有9.21%。在口胃消化阶段,DPPH自由基清除率较口腔消化阶段骤增,此时WJ组由17.54%增长到了50.20%,SJ组清除DPPH自由基效果次之,远高于CK组。在口胃肠消化阶段,各处理组的DPPH自由基清除率继续上升,各处理组的变化趋势与口胃消化后一致,WJ组相较于口胃消化阶段的增幅为42.27%,远远高于CK组(66.11%),为各处理组中最高。因此,研究结果表明,水解处理后的片剂更易于消化。
3 讨论与结论
3.1 不同处理方式对螺旋藻营养物质含量的影响
消化前,不同试验条件处理的粉剂和片剂的蛋白质含量都比对照组低,而游离氨基酸含量却较对照组高,尤其是SJ组和ZQ组的蛋白质含量更低,因为酸解和高压蒸汽处理破坏了蛋白质的空间立体结构,使其发生了变性[18]。在口胃连续消化阶段,ZQ组和GW组的粉剂游离氨基酸含量较高,而SJ组和WJ组的片剂游离氨基酸较高。这可能是在胃酸环境和胃蛋白酶作用下,经以上方式处理的粉剂和片剂可溶性蛋白暴露出胃蛋白酶酶解所需的酶切位点,破坏了蛋白质的三级结构,降低了蛋白质分子量,从而产生了多肽和游离氨基酸[19-20]。在口胃肠连续消化阶段,不同试验条件下的蛋白质含量和游离氨基酸含量骤增,ZQ组和GW组的粉剂游离氨基酸含量较高,WJ组的片剂游离氨基酸释放效果较好。主要是在胃酸和胃蛋白酶的消化下,经以上方式处理的粉剂和片剂暴露出了大部分的胰酶的酶切位点[21],同时肠道微碱pH值环境使存在的胰酶抑制剂失活,更多小分子多肽被降解。
消化前,WJ组的粉剂和GW组的片剂可溶性糖的释放效果较好,但还原糖含量较低,且片剂的可溶性糖和还原糖含量远远低于粉剂,可能是由于片剂的处于挤压状态,且大量的螺旋藻分子被包埋。在口腔消化阶段,不同试验条件下的粉剂和片剂可溶性糖增加,但还原糖增加量不明显,说明口腔消化环境基本不会降解可溶性糖分子量,因为唾液淀粉酶只能水解淀粉和部分碳水化合物α(1→4)的糖苷键[22],而对绝大部分碳水化合物并不消化。在口胃连续消化阶段,不同试验条件下的粉剂和片剂可溶性多糖和还原糖含量增加,其中GW组和SJ组的粉剂以及WJ和SJ组的片剂可溶性糖和还原糖含量较高。主要是因为胃液中超低的pH值环境,造成了螺旋藻细胞壁的破坏,释放出较多可溶性糖,而还原糖含量的骤增也是因为酸性环境导致可溶性糖的相对分子量降低,导致大分子糖类的糖苷键断裂和还原末端形成[23]。在口胃肠连续消化阶段,各试验条件下的粉剂和片剂可溶性糖骤增,但还原糖含量的变化不大。闵芳芳等[24]认为主要是多糖在肠道环境中的絮状沉淀消失,导致多糖易发生聚集。
3.2 不同处理方式对螺旋藻抗氧化活性的影响
抗氧化体系具有多种检测方式,DPPH自由基清除率测定是最常用的一种。在口腔消化阶段,粉剂和片剂的抗氧化活性未发生很大变化。在口胃连续消化阶段,各处理组的粉剂和片剂DPPH自由基清除率较口腔消化阶段增加,其中SJ组的DPPH自由基清除率最高。主要原因可能是胃液酸性环境和胃蛋白酶导致多酚黄酮类物质与蛋白质氨基酸残基或氨基、巯基形成的共价键或非共价键断裂,使多酚和黄酮类物质转换成游离态,还有蛋白质的二级和三级结构遭到破坏,共价键发生断裂,降解形成具有抗氧化活性的小分子多肽,以及胃消化阶段可溶性糖的大量释放促进了整个抗氧化系统的升高[25-27]。在口胃肠消化阶段,各处理组的粉剂和片剂DPPH自由基清除能力继续增强。虽然肠道环境中pH值升高会导致部分多酚的结构发生改变,部分多酚氧化成醌类物质[28],但粉剂和片剂的可溶性糖含量在肠消化后骤增,这导致了肠消化的整个抗氧化活性的增强。
本研究探讨了不同方式处理后的螺旋藻粉剂和片剂的整个体外模拟消化过程,结果表明,经口胃肠连续消化后,高压蒸汽处理的粉剂游离氨基酸释放效果最好,高温处理的粉剂可溶性蛋白释放效果最佳,酸解和高温处理后的粉剂可溶性糖和还原糖释放效果较好,水解处理的片剂游离氨基酸、可溶性蛋白、可溶性多糖释放较好;螺旋藻的游离氨基酸主要在胃、肠消化后释放,可溶性多糖主要在肠消化后释放;酸解处理的粉剂抗氧化效果较好,而水解处理的片剂抗氧化效果较好,且在口胃肠连续消化后螺旋藻抗氧化效果发挥最佳。本研究对螺旋藻的生产加工具有指导性意义。
