云南不同地理种群草地贪夜蛾肠道可培养细菌多样性分析
2022-07-14李永萍杜广祖狄藤孔德鸿杨航杨进波易小光张庭发陈斌
李永萍 杜广祖 狄藤 孔德鸿 杨航 杨进波 易小光 张庭发 陈斌






摘要:【目的】明確云南不同地理种群草地贪夜蛾幼虫肠道可培养细菌群落组成及种群间的差异,为草地贪夜蛾肠道细菌多样性及其生物学功能研究提供科学依据,并为解析草地贪夜蛾的环境适应机理打下基础。【方法】采用分离培养法对云南省普洱市澜沧、保山市隆阳、昆明市石林、红河州开远4个不同地理种群的草地贪夜蛾幼虫肠道细菌进行分离培养,结合形态学及16S rDNA测序方法进行细菌种类鉴定。【结果】从云南4个地理种群草地贪夜蛾幼虫肠道中共分离获得27株形态、颜色和大小各异的细菌菌株,27株细菌菌株分属4门9科12属19种,优势菌门为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),优势菌属为厚壁菌门肠球菌属(Enterococcus)。其中,澜沧、石林、开远和保山种群分别分离到3门4科6属8种共9株细菌、3门5科6属6种共6株细菌、2门3科4属5种共5株细菌和3门6科6属6种共7株细菌;4个地理种群草地贪夜蛾幼虫肠道内均存在肠球菌属和克雷伯氏菌属(Klebsiella)细菌;4个地理种群草地贪夜蛾幼虫肠道细菌的丰富度指数、Shannon指数、Simpson指数和均匀度指数分别为0.705~1.277、0.969~1.381、0.615~0.635及0.602~0.753。【结论】云南4个不同地理种群草地贪夜蛾幼虫肠道内可培养细菌较丰富,不同地理种群肠道细菌多样性存在差异,但优势菌均为厚壁菌门的肠球菌属细菌,肠球菌属细菌对草地贪夜蛾肠道细菌群落起着决定作用。
关键词: 草地贪夜蛾;地理种群;肠道可培养细菌;多样性;云南
中图分类号: S433.4 文献标志码: A 文章编号:2095-1191(2022)04-1066-12
Diversity analysis of cultivable intestinal bacteria in different
geographic populations of Spodoptera frugiperda(J. E. Smith)
LI Yong-ping1, DU Guang-zu1, DI Teng1, KONG De-hong1, YANG Hang2,
YANG Jin-bo2, YI Xiao-guang2, ZHANG Ting-fa2, CHEN Bin1*
(1Plant Protection College, Yunnan Agricultural University/Yunnan State Key Laboratory for Conservation and Utilization of Bioresources, Kunming, Yunnan 650201, China; 2Yunnan Green Biotechnology Science and Technology
Co. Ltd, Dali, Yunnan 675600, China)
Abstract:【Objective】To clarify the differences between cultivable bacterial communities and populations in the intestinal of Spodoptera frugiperda larvae in different geographical populations in Yunnan,so as to provide theoretical basis for the intestinal bacterial diversity and biological function of S. frugiperda and lay a foundation for the analysis of the environmental adaptation mechanism of S. frugiperda. 【Method】Cultivable bacteria in the intestinal of S. frugiperda from four geographical populations, namely, Lancang in Pu’er city, Longyang in Baoshan City, Shilin in Kunming City, and Kaiyuan in Honghe City of Yunnan were isolated and cultured, and the species of bacteria were identified using the morphological and 16S rDNA sequence. 【Result】From the intestines of larval S. frugiperda from four geographical populations in Yunnan, a total of 27 bacterial strains of different shapes, colors and sizes were isolated, and 27 bacterial strains belonged to 4 phyla, 9 families, 12 genera and 19 species. Predominant phyla were Proteobacteria and Firmicutes and the predominant genera was Enterococcus. Among them, the Lancang populations were isolated to 9 bacteria form 8 species, 3 phyla, 4 families, 6 genera; the Shilin populations were isolated to 6 bacteria form 3 phyla, 5 families, 6 genera and 6 species; the Kaiyuan populations were isolated to 5 bacteria form 2 phyla, 3 families, 4 genera and 5 species; and the Baoshan populations were isolated to 7 bacteria form 3 phyla, 6 families, 6 genera and 6 species. Enterococcus and Klebsiella from four populations were the common genera. Richness, Shannon, Simpson and pielou evenness indices of four populations were 0.705-1.277,0.969-1.381,0.615-0.635 and 0.602-0.753, respectively. 【Conclusion】Cultivable bacteria of S. frugiperda larvae in four different geographical populations in Yunnan are rich, and there are differences in the diversity of intestinal bacteria in different geographical populations. But the dominant bacteria are Enterococcus, and Enterococcus bacteria play a decisive role in the intestinal bacterial community of S. frugiperda.
Key words: Spodoptera frugiperda; geographic populations; cultivable intestinal bacteria; diversity; Yunnan
Foundation items: National Natural Science Foundation of China (32060616); National Key Research and Development Program of China (2019YFD0300105)
0 引言
【研究意义】草地贪夜蛾[Spodoptera frugiperda(J. E. Smith)]又名行军虫、秋黏虫,隶属于鳞翅目(Lepidoptera)夜蛾科(Noctuidae)灰翅夜蛾属(Spodoptera)(Todd and Poole,1980)。该虫原产于美洲热带和亚热带地区(Goergen et al.,2016),由于其具有寄主范围广、繁殖速度快、迁飞能力强等特点(王磊等,2019),蔓延至整个非洲大陆,随后入侵亚洲(Jing et al.,2020),并于2019年入侵我国云南省普洱江城县(杨学礼等,2019),之后迅速向全国扩散(姜玉英等,2019)。草地贪夜蛾主要嗜食禾本科作物,现已成为我国玉米上重大危害性害虫(吴孔明,2020)。草地贪夜蛾不同地理种群的抗药性、生物学特性等存在明显差异(江南紀和王琛柱,2019;唐运林等,2019;尹艳琼等,2019;苏湘宁等,2020),研究云南省草地贪夜蛾不同地理种群肠道细菌组成及多样性差异,可为解析草地贪夜蛾不同地理种群抗药性等生物学差异机理及调控肠道菌群防治该虫提供理论依据。【前人研究进展】昆虫肠道内存在着丰富的微生物,其中90%为细菌(Egert et al.,2003),这些微生物影响宿主的代谢活动并参与宿主免疫活动(Lin et al.,2015;陈勃生等,2017;周帆等,2020)。已有研究表明,昆虫的品系(刘芷涵等,2020)、发育阶段(Yun et al.,2014)、健康状况(Sun et al.,2016)、性别(Nagalakshmi et a1.,2017)、食物(Strano et a1.,2018)、寄主(Chen et al.,2018)和地理环境(Paramasiva et a1.,2014)等均会影响昆虫肠道细菌的种类组成。昆虫迁入新的环境后,由于气候、食物、温度等因素的不同可能会产生地理种群差异,Koch等(2013)通过分析蜜蜂肠道细菌16S rRNA序列发现,不同地理种群的蜜蜂肠道菌群组成存在差异,猜测地理距离可能影响昆虫肠道菌群的组成;刘小改(2017)对稻纵卷叶螟[Cnaphalocrocis medinalis (Guenée)]肠道微生物16S rDNA V4~V5区扩增测序发现,不同地理种群稻纵卷叶螟的肠道微生物丰富度与多样性存在显著差异,但所有地理种群中厚壁菌门(Firmicutes)的肠球菌属(Enterococcus)占绝对优势;研究发现10个地理种群暗黑鳃金龟(Holotrichia parallela)后肠微生物多样性和群落结构差异较大,可能与土壤pH、有机碳含量、总氮含量、地理气候和年平均温度等因素有关(Huang and Zhang,2017);王争艳等(2020)通过高通量测序发现不同地理种群的赤拟谷盗[Tribo-lium castaneum (Herbst)]成虫肠道菌群组成存在显著差异,但优势菌群均来自于变形菌门(Proteobacteria)。对于草地贪夜蛾肠道微生物的研究,Almeida等(2017)通过分离培养法发现,对不同杀虫剂具有抗药性的草地贪夜蛾幼虫肠道内优势菌群主要来自肠球菌属和勒克氏菌属(Leclercia);李青晏等(2020)采用分离培养法发现,云南蒙自草地贪夜蛾幼虫和成虫的肠道中优势菌群分别来自克雷伯氏菌属(Klebsiella)和不动杆菌属(Acinetobacter);徐天梅等(2020)对草地贪夜蛾肠道细菌16S rDNA V3~V4可变区测序发现,云南省草地贪夜蛾首发地种群肠道内细菌群落组成及多样性高于扩散区种群;张志红等(2020)发现云南芒市地区草地贪夜蛾肠道内优势菌株变栖克雷伯氏菌(K. variicola)对青霉素、红霉素和氨苄西林表现出强耐药性;Gichuhi等(2020)对肯尼亚4个玉米种植区的草地贪夜蛾肠道细菌16S rRNA的V4区域进行高通量测序,结果发现草地贪夜蛾肠道内优势菌群主要来自假单胞菌属(Pseudomonas)、柠檬酸杆菌属(Citrobacter)、赖氨酸芽胞杆菌属(Lysinibacillus)和肠球菌属。现有研究发现,草地贪夜蛾肠道内细菌组成种类丰富,其中肠杆菌属(Enterobacter)、肠球菌属、芽胞杆菌属(Bacillus)和克雷伯氏菌属等细菌是草地贪夜蛾肠道内较常见的细菌种类(Acevedo et al.,2017;Almeida et al.,2017;李青晏等,2020;徐天梅等,2020;张志红等,2020)。【本研究切入点】云南省地处我国西南,地理环境复杂,气候多样,草地贪夜蛾入侵进入云南并已在云南省不同地区成功定殖、发生危害,而在不同的地理和气候环境条件下,其肠道内生细菌组成是否也随着分布区地理、气候环境的差异而存在差异,这些肠道内生菌组成的差异是否也是草地贪夜蛾适应不同地理条件所引起的结果尚不明确。此外,宏基因组学测序技术是昆虫肠道内生菌多样性及功能预测的重要措施,然而该方法不能得到一些重要生理功能的内生菌菌株,因而不能满足内生菌的生物学功能研究。【拟解决的关键问题】采用分离培养法对云南4个不同地理种群的草地贪夜蛾幼虫肠道细菌进行分离培养,结合形态学及16S rDNA测序方法进行细菌种类鉴定,明确不同地理种群草地贪夜蛾肠道可培养细菌群落组成及种群间的差异,以期为深入研究草地贪夜蛾肠道内生菌多样性及其生物学功能研究提供依据,并为解析草地贪夜蛾的环境适应机理打下基础。
1 材料与方法
1. 1 试验材料
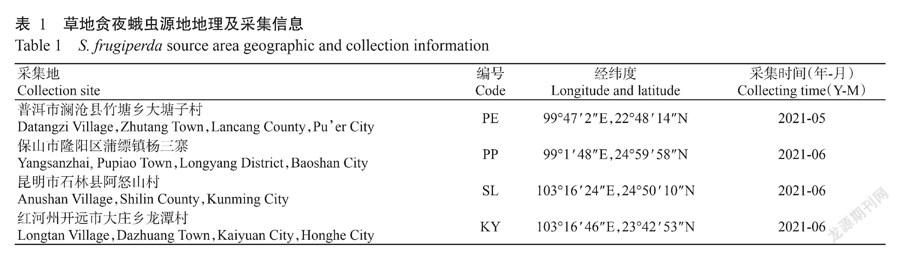
1. 1. 1 供试虫源 2021年从云南省普洱市澜沧县竹塘乡大塘子村、保山市隆阳区潽缥镇杨三寨、昆明市石林县阿怒山村和红河州开远市大庄乡龙潭村玉米地采集健康4龄草地贪夜蛾幼虫各30头,每10头为1个处理,重复3次。虫源采集信息见表1。
1. 1. 2 培养基 LB培养基:氯化钠10 g,酵母浸粉5 g,胰蛋白胨10 g,琼脂20 g,无菌水1000 mL,pH 7.0(耿海荣等,2019);牛肉膏蛋白胨培养基(NA):氯化钠5 g,牛肉膏5 g,蛋白胨10 g,琼脂20 g,无菌水1000 mL,pH 7.4~7.6(戴航宇等,2020)。
1. 2 试验方法
1. 2. 1 草地贪夜蛾肠道细菌的分离及纯化 将采集的草地贪夜蛾幼虫于室内无菌培养皿中饥饿处理24 h后进行解剖,镊子夹取试虫在无菌水中漂洗1 min,再于75%乙醇溶液中消毒2 min,然后用无菌水清洗表面的酒精,在超净工作台上解剖。将解剖出的草地贪夜蛾肠道内容物置于装有0.85%生理盐水的无菌离心管中,研磨成匀浆状,继续加入生理盐水定容至1 mL,充分振荡。12000 r/min离心2 min使杂质沉淀,取上清液作为肠道原液。取100 μL肠道原液与900 μL生理盐水混合,稀释为原浓度的10-1,按此方法依次稀释出原浓度的10-1~10-4,移取100 μL菌液均匀涂布于LB和NA固体培养基,各重复3次(徐天梅等,2021)。把涂布好的培养基置于(27±1)℃恒温条件下培养48 h后挑选出大小、颜色、质地和形态各异的单菌落,在新的LB培养基上多次划线培养,直到获得纯菌株并附标签。对纯化后的菌株进行革兰氏染色观察。
根据公式计算每种菌株的相对丰度:相对丰度(%)=某种菌菌落数/总菌落数×100(张凌英等,2020)。
1. 2. 2 可培养细菌菌株分子鉴定 采用冻融法提取细菌基因组DNA(冯广达等,2013),以细菌16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTC AG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系25.0 μL:上、下游引物各1.0 μL、DNA模板1.0 μL、PCR Mix 12.5 μL、ddH2O 9.5 μL。扩增程序:94 ℃预变性5 min;94 ℃ 1 min,53 ℃ 50 s,72 ℃ 2 min,进行32个循环;72 ℃延伸10 min。取2.0 μL PCR产物用于1%琼脂糖凝胶电泳检测,将PCR产物送至生工生物工程(上海)股份有限公司进行测序。拼接和校对测序所得16S rDNA序列,将序列上传至NCBI,与GenBank数据库已知序列进行比对,下载与原序列相似度最高的同源序列,将下载的序列通过MEGA 7.0,采用邻接法(Neighbour-joining,NJ)和Kimura双参数矫正模型构建系统发育进化树,各分支的Bootstrap置信度用1000次自导复制评价系统发育进化树的稳定性(郑亚强等,2017)。
1. 2. 3 草地贪夜蛾肠道细菌群落多样性比较 运用DPS 9.01计算草地贪夜蛾肠道细菌群落的多样性指数,包括物种丰富度指数、Shannon指数、Simpson指数和Pielou均匀度指数(戚珊珊等,2017)。
2 结果与分析
2. 1 草地贪夜蛾幼虫肠道可培养细菌的形态学特征
采用LB和NA培养基从云南4个地理种群的草地贪夜蛾幼虫肠道中共分离获得27株形态、颜色和大小各異的细菌菌株。菌落形态多为圆形,有2株为不规则状;从颜色看,有白色、明黄色、浅黄色、柠黄色和橙色;从细菌形态看,有9株为球状、7株为短杆状、11株为杆状。革兰氏染色结果表明,有12株菌呈阳性,15株菌呈阴性。详细培养性状见表2。
2. 2 细菌基因序列比对结果及系统发育分析结果
2. 2. 1 草地贪夜蛾幼虫肠道可培养细菌基因序列比对结果 通过与NCBI数据库比对,云南4个地理种群草地贪夜蛾幼虫肠道中可培养细菌有4门9科12属19种。4个地理种群肠道可培养细菌类群组成存在差异。
澜沧草地贪夜蛾种群幼虫肠道可培养细菌9株(表3),分属于3门4科6属8种,其中变形菌门包括柄杆菌科(Caulobacteraceae)短波单胞菌属(Brevundimonas)的泡囊短波单胞菌(B. vesicularis )1株;肠杆菌科(Enterobacteriaceae)肠杆菌属的路德维希肠杆菌(E. ludwigii)1株和阿氏肠杆菌(E. asburiae)1株,克雷伯氏菌属的变栖克雷伯菌1株,勒克氏菌属的非脱羧勒克氏菌(L. adecarboxylata)2株。厚壁菌门包括肠球菌科(Enterococcaceae)肠球菌属的鹑鸡肠球菌(E. gallinarum)1株和蒙氏肠球菌(E. mundtii)1株。放线菌门(Actinobacteria)有微球菌科(Micrococcaceae)考克氏菌属(Kocuria)的极考克氏菌(K. polaris)1株。
石林草地贪夜蛾种群幼虫肠道可培养细菌6株(表3),分属于3门5科6属6种,变形菌门包括肠杆菌科克雷伯氏菌属的K. michiganensis 1株和肠杆菌属的阿氏肠杆菌1株;欧文氏菌科(Erwiniaceae)泛菌属(Pantoea)的成团泛菌(P. agglomerans)1株。厚壁菌门肠球菌科肠球菌属的铅黄肠球菌(E. casseliflavus)1株,芽胞杆菌科(Bacillaceae)芽胞杆菌属的高山芽胞杆菌(B. altitudinis)1株。拟杆菌门(Bacteroidetes)鞘氨醇杆菌科(Sphingobacteriaceae)鞘氨醇杆菌属(Sphingobacterium)的鞘氨醇杆菌(Sphingobacterium sp.)1株。
开远种群草地贪夜蛾幼虫肠道可培养细菌5株(表3),分属于2门3科4属5种,变形菌门包括柄杆菌科短波单胞菌属的短波单胞菌(Brevundimonas sp.)1株;肠杆菌科克雷伯氏菌属的变栖克雷伯菌1株,肠杆菌属的路德维希肠杆菌1株和肠杆菌(Enterobacter sp.)1株。厚壁菌门为肠球菌科肠球菌属的蒙氏肠球菌1株。
保山种群草地贪夜蛾幼虫肠道可培养细菌7株(表3),分属于3门6科6属6种,变形菌门包括假单胞菌科(Pseudomonadaceae)假单胞菌属的假单胞菌(Pseudomonas sp.)1株,莫拉菌科(Moraxellaceae)不动杆菌属的不动杆菌(A. soli)1株,肠杆菌科克雷伯氏菌属的变栖克雷伯菌1株。厚壁菌门包括肠球菌科肠球菌属的蒙氏肠球菌2株,芽胞杆菌科芽胞杆菌属的枯草芽胞杆菌(B. subtilis)1株。放线菌门为微球菌科谷氨酸棒杆菌属(Glutamicibacter)的烟草谷氨酸棒杆菌(G. nicotianae)1株。
从细菌种类组成来看,云南省澜沧、保山、开远和石林4个地理种群草地贪夜蛾幼虫肠道内均能分离到肠球菌属和克雷伯氏菌属细菌,除石林种群外,澜沧、保山和开远种群均能分离到蒙氏肠球菌和变栖克雷伯菌。
2. 2. 2 草地贪夜蛾幼虫肠道可培养细菌系统发育分析 图1显示,4个地理种群草地贪夜蛾幼虫肠道分离到的27株细菌共分为5大支9小支。第1大支为变形菌门的肠杆菌属、克雷伯氏菌属、勒克氏菌属、不动杆菌属、泛菌属和假单胞菌属细菌,其中PEA-4、KYAB-2、KYB-3、PEB-7、SLB-5、SLAB-1、PEB-6、PEA-5、PEAB-2、KYAB-1和PP6B-4与模式菌株E. asburiae、Enterobacter sp.、E. ludwigii、K. michiganensis、K. variicola和Leclercia adecarboxylata聚为一类,表明这11株菌亲缘关系较近;SLAB-3与模式菌株P. agglomerans单独聚为一小支;PP6AB-2与模式菌株Pseudomonas sp.单独聚为一小支;PP6B-3与模式菌株A. soli单独聚为一小支。第2大支为变形菌门短波单胞菌属的2株菌株,PEAB-8和KYB-5与模式菌株B. vesicularis及Brevundimonas sp.聚为一类,说明这2株菌亲缘关系较近。第3大支为放线菌门的2株菌株,其中PEAB-1与模式菌株K. polaris聚在一起,PP6B-7与模式菌株G. nicotianae聚在一起。第4大支为厚壁菌门的菌株,其中,SLB-6与模式菌株B. altitudinis聚在一起,PP6A-6与模式菌株B. subtilis聚在一起,这2株菌又聚为一小支,表明这2株菌的亲缘关系较近;PEAB-3、SLAB-2、PP6AB-5、PEAB-9、KYB-4和PP6AB-1与肠球菌属的模式菌株E. casseliflavus、E. gallinarum及E. mundtii聚为一小支,说明这6株菌的亲缘关系较近。第5大支为拟杆菌门的菌株,SLB-4与模式菌株Sphingobacterium sp.聚为一支。
2. 3 草地贪夜蛾幼虫肠道可培养细菌组成分析结果
表4结果显示,4个地理种群的草地贪夜蛾幼虫肠道中分离到变形菌门、厚壁菌门、拟杆菌门和放线菌门共4个门细菌,其中澜沧种群3个门的丰度依次为厚壁菌门(65.8%)>变形菌门(29.1%)>放线菌门(5.2%);石林种群3个门的丰度依次为厚壁菌门(5.4%)>变形菌门(41.3%)>拟杆菌门(5.3%);开远种群2个门的丰度依次为变形菌门(51.2%)>厚壁菌门(48.8%);保山种群3个门的丰度依次为厚壁菌门(72.4%)>变形菌门(26.3%)>放线菌门(1.3%)。厚壁菌门是澜沧、石林和保山3个地理种群的优势菌门,开远种群优势菌门为变形菌门,其中保山种群厚壁菌门的相对丰度显著高于其他3个种群(P<0.05,下同),开远种群变形菌门的相对丰度显著高于其他3个种群。由此看出,4个地理种群的草地贪夜蛾幼虫肠道内均能分离到厚壁菌门和变形菌门,且不同地理种群优势菌门的相对丰度差异显著。
表5结果显示,草地贪夜蛾不同地理种群幼虫肠道内可培养细菌属水平上组成及丰度存在差异,其中澜沧种群的6个属细菌丰度依次为肠球菌属(62.1%)>克雷伯氏菌属(11.5%)>勒克氏菌属(8.3%)>肠杆菌属(6.4%)>短波单胞菌属(5.8%)=考克氏菌属(5.8%);石林种群6个属的细菌丰度依次为肠球菌属(50.8%)>克雷伯氏菌属(29.6%)>泛菌属(8.6%)>鞘氨醇杆菌属(5.3%)>肠杆菌属(3.1%)>芽胞杆菌属(2.6%);开远种群的4个属细菌丰度依次为肠球菌属(48.8%)>克雷伯氏菌属(31.7%)>肠杆菌属(15.7%)>短波单胞菌属(3.9%);保山种群的6个属细菌丰度依次为肠球菌属(70.0%)>不动杆菌属(15.0%)>克雷伯氏菌属(8.8%)>假单胞菌属(2.5%)>芽胞杆菌属(2.4%)>谷氨酸棒杆菌属(1.3%)。综合以上结果,草地贪夜蛾4个地理种群幼虫肠道内的优势菌均为肠球菌属,相对丰度均显著高于同种群其他属细菌,而保山种群的肠球菌属相对丰度显著高于其他3个种群;开远种群肠杆菌属丰度显著高于澜沧和石林种群,而保山种群中未分离到肠杆菌属;石林和开远种群克雷伯氏菌属相对丰度显著高于澜沧和保山种群。综上结果表明,肠球菌属和克雷伯氏菌屬是草地贪夜蛾4个地理种群肠道细菌的优势菌属。
2. 4 草地贪夜蛾不同地理种群幼虫肠道可培养细菌多样性指数分析结果
表6顯示,草地贪夜蛾幼虫肠道可培养细菌的丰富度澜沧种群最高,丰富度指数达1.277,显著高于其他3个种群;开远种群的香农指数显著低于其他3个种群;4个种群肠道可培养细菌的辛普森指数和均匀度指数均无显著差异(P>0.05),表明4个地理种群幼虫肠道可培养细菌分布较均匀。
3 讨论
宿主与其肠道内的微生物协同进化有助于宿主适应多样的生境(Muegge et al.,2011)。本研究采用传统分离培养法结合16S rDNA测序技术,对采自云南省澜沧、保山、开远和石林4个地理种群以玉米为寄主的草地贪夜蛾幼虫肠道细菌进行分离培养,共分离到4门9科12属19种共27株细菌,4个地理种群的草地贪夜蛾均以变形菌门和厚壁菌门为优势菌门,放线菌门和拟杆菌门仅微量存在,与Gichuhi等(2020)对肯尼亚4个草地贪夜蛾种群幼虫肠道细菌优势菌门的研究结果一致,许多鳞翅目昆虫肠道细菌的优势菌门也有类似结果(He et al.,2013;魏丹峰等,2017;朱晗等,2020)。表明变形菌门和厚壁菌门细菌是草地贪夜蛾幼虫肠道共生菌的优势类群,为调控肠道共生菌防治草地贪夜蛾提供了靶标菌群。同时,草地贪夜蛾作为一种新入侵进入云南的害虫,除开远种群以变形菌门为最优势类群外,澜沧、保山和石林种群均以厚壁菌门为最主要类群,主要为肠球菌属和克雷伯氏菌属,引起这种差异的原因可能是不同地理种群所处环境中的温度和农药使用等差异,但具体原因还有待深入研究。其次,本研究中开远、澜沧、保山和石林4个地理种群草地贪夜蛾肠道优势菌属均为肠球菌属,与国外Almeida等(2017)和Gichuhi等(2020),及国内李宏伟等(2020)、徐天梅等(2020)和张凌英等(2020)的研究结果一致,表明肠球菌属可能是草地贪夜蛾肠道内的常驻核心菌群,对草地贪夜蛾有重要的生理功能。研究发现肠球菌属细菌在昆虫体内广泛存在,可介导对抗生素的耐药性,改善昆虫肠道的碱性环境,且对许多抗菌药物表现为耐药,如舞毒蛾肠道中的粪肠球菌能降低苏云金芽胞杆菌杀虫剂活性(Broderick et al.,2004);铅黄肠球菌能降解植物中的萜烯类物质(Vilanova et al.,2016)。此外,厚壁菌门的芽胞杆菌属是产纤维素酶的常见类群,能降解纤维素等大分子物质,广泛存在于环境和昆虫肠道中(Broderick et al.,2006;Auta et al.,2017;吴长伟等,2021)。
草地贪夜蛾不同地理种群的优势菌属基本相同,可能与虫源均采自玉米寄主有关,但一些次优势菌的种类和相对丰度的差异较大,如保山种群的次优势菌主要来自不动杆菌属和克雷伯氏菌属,其中不动杆菌属、谷氨酸棒杆菌属和假单胞菌属为该种群所特有;而澜沧、石林和开远种群次优势菌主要来自克雷伯氏菌属和肠杆菌属,泛菌属和鞘氨醇杆菌属为石林种群所特有,考克氏菌属和勒克氏菌属为澜沧种群所特有,产生这一差异的原因可能与各地区气候环境以及昆虫种群的抗药性有关,有待进一步探究。本研究中保山隆阳区四季气候温和,澜沧地区海拔落差大造成立体气候明显,开远地区常年少雨,石林县日照偏少,使草地贪夜蛾在适应不同环境的过程中肠道菌群可能发生了自然选择。研究发现不同农业气候区的棉铃虫(Heiicoverpa armigera)肠道细菌组成差异较大(Priya et al.,2012),室内饲喂的棉铃虫肠道菌群也较田间种群简单(Xiang et al.,2006);研究发现不同地理种群二化螟(Chilo suppressalis)抗药性水平差异较大,敏感种群的中肠细菌群落多样性较抗性种群低(张珏锋等,2013)。昆虫肠道细菌在宿主生长发育、代谢和环境适应性中发挥着不可替代的作用(杨晓晴等,2018),昆虫肠道内微生物可能与宿主协同进化,宿主的免疫系统影响肠道微生物群,而微生物群反过来适应不同免疫的宿主和环境(Brucker and Bordenstein,2012;Koch et al.,2013)。不同地理种群草地贪夜蛾的抗药性存在显著差异(凌炎等,2019;尹艳琼等,2019),然而,对于云南不同地理种群草地贪夜蛾幼虫肠道细菌组成的差异与抗药性间的关系尚不清楚。因此,进一步明确特定肠道菌对草地贪夜蛾抗药性的影响,将有助于理解草地贪夜蛾对不同环境适应性分化的机制,并可为草地贪夜蛾抗药性治理及防治提供新思路。
4 结论
云南澜沧、石林、开远和保山4个不同地理种群草地贪夜蛾幼虫肠道细菌较丰富,但不同地理种群肠道细菌多样性存在差异,表明草地贪夜蛾从普洱江城县扩散到不同地区后定殖并已形成了不同的地理种群;同时,不同地理种群草地贪夜蛾幼虫肠道细菌的优势菌均为厚壁菌门的肠球菌属细菌,肠球菌属细菌对草地贪夜蛾肠道及其肠道整个细菌群落起着决定作用。
参考文献:
陈勃生,鲁兴萌,邵勇奇. 2017. 鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J]. 昆虫学报,60(6):710-722. [Chen B S,Lu X M,Shao Y Q. 2017. Diversity of the gut microbiota in lepidopteran insects and their interac-tion with hosts[J]. Acta Entomologica Sinica,60(6):710-722.] doi:10.16380/j.kcxb.2017.06.011.
戴航宇,滕春莹,张荣涛. 2020. 桦褐孔菌多酚抑菌活性分析研究[J]. 中国酿造,39(11):109-115. [Dai H Y,Teng C Y,Zhang R T. 2020. Antibacterial activity of polyphenols from Inonotus obliquus[J]. China Brewing,39(11):109-115.] doi:10.11882/j.issn.0254-5071.2020.11.021.
冯广达,陈美标,羊宋贞,朱红惠. 2013. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报,34(3):439-442. [Feng G D,Chen M B,Yang S Z,Zhu H H. 2013. A comparative study on bacteria DNA extraction methods used for PCR amplification[J]. Journal of South China Agricultural University,34(3):439-442.]
耿海荣,张晨曦,赵月菊,刘阳. 2019. 一株高效降解玉米赤霉烯酮的耐酸耐高温枯草芽孢杆菌的研究[J]. 核农学报,33(7):1399-1407. [Geng H R,Zhang C X,Zhao Y J,Liu Y. 2019. Study on heat resistant Bacillus subtilis with high degradation efficiency of Zearalenone[J]. Journal of Nuclear Agricultural Sciences,33(7):1399-1407.] doi:10.11869/j.issn.100-8551.2019.07.1399.
江南纪,王琛柱. 2019. 草地贪夜蛾的性信息素通讯研究进展[J]. 昆虫学报,62(8):993-1002. [Jiang N J,Wang C Z. 2019. Progress in sex pheromone communication of the fall armyworm,Spodoptera frugiperda (Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica,62(8):993-1002.] doi:10.16380/j.kcxb.2019.08.012.
姜玉英,刘杰,谢茂昌,李亚红,杨俊杰,张曼丽,邱坤. 2019. 2019年我国草地贪夜蛾扩散为害规律观测[J]. 植物保护,45(6):10-19. [Jiang Y Y,Liu J,Xie M C,Li Y H,Yang J J,Zhang M L,Qiu K. 2019. Observation on law of diffusion damage of Spodoptera frugiperda in China in 2019[J]. Plant Protection,45(6):10-19.] doi:10.16688/ j.zwbh.2019539.
李宏伟,杨晓洁,向奕舟,林连兵,张棋麟. 2020. 草地贪夜蛾幼虫肠道细菌的分离鉴定及纤维素降解细菌的筛选[J]. 应用昆虫学报,57(3):608-616. [Li H W,Yang X J,Xiang Y Z,Lin L B,Zhang Q L. 2020. Isolation and identification of the intestinal bacteria,and screening of the cellulolytic bacteria,of Spodoptera frugiperda (Lepidoptera:Nocturid) larvae[J]. Chinese Journal of Applied Entomology,57(3):608-616.] doi:10.7679/j.issn.2095-1353.2020.061.
李青晏,唐运林,蒋睿轩,张永红,朱峰,白兴荣,顾偌铖,吴燕燕,吴玉娇,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2020. 云南地区草地贪夜蛾肠道细菌的分离及鉴定[J]. 西南大学学报(自然科学版),42(1):1-8. [Li Q Y,Tang Y L,Jiang R X,Zhang Y H,Zhu F,Bai X R,Gu R C,Wu Y Y,Wu Y J,Chen J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2020. Isolation and identification of gut bacteria of Spodoptera frugiperda feeding on maize in Yunnan,China[J]. Journal of Southwest University (Na-tural Science),42(1):1-8.] doi:10.13718/j.cnki.xdzk. 2020.01.001.
凌炎,黄芊,蒋婷,庞国群,蒋显斌,符诚强,吴碧球,黄所生,李成,黄凤宽,钟勇,龙丽萍. 2019. 两个广西草地贪夜蛾种群对常用杀虫剂的敏感性测定[J]. 环境昆虫学报,41(5):954-960. [Ling Y,Huang Q,Jiang T,Pang G Q,Jiang X B,Fu C Q,Wu B Q,Huang S S,Li C,Huang F K,Zhong Y,Long L P. 2019. Sensitivity tests of two Spodoptera frugiperda populations to commonly-used insecticides in Guangxi[J]. Journal of Environmental Entomology,41(5):954-960.] doi:10.3969/j.issn.1674-0858. 2019.05.4.
劉小改. 2017. 稻纵卷叶螟肠道细菌群落组成与多样性分析[D]. 重庆:西南大学. [Liu X G. 2017. Analysis of the bacterial community structure and diversity in the intestine of Cnaphalocrocis medinalis (Gueneée) (Lepidoptera:Pyralidae)[D]. Chongqing:Southwest University.]
刘芷涵,孙小红,邢一帆,周丹,孙艳,马磊,沈波. 2020. 淡色库蚊溴氰菊酯敏感品系与抗性种群的肠道菌群多样性分析[J].中国媒介生物学及控制杂志,31(5):545-551. [Liu Z H,Sun X H,Xing Y F,Zhou D,Sun Y,Ma L,Shen B. 2020. An analysis of gut microbial diversity of deltamethrin-susceptible strains and deltamethrin-resistant populations of Culex pipiens pallens[J]. Chinese Journal of Vector Biology and Control,31(5):545-551.] doi:10.11853/j.issn.1003.8280.2020.05.009.
戚珊珊,周礼红,胡久平,刘敏,赵辉,熊燕. 2017. 西藏多地區土壤可培养细菌的分离鉴定及多样性分析[J]. 西南农业学报,30(7):1629-1635. [Qi S S,Zhou L H,Hu J P,Liu M,Zhao H,Xiong Y. 2017. Isolation,identification and diversity of soil bacteria in multiple regions from Tibetan Plateau[J]. Southwest China Journal of Agricultural Sciences,30(7):1629-1635.] doi:10.16213/j.cnki.scjas. 2017.7.028.
苏湘宁,廖章轩,李传瑛,黄少华,李峰博,刘伟玲,章玉苹. 2020. 广东草地贪夜蛾对2种常用农药的抗药性及助剂和增效剂对农药毒力的影响[J]. 南方农业学报,51(6):1274-1281. [Su X N,Liao Z X,Li C Y,Huang S H,Li F B,Liu W L,Zhang Y P. 2020. Resistance of Spodoptera frugiperda in Guangdong against two commonly used pesticides and the effects of auxiliaries and synergist on toxicity to pesticides[J]. Journal of Southern Agriculture,51(6):1274-1281.] doi:10.3969/j.issn.2095-1191.2020.06.004.
唐运林,顾偌铖,吴燕燕,邹祥明,张祯,牛小慧,王泽乐,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2019. 入侵重庆地区的草地贪夜蛾种群生物型鉴定[J]. 西南大学学报(自然科学版),41(7):1-7. [Tang Y L,Gu R C,Wu Y Y,Zou X M,Zhang Z,Niu X H,Wang Z L,Chen J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2019. Biotype identification of the population of Spodoptera frugiperda that migrated to Chongqing area[J]. Journal of Southwest University (Natural Science Edition),41(7):1-7.] doi:10. 13718/j.cnki.xdzk.2019.07.001.
王磊,陈科伟,钟国华,冼继东,何晓芳,陆永跃. 2019. 重大入侵害虫草地贪夜蛾发生危害、防控研究进展及防控策略探讨[J]. 环境昆虫学报,41(3):479-487. [Wang L,Chen K W,Zhong G H,Xian J D,He X F,Lu Y Y. 2019. Progress for occurrence and management and the strategy of the fall armyworm Spodoptera frugiperda (Smith)[J]. Journal of Environmental Entomology,41(3):479-487.] doi:10.3969/j.issn.1674-0858.2019.03.7.
王争艳,王洋,何梦婷,鲁玉杰. 2020. 不同地理种群赤拟谷盗肠道细菌群落多样性分析[J]. 应用昆虫学报,57(3):617-622. [Wang Z Y,Wang Y,He M T,Lu Y J. 2020. Diversity of intestinal bacteria in different geographic populations of Tribolium castaneum (Coleoptera:Tenebrio-nidae)[J]. Chinese Journal of Applied Entomology,57(3):617-622.] doi:10.7679/j.issn.2095-1353.2020.062.
魏丹峰,王秀吉,杨锦,耿涌鑫,陈敏. 2017. 取食不同食料的美国白蛾幼虫肠道细菌多样性及差异性研究[J]. 环境昆虫学报,39(3):515-524. [Wei D F,Wang X J,Yang J,Geng Y X,Chen M. 2017. Analysis of the diversity and difference of intestinal bacteria in larvae Hyphantria cunea Drury (Lepidoptera:Arctiidae) on different diets[J]. Journal of Environmental Entomology,39(3):515-524.] doi:10.3969/j.issn.1674-0858.2017.03.4.
吴长伟,弓新国,郑琳,张勃,蒋美红,李学杉,黄志强,普兴伟,吴明美,李仙. 2021. HF-09菌株降解烟梗纤维素及其休止细胞发酵产香效果[J]. 河南农业科学,50(6):171-180. [Wu C W,Gong X G,Zheng L,Zhang B,Jiang M H,Li X S,Huang Z Q,Pu X W,Wu M M,Li X. 2021. Degrading tobacco stem cellulose by HF-09 strain and producing aroma by resting cell fermentation[J]. Journal of Henan Agricultural Sciences,50(6):171-180. ] doi:10.15933/j.cnki.1004-3268.2021.06.021.
吴孔明. 2020. 中国草地贪夜蛾的防控策略[J]. 植物保护,46(2):1-5. [Wu K M. 2020. Management strategies of fall armyworm (Spodoptera frugiperda) in China[J]. Plant Protection,46(2):1-5.] doi:10.16688/j.zwbh.2020088.
徐天梅,符成悦,苏造堂,肖关丽,李维薇,陈斌. 2020. 云南草地贪夜蛾扩散区与首发地种群肠道细菌群落组成结构及多样性的比较[J]. 植物保护,46(4):116-125. [Xu T M,Fu C Y,Su Z T,Xiao G L,Li W W,Chen B. 2020. Composition and diversity of gut bacteria community of Spodoptera frugiperda from the first invasion site and the dispersal area in Yunnan Province[J]. Plant Protection,46(4):116-125.] doi:10.16688/j.zwbh.2020083.
徐天梅,黄钰,肖关丽,陈斌. 2021. 白背飞虱雌雄成虫肠道可培养细菌种类组成及差异分析[J]. 环境昆虫学报,43(1):158-169. [Xu T M,Huang Y,Xiao G L,Chen B. 2021. Composition and differential analysis of culturable bacteria community in the gut of male and female Sogatella furcifera (Horváth)[J]. Journal of Environmental Entomology,43(1):158-169.] doi:10.3969/j.issn.1674-0858.2021.01.16.
杨学礼,刘永昌,罗茗钟,李依,王文辉,万飞,姜虹. 2019. 云南省江城县首次发现迁入我国西南地区的草地贪夜蛾[J]. 云南农业,(1):72. [Yang X L,Liu Y C,Luo M Z,Li Y,Wang W H,Wan F,Jiang H. 2019. Spodoptera frugiperda has been found in Jiangcheng County,Yunnan Province for the first time[J]. Yunnan Agriculture,(1):72.]
楊晓晴,王正亮,王天召,俞晓平. 2018. 基于16S rRNA高通量测序的灰飞虱体内细菌群落结构及多样性分析[J]. 昆虫学报,61(2):200-208. [Yang X Q,Wang Z L,Wang T Z,Yu X P. 2018. Analysis of the bacterial community structure and diversity in the small brown planthopper,Laodelphax striatellus (Hemiptera:Delphacidae) by 16S rRNA high-throughput sequencing[J]. Acta Entomologica Sinica,61(2):200-208.] doi:10.16380/j.kcxb.2018.02.006.
尹艳琼,张红梅,李永川,田维逵,杨毅娟,罗嵘,李向永,赵雪晴,刘莹,王燕,陈福寿,谌爱东. 2019. 8种杀虫剂对云南不同区域草地贪夜蛾种群的室内毒力测定[J]. 植物保护,45(6):70-74. [Yin Y Q,Zhang H M,Li Y C,Tian W K,Yang Y J,Luo R,Li X Y,Zhao X Q,Liu Y,Wang Y,Chen F S,Chen A D. 2019. Laboratory toxicity of eight insecticides against Spodoptera frugiperda from different areas in Yunnan[J]. Plant Protection,45(6):70-74.] doi:10.16688/j.zwbh.2019456.
张珏锋,何月平,陈建明. 2013. 不同抗药性水平二化螟幼虫中肠细菌群落多样性分析[J]. 昆虫学报,56(9):1075-1082. [Zhang J F,He Y P,Chen J M. 2013. Diversity analysis of bacterial community in midguts of larvae of the striped stem borer,Chilo suppressalis (Lepidoptera:Crambidae),with different levels of resistance to insecticides[J]. Acta Entomologica Sinica,56(9):1075-1082.] doi:10.16380/j.kcxb.2013.09.010.
张凌英,苏造堂,徐天梅,张志红,郑亚强,桂富荣,陈斌. 2020. 云南普洱江城县草地贪夜蛾幼虫肠道中可培养细菌的分离及鉴定[J]. 环境昆虫学报,42(1):60-67. [Zhang L Y,Su Z T,Xu T M,Zhang Z H,Zheng Y Q,Gui F R,Chen B. 2020. Isolation and identification of culturable intestinal bacteria of Spodoptera frugiperda in Jiangcheng,Puer,Yunnan Province[J]. Journal of Environmental Entomology,42(1):60-67.] doi:10.3969/j.issn.1674-0858.2020.01.8.
张志红,张凌英,赵英杰,苏造堂,陈思颖,肖关丽,李维薇,陈斌. 2020. 云南省芒市草地贪夜蛾幼虫肠道可培养细菌种类及对抗生素的敏感性[J]. 南方农业学报,51(6):1293-1299. [Zhang Z H,Zhang L Y,Zhao Y J,Su Z T,Chen S Y,Xiao G L,Li W W,Chen B. 2020. Species and antibiotic sensitivity of culturable gut bacteria of Spodoptera frugiperda larvae from Mangshi,Yunnan[J]. Journal of Southern Agriculture,51(6):1293-1299.] doi:10.3969/j.issn.2095-1191.2020.06.007.
郑亚强,杜广祖,李亦菲,陈斌,李正跃,肖关丽. 2017. 马铃薯块茎蛾肠道细菌分离鉴定及其对植物源大分子化合物的降解作用[J]. 环境昆虫学报,39(3):525-532. [Zheng Y Q,Du G Z,Li Y F,Chen B,Li Z Y,Xiao G L. 2017. Isolation and identification of bacteria from larval gut of the potato tuberworm,Phthorimaea operculella (Zeller) and the degradation for plant-based macromolecular compounds[J]. Journal of Environmental Entomology,39(3):525-532.] doi:10.3969/j.issn.1674-0858.2017.03.5.
周帆,龐志倡,余小强,汪肖云. 2020. 昆虫肠道微生物的研究进展和应用前景[J]. 应用昆虫学报,57(3):600-607. [Zhou F,Pang Z C,Yu X Q,Wang X Y. 2020. Insect gut microbiota research:Progress and applications[J]. Chinese Journal of Applied Entomology,57(3):600-607.] doi:10. 7679/j.issn.2095-1353.2020.060.
朱晗,郝德君,魏原芝,孙丽昕,文全民. 2020. 仁扇舟蛾幼虫肠道可培养细菌群落结构分析[J]. 南京林业大学学报(自然科学版),45(2):171-176. [Zhu H,Hao D J,Wei Y Z,Sun L X,Wen Q M. 2020. Community structure analysis of the intestine cultivable bacteria of Clostera restitura larvae[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),45(2):171-176.] doi:10.12302/j.issn.1000-2006.201910011.
Acevedo F E,Peiffer M,Tan C W,Stanley B A,Stanley A,Wang J,Jones A G,Hoover K,Rosa C,Luthe D,Felton G. 2017. Fall armyworm-associated gut bacteria modulate plant defense responses[J]. Molecular Plant-Microbe Interactions,30(2):127-137. doi:10.1094/MPMI-11-16-0240-R.
Almeida L G,Moraes L A B,Trigo J R,Omoto C,Cônsoli F L. 2017. The gut microbiota of insecticide-resistant insects houses insecticide-degrading bacteria:A potential source for biotechnological exploitation[J]. PLoS One,12(3):e0174754. doi:10.1371/journal.pone.0174754.
Auta S H,Emenike C U,Fauziah S H. 2017. Screening of Bacillus strains isolated from mangrove ecosystems in Penin-sular Malaysia for microplastic degradation[J]. Environmental Pollution,231(Pt2):1552-1559. doi:10.1016/j.envpol.2017.09.043.
Broderick N A,Raffa K F,Goodman R M,Handelsman J. 2004. Census of the bacterial community of the gypsy moth larval midgut by using culturing and culture-independent methods[J]. Applied & Environmental Microbio-logy,70(1):293-300. doi:10.1128/AEM.70.1.293-300. 2004.
Broderick N A,Raffa K F,Handelsman J. 2006. Midgut bacteria required for Bacillus thuringiensis insecticidal activity[J]. Proceedings of the National Academy of Sciences of the United States of America,103(41):15196-15199. doi:10.1073/pnas.0604865103.
Brucker R M,Bordenstein S R. 2012. The roles of host evolutionary relationships(genus:Nasonia) and development in structuring microbial communities[J]. Evolution:International Journal of Organic Evolution,66(2):349-362. doi:10.1111/j.1558-5646.2011.01454.x.
Chen B S,Du K Q,Sun C,Vimalanathan A,Liang X L,Li Y,Wang B H,Lu X M,Li L J,Shao Y Q. 2018. Gut bacterial and fungal communities of the domesticated silkworm (Bombyx mori) and wild mulberry-feeding relatives[J]. The ISME Journal:Multidisciplinary Journal of Microbial Ecology,12(9):2252-2262. doi:10.1038/s41396-018-01 74-1.
Egert M,Wagner B,Lemke T,Brune A,Friedrich M W. 2003. Microbial community structure in midgut and hindgut of the humus-feeding larva of Pachnoda ephippiata (Coleop-tera:Scarabaeidae)[J]. Applied and Environmental Microbiology,69(11):6659-6668. doi:10.1128/AEM.69.11. 6659-6668.2003.
Gichuhi J,Sevgan S,Khamis F,Van den Berg J,du Plessis H,Ekesi S,Herren J K. 2020. Diversity of fall armyworm,Spodoptera frugiperda and their gut bacterial community in Kenya[J]. PeerJ,8:e8701. doi:10.7717/peerj.8701.
Goergen G,Kumar P L,Sankung S B,Togola A,Tamò M,Luthe D S. 2016. First report of outbreaks of the fall armyworm Spodoptera frugiperda(J.E. Smith)(Lepidoptera,Noctuidae),a new alien invasive pest in west and central Africa[J].PLoS One,11(10):e0165632. doi:10.1371/journal.pone.0165632.
He C,Nan X N,Zhang Z Q,Li M L. 2013. Composition and diversity analysis of the gut bacterial community of the oriental armyworm,Mythimna separata,determined by culture-independent and culture-dependent techniques[J]. Journal of Insect Science,13(165):1-11. doi:10.1673/031.013.16501.
Huang S W,Zhang H Y. 2017. The impact of environmental heterogeneity and life stage on the hindgut microbiota of Holotrichia parallela larvae(Coleoptera:Scarabaeidae)[J]. PLoS One,8(2):e57169. doi:10.1371/journal.pone. 0057169.
Jing D P,Guo J F,Jiang Y Y,Zhao J Z,Amit S,He K L,Wang Z Y. 2020. Initial detections and spread of invasive Spodoptera frugiperda in China and comparisons with other noctuid larvae in cornfields using molecular techniques[J]. Insect Science,27(4):780-790. doi:10.1111/1744-7917.12700.
Koch H,Abrol D P,Li J L,Schmid-Hempel P. 2013. Diversity and evolutionary patterns of bacterial gut associates of corbiculate bees[J]. Molecular Ecology,22(7):2028-2044. doi:10.1111/mec.1220910.1111/mec.12209.
Lin W S,Huang C W,Song Y S,Yen J H,Kuo P C,Yeh S R,Lin H Y,Fu T F,Wu M S,Wang H D,Wang P Y. 2015. Reduced gut acidity induces an obese-like phenotype in Drosophila melanogaster and in mice[J]. PLoS One,10(10):e0139722. doi:10.1371/journal.pone.0139722.
Muegge B D,Kuczynski J,Knights D,Clemente J C,Gonzlez A,Fontana L,Henrissat B,Knight R,Gordon J. 2011. Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans[J]. Science,332(6032):970-974. doi:10.1126/science.1198719.
Nagalakshmi R G,Selvakumar G,Abraham V,Sudhagar S,Ravi M. 2017. Diversity of the cultivable gut bacterial communities associated with the fruit flies Bactrocera dorsalis and Bactrocera cucurbitae (Diptera:Tephritidae)[J]. Phytoparasitica,45(4):453-460. doi:10.1007/s12600- 017-0604-z.
Paramasiva I,Shouche Y,Kulkarni G J,Krishnayya P V,Akbar S M,Sharma H C. 2014. Diversity in gut microflora of Helicoverpa armigera populations from different regions in relation to biological activity of Bacillus thuringiensis δ-endotoxin Cry1Ac[J]. Archives of Insect Biochemistry and Physiology,87(4):201-13. doi:10.1002/arch.21190.
Priya N G,Ojha A,Kajla M K,Raj A,Rajagopal R. 2012. Host plant induced variation in gut bacteria of Helicoverpa armigera[J]. PLoS One,7(1):e30768. doi:10.1371/journal.pone.0030768.
Strano C P,Malacrinò A,Campolo O,Palmeri V. 2018. Influen-ce of host plant on Thaumetopoea pityocampa gut bacterial community[J]. Microbial Ecology,75(2):487-494. doi:10.1007/s00248-017-1019-6.
Sun Z L,Lu Y H,Zhang H,Kumar D,Liu B,Gong Y C,Zhu M,Zhu L Y,Liang Z,Kuang S L,Chen F,Hu X L,Cao G L,Xue R Y,Gong C L. 2016. Effects of BmCPV infection on silkworm Bombyx mori intestinal bacteria[J]. PLoS One,11(1):e0146313. doi:10.1371/journal.pone. 0146313.
Todd E L,Poole R W. 1980. Keys and illustrations for the Armyworm moths of the noctuid genus Spodoptera Guenée from the western hemisphere[J]. Annals of the Entomological Society of America,73(6):722-738. doi.org/10. 1093/aesa/73.6.722.
Vilanova C,Baixeras J,Latorre A,Porcar M. 2016. The genera-list inside the specialist:Gut bacterial communities of two insect species feeding on toxic plants are dominated by Enterococcus sp.[J]. Frontiers in Microbiology,7:1005. doi:10.3389/fmicb.2016.01005.
Xiang H,Wei G F,Jia S H,Huang J H,Miao X X,Zhou Z H,Zhao L P,Huang Y P. 2006. Microbial communities in the larval midgut of laboratory and field populations of cotton bollworm(Helicoverpa armigera)[J]. Canadian Journal of Microbiology,52(11):1085-1092. doi:10.1139/ w06-064.
Yun J H,Roh S W,Whon T W,Jung M J,Kim M S,Park D S,Yoon C,Nam Y D,Kim Y J,Choi J H,Kim J Y,Shin N R,Kim S H,Lee W J,Bae J W. 2014. Insect gut bacterial diversity determined by environmental habitat,diet,developmental stage,and phylogeny of host[J]. Applied and Environmental Microbiology,80(17):5254-5264. doi:10.1128/AEM.01226-14.
收稿日期:2021-11-12
基金項目:国家自然科学基金项目(32060616);国家重点研发计划项目(2019YFD0300105)
通讯作者:陈斌(1970-),https://orcid.org/0000-0001-7424-3046,博士,教授,主要从事害虫综合治理研究工作,E-mail:chbins@163.com
第一作者:李永萍(1997-),https://orcid.org/0000-0003-2520-2197,研究方向为昆虫肠道菌多样性,E-mail:2305544078@qq.com
