蒜芥茄SsWRKY1基因克隆及黄萎病病原菌胁迫下表达分析
2022-07-14尹梦莹蔚亚楠杜光辉桂敏黎志彬鲍锐龚亚菊吴丽艳
尹梦莹 蔚亚楠 杜光辉 桂敏 黎志彬 鲍锐 龚亚菊 吴丽艳






摘要:【目的】克隆蒜芥茄WRKY1基因(SsWRKY1),并分析其在黃萎病病原菌胁迫下的表达模式,为探究WRKY1基因在野生蒜芥茄黄萎病抗性中的调控机制提供理论参考。【方法】利用染色体步移技术克隆SsWRKY1基因,通过在线生物信息学软件进行序列分析及构建系统发育进化树;采用GFP融合蛋白表达法对WRKY1蛋白进行亚细胞定位,利用实时荧光定量PCR(qRT-PCR)检测SsWRKY1基因在不同组织及接种黄萎病病原菌后不同时间的相对表达量。并分析9种野生茄材料接种黄萎病病原菌后的病情指数与WRKY1基因表达变化量的相关性。【结果】克隆获得的SsWRKY1基因(GenBank登录号MZ846202)ORF序列长度为1224 bp,编码407个氨基酸残基,蛋白相对分子量为44.87 kD,理论等电点(pI)为6.91,属于亲水性不稳定蛋白,亚细胞定位于细胞核,符合转录因子特征。SsWRKY1蛋白含有2个WRKY保守结构域和C2H2型锌指结构,属于Ⅰ类WRKY转录因子,其二级结构主要由α-螺旋(7.13%)、β-折叠(4.67%)、无规则卷曲(73.71%)和延伸链(14.50%)组成。SsWRKY1蛋白与番茄、野生潘那利番茄、野生番茄、马铃薯WRKY1蛋白的亲缘关系较近。SsWRKY1基因在根和茎的相对表达量显著高于叶中的相对表达量(P<0.05,下同)。黄萎病病原菌接种后不同时间,SsWRKY1基因的相对表达量均低于对照组(无菌水接种),但仅在24 h时二者差异达显著水平。9种野生茄材料接种黄萎病病原菌后的病情指数与接种前后WRKY1基因表达变化量间呈显著正相关。【结论】SsWRKY1属于第Ⅰ类WRKY转录因子,序列高度保守,在细胞核中表达,其基因具有组织表达特异性,黄萎病菌胁迫后该基因的表达下调,推测WRKY1在野生茄黄萎病抗性中起负调控作用。
关键词: 蒜芥茄;WRKY转录因子;黄萎病;基因克隆;亚细胞定位;表达分析
中图分类号: S641.1;S436.411 文献标志码: A 文章编号:2095-1191(2022)04-1000-11
Cloning and expression analysis of SsWRKY1 gene in Solanum sisymbriifolium under stress of verticillium wilt disease
YIN Meng-ying1,2, YU Ya-nan1,2, DU Guang-hui2, GUI Min1, LI Zhi-bin1,
BAO Rui1, GONG Ya-ju1*, WU Li-yan1*
(1Horticultural Research Institute, Yunnan Academy of Agricultural Sciences, Kunming, Yunnan 650205, China;
2Institute of Resource Plants, Yunnan University, Kunming, Yunnan 650500, China)
Abstract:【Objective】The WRKY1 gene of Solanum sisymbriifolium (SsWRKY1) was cloned and its expression pattern under the stress of verticillium wilt disease was analyzed to provide a theoretical reference for exploring the regulatory mechanism of WRKY1 gene in the resistance to verticillium wilt. 【Method】SsWRKY1 gene was cloned by the genome walking technique, and its sequence was analyzed by bioinformatics software and a phylogenetic tree was constructed. The subcellular localization of WRKY1 protein was determined by its GFP fusion protein expression under its native promoter. The expression of SsWRKY1 in different tissues of S. sisymbriifolium at different times under verticillium wilt di-sease stress was analyzed by real-time quantitative PCR(qRT-PCR). The correlation analysis between disease index and WRKY1 gene expression of 9 wild eggplant materials inoculated with the verticillium wilt pathogen was also analyzed. 【Result】The full-length open reading frame(ORF) sequence of SsWRKY1 gene (GenBank accession number:MZ846202) was 1224 bp, encoding 407 amino acids residues. Its protein molecular weight was 44.87 kD and its theoretical isoelectric point (pI) was 6.91, which indicated that SsWRKY1 was a hydrophilic and unstable protein. Its subcellular localization in the nucleus conformed to the characteristics of transcription factors. The SsWRKY1 protein contained two conserved WRKY domains and a C2H2-type zinc finger structure, indicating that SsWRKY1 was a class I WRKY transcription factor. Its secondary structure was mainly composed of α-helix (7.13%), β-bridge (4.67%), random coil (73.71%) and exten-ded strand (14.50%). S. sisymbriifolium was closely related to S. lycopersicum, S. pennellii, S. arcanum and S. tuberosum. The relative expression of SsWRKY1 in roots and stems was significantly higher than that in leaves (P<0.05,the same below). The relative expression of SsWRKY1 at different times after the inoculation of the verticillium wilt pathogen was lower than that of the control group (sterile water inoculation), but the difference was significant at 24 h. There was a significant positive correlation between disease index and the variation in WRKY1 expression in 9 wild eggplant materials ino-culated with verticillium wilt pathogen. 【Conclusion】SsWRKY1 belongs to the class I of WRKY transcription factors, its sequence is highly conserved and is expressed in the nucleus. The gene expression of SsWRKY1 is tissue-specific and the expression of this gene decreased under verticillium wilt disease stress. SsWRKY1 gene may play a negative regulatory role in wild eggplant resistance to verticillium wilt.
Key words:Solanum sisymbriifolium;WRKY transcription factor;verticillium wilt;gene cloning;subcellular loca-lization;gene expression analysis
Foundation items:National Natural Science Foundation of China Regional Fund Project (31960594);Yunnan Applied Basic Research Project (2019FB059);Yunnan Joint Foundation for Agricultural Basic Research (2018FG001-022)
0 引言
【研究意义】黄萎病(Verticillium wilt)是由轮枝菌(Verticillium spp.)引起的一种土传性植物维管束病害,其病原菌微菌核在没有寄主存在的条件下,可在土壤中存活十几年之久,加之其形态和致病力易发生变异使得黄萎病防控日益复杂(Fradin and Thomma,2010;Inderbitzin et al.,2011),被称作植物的“癌症”。目前茄子黄萎病抗病材料主要为近缘野生种和半栽培种(庄勇和王述彬,2009)。我国云南省及周边地区蕴藏着丰富的黄萎病抗性野茄种质资源(郑殿升等,2013),其中,蒜芥茄(Solanum sisymbriifolium)具有较强的黄萎病抗性(Collonnier et al.,2001;郭堂勋等,2015;吴丽艳等,2017),但其抗性基因尚未被挖掘利用。WRKY转录因子是植物所特有的一类转录因子,在植物抗病防御反应中发挥重要的调控作用(Pandey and Somssich,2009),但在野茄抗黄萎病过程中的研究甚少。因此,克隆蒜芥茄WRKY基因并分析其表达特性,对深入探究该基因在蒜芥茄抗黄萎病过程中的生物学功能及调控机制具有重要意义。【前人研究进展】WRKY转录因子在植物逆境应答中发挥重要作用。Dang等(2014)研究发现,烟草中过表达辣椒CaWRKY27基因能增强烟草对青枯病菌的抗性;Warren等(2020)研究发现,将芍药PlWRKY65基因沉默后,植株对细链孢霉感染更敏感;Long等(2021)研究认为,甜橙CsWRKY22基因表达可降低其植株对溃疡病的抗性;刘开等(2021)研究发现,茄子SmWRKY65基因可能参与植株青枯病抗性调控;Freeboroug等(2021)研究发现,木薯MeWRKY81基因参与对木薯花叶病毒的负调控因子。WRKY1作为较早被发现的WRKY转录因子之一,在植物抗逆反应中也发挥着重要作用。如番茄LpWRKY1和辣椒CaWRKY1转录因子均被证明参与植物防御反应(Hofmann et al.,2008;Oh et al.,2008),且番茄LpWRKY1转录因子在番茄抗晚疫病过程中发挥正向调节作用(Cui et al.,2019);草莓FaWRKY1转录因子是介导植株对尖孢炭疽病菌防御反应的重要因子,能负调控果实对尖孢炭疽病的抗性(Sonia et al.,2009;Higuera et al.,2019);苹果轮纹病病原菌能诱导湖北海棠中MhWRKY1基因的表达,推测该基因参与防御轮纹病病原菌侵入的响应(张计育等,2011);棉花GbWRKY1转录因子是一个关键的调节因子,能负调控棉花对灰霉病菌和大丽轮枝菌抗性(Li et al.,2014);烟草中过表达SpWRKY1基因能显著提高植株对烟草疫霉的抗性(Li et al.,2015);葡萄VvWRKY1基因可增强植株对霜霉病的抗性(Marchive et al.,2018);水茄StWRKY-1基因在拟南芥中诱导表达后,拟南芥对茄子黄萎病表现出抗性(李笑等,2018);拟南芥AtWRKY1基因能负调控丁香假单胞菌番茄致病变种(Pseudomonas syringae pv. Tomato DC3000,Pst DC3000)的响应(Fang et al.,2021)。【本研究切入点】本课题组前期基于转录组测序数据对蒜芥茄在黄萎病抗病过程中的主要差异基因、代谢通路等进行深入分析,结果发现接种黄萎病病原菌后,WRKY1同源基因在蒜芥茄中显著上调表达,推测该基因可能在蒜芥茄黄萎病抗病中发挥重要作用。【拟解决的关键问题】以蒜芥茄为材料,利用染色体步移技术(Genome Walking)克隆出蒜芥茄WRKY1基因(SsWRKY1)(GenBank登录号MZ846202),对其进行生物信息学分析,采用实时荧光定量PCR(qRT-PCR)检测其在蒜芥茄不同组织(根、茎、叶)及接种黄萎病病原菌后不同时间的相对表达量,并对9种野生茄材料接种黄萎病病原菌24 h后WRKY1基因的表达情况与其病情指数进行相关分析,为探究WRKY1基因在野生蒜芥茄黄萎病抗性中的调控机制提供理论参考。
1 材料与方法
1. 1 试验材料
供试的9种野生茄材料(表1)种植于云南省农业科学院园艺作物研究所试验基地内。黄萎病致病菌株大丽轮枝菌(Verticillium dahliae Kleb.)由本课题组保存提供。主要试剂:广谱植物基因组DNA快速提取试剂盒(DL116-01)购自北京博迈德基因技术有限公司;植物RNA提取试剂盒(R6827)购自OMEGA公司,GoldenstarTM RT6 cDNA Synthesis Kit試剂盒、2 ×TSINGKE Master qPCR Mix qPCR Mix(SYBR Green Ⅰ)试剂盒、大肠杆菌DH5α感受态细胞和农杆菌GV3101感受态细胞购自北京擎科生物科技有限公司;KOD FX高保真PCR酶购自东洋纺(上海)生物科技有限公司;2 ×Biorun Pfu PCR Mix酶购自武汉伯远生物科技有限公司;T4 DNA连接酶和限制性内切酶购自北京全式金生物技术有限公司;pMD19-T载体购自宝生物工程(大连)有限公司。主要设备仪器:CFX96TM Realtime System荧光定量PCR仪(美国Bio-Rad公司)、T100TM PCR仪(美国Bio-Rad公司)、NanoDrop 超微量核酸蛋白分析仪(德国Implen公司)、ChemiDoc XRS+凝胶成像系统(美国Bio-Rad公司)、顶置LED人工气候箱(武汉伯远生物科技有限公司)和徕卡正置荧光显微镜(德国Leica公司)。
1. 2 材料处理及取样
于4片真叶期选取生长状态良好的蒜芥茄植株,分别对其不同组织部位(根、茎、叶)进行取样,液氮速冻,储存于-80 ℃超低温冰箱,用于SsWRKY1基因在蒜芥茄不同组织中的表达分析。
参考吴丽艳等(2017)的方法,于4片真叶期利用浸根法对蒜芥茄进行病原菌人工接种,以无菌水处理为对照,分别处理0、24 、48和72 h后,取其根部,待洗净并擦干后液氮速冻,于-80 ℃超低温冰箱,用于SsWRKY1基因在蒜芥茄接种黄萎病病原菌后不同时间的表达分析。
采用上述相同的方法进行野生茄材料人工接种及取样,用于WRKY1基因表达情况与其病情指数的相关分析。根据SsWRKY1基因在蒜芥茄接种黄萎病病原菌后不同时间的表达分析结果得到该基因表达量差异最大的时间点,取部分植株叶片,并参考吴丽艳等(2017)的方法统计剩余植株的抗病性和病情指数。以上每个材料均设3次重复,每次重复10株植株。
1. 3 SsWRKY1基因克隆
1. 3. 1 基因组DNA提取 按照广谱植物基因组DNA快速提取试剂盒说明提取蒜芥茄根部基因组DNA。
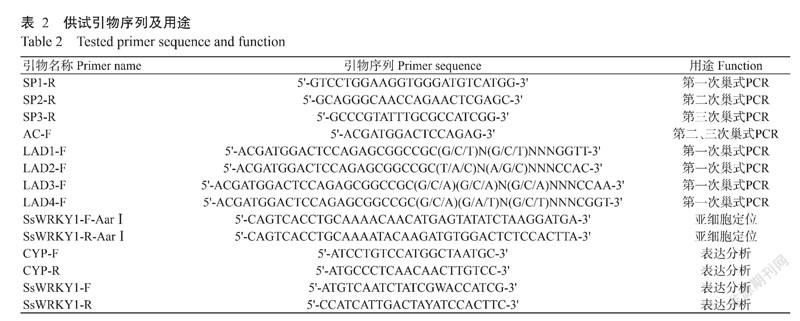
1. 3. 2 采用染色体步移技术扩增SsWRKY1基因编码区(CDS)序列 根据前期转录组测序得到的不完整CDS序列,利用Primer 5.0设计3条特异引物SP1-R、SP2-R和SP3-R(表2)。以蒜芥茄基因组DNA为模板,以简并引物LAD1-F/LAD2-F/LAD3-F/LAD4-F与特异引物SP1-R配对进行第1次巢式PCR,扩增程序:95 ℃预变性90 s;95 ℃ 10 s,62 ℃ 30 s,72 ℃ 2 min;94 ℃ 10 s,25 ℃ 2 min,72 ℃ 2 min;进行15个循环(94 ℃ 10 s,62 ℃ 30 s,72 ℃ 2 min;94 ℃ 10 s,62 ℃ 30s,72 ℃ 2 min;94 ℃ 10 s,44 ℃ 30 s,72 ℃ 2 min);72 ℃延伸5 min。以第1次巢式PCR产物为模板,以特异引物SP2与简并引物AC-F配对,进行第2次巢式PCR;以第2次巢式PCR产物为模板,以特异引物SP3与简并引物AC-F配对,进行第3次巢式PCR,第2、3次PCR扩增程序相同,均为:95 ℃预变性90 s;94 ℃ 10 s,62 ℃ 30 s,72 ℃ 2 min,进行30个循环;72 ℃预变性5 min。反应体系25.0 μL:模板1.0 μL,2×KOD1 PCR Mix 0.5 μL,dNTP Mix 5.0 μL,10 × Buffer 12.5 μL,10.0 μmol/L 上、下游引物各1.0 μL,ddH2O补充至25.0 μL。
利用1%琼脂糖凝胶电泳分别对第2、3轮PCR产物进行检测,待目的片段检测确认后,对其进行回收、纯化并连接至pMD19-T载体上,将重组载体转化大肠杆菌DH5α感受态细胞,经菌落PCR鉴定后,选取符合要求的阳性质粒送至昆明擎科生物科技有限公司测序。
1. 4 生物信息学分析
使用NCBI数据库的ORFfinder查找SsWRKY1基因的开放阅读框(ORF),利用ProtParam对SsWRKY1蛋白的理化性质进行预测;利用Cell-PLoc 2.0对蛋白进行亚细胞定位,利用ProtScale对蛋白的亲/疏水性进行预测;利用SOPMA对蛋白的二级结构进行预测,同时利用SWISS-MODEL对蛋白的三级结构进行预测;在NCBI数据库中通过BLAST搜索与SsWRKY1蛋白同源序列,利用DNAMAN 9.0进行同源比对,最后利用MEGA X的邻接法(Neighbor-Joining)构建系统发育进化树(1000次重复,其他为默认设置)。
1. 5 亚细胞定位试验
利用Primer 5.0设计携带Aar Ⅰ酶切位点的特异性引物SsWRKY1-F-AarⅠ/SsWRKY1-R-AarⅠ(表2),以蒜芥茄DNA為模板进行PCR扩增。反应体系50.0 μL:Biorun Pfu PCR Mix 25.0 μL,10 μmol/L正、反向引物(SsWRKY1-F-AarⅠ和SsWRKY1-R-AarⅠ)各2.0 μL,cDNA模板1.0 μL,Nuclease-free H2O 20.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,50 ℃ 45 s,72 ℃ 73 s,进行30个循环;72 ℃延伸10 min,4 ℃保存。然后用AarⅠ内切酶对扩增产物进行酶切,用BsaⅠ和Eco31Ⅰ对pBWA(V)HS-ccdb-GLosgfp载体进行双酶切,经纯化回收后用T4连接酶连接,从而构建pBWA(V)HS-SsWRKY1-GLosgfp融合表达载体。
采用液氮法将空载体pBWA(V)HS-ccdb-GLosgfp(阴性对照)和重组载体WA(V)HS-SsWRKY1-GLosgfp转化农杆菌GV3101。随后在YEP固体培养基(含100 μg/mL卡那霉素和50 μg/mL利福平)上进行阳性克隆筛选。挑取单克隆至YEP液体培养基中过夜培养(28 ℃,220 r/min),经菌液PCR检测为阳性后继续培养至OD600 nm=0.6时收集菌体。
利用含有100 μmol/L乙酰丁香酮、10 mmol/L 2-吗啉乙磺酸和10 mmol/L氯化镁的悬浮液对收集菌体进行重悬,并调至重悬菌液OD600 nm=0.2后室温孵育4 h。通过瞬时表达法将重悬菌液注射至本氏烟草叶片,随后置于恒温培养箱(光照16 h/黑暗8 h)中培养48 h。然后用1 μg/mL DAPI(4',6-二脒基-2-苯基吲哚)染色剂对注射菌液的叶片进行染色处理。最后,利用正置荧光显微镜观察烟草细胞中绿色荧光蛋白(GFP)荧光信号的分布情况。
1. 6 蒜芥茄及其他野茄材料中WRKY1基因表达分析
RNA提取参照植物RNA提取试剂盒说明进行操作。总RNA按照GoldenstarTM RT6 cDNA Synthesis Kit试剂盒的方法反转录合成cDNA第一链。根据目的基因的cDNA序列设计qRT-PCR引物SsWRKY1-F/ SsWRKY1-R(表2),以CYP为内参基因,利用2×TSINGKE Master qPCR Mix qPCR Mix(SYBR Green Ⅰ)试剂盒对WRKY1基因进行表达分析。每处理重复3次,以无菌水接种处理为对照。
1. 7 统计分析
使用Excel 2016对试验数据进行整理分析。WRKY1基因的相对表达量采用2-△△Ct法进行计算,通过SPSS 22.0进行单因素方差分析,并使用GraphPad Prism 8制图。参照吴丽艳等(2017)的病情调查方法及种质群体抗性分级标准对9种野茄材料进行黄萎病抗性鉴定,利用双变量-Spearman法对基因表达变化量和病情指数进行相关分析。
2 结果与分析
2. 1 SsWRKY1基因克隆及序列分析结果
经3轮PCR扩增后获得约1500 bp条带(图1)。将其测序结果提交至NCBI数据库,利用ORFfinder查找ORF,结果显示该序列包含SsWRKY1基因(GenBank登录号MZ846202)完整的ORF,长度为1224 bp,编码407个氨基酸残基(图2)。
2. 2 SsWRKY1蛋白系统发育分析及多重序列比对结果
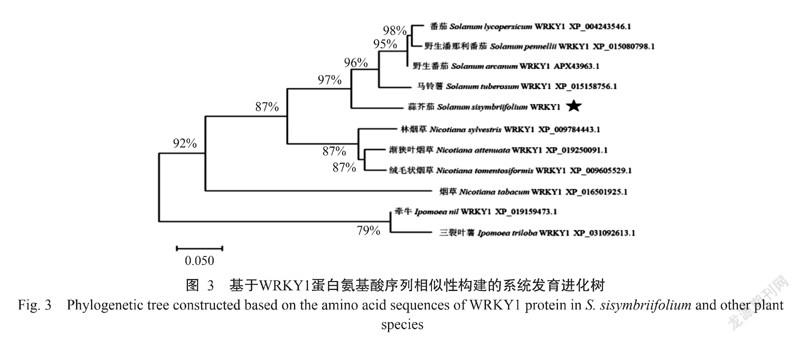
从NCBI数据库中搜索出10种已知植物的WRKY1蛋白序列,并利用MEGA X对SsWRKY1蛋白序列进行系统发育进化分析,结果(图3)显示,SsWRKY1蛋白和番茄(S. lycopersicum)、野生潘那利番茄(S. pennellii)、野生番茄(S. arcanum)及马铃薯(S. tuberosum)WRKY1蛋白的亲缘关系较近。
氨基酸序列多重比对结果(图4)显示,SsWRKY1与其他10种植物氨基酸序列的相似性为75.82%,且与其他植物一样,蒜芥茄SsWRKY1也具有WRKY功能结构域,序列一致性达100.00%,表明SsWRKY1蛋白的氨基酸序列高度保守,蛋白结构较稳定,暗示其生物学功能与其他植物WRKY1转录因子相似。SsWRKY1蛋白含有2个WRKY保守基序,分别存在于CDS的中部和后部,且具有典型的CX4-5CX22-23HX1H锌指结构(C2H2型),符合Ⅰ类WRKY转录因子的特征。
2. 2. 2 SsWRKY1蛋白理化性质及结构预测结果
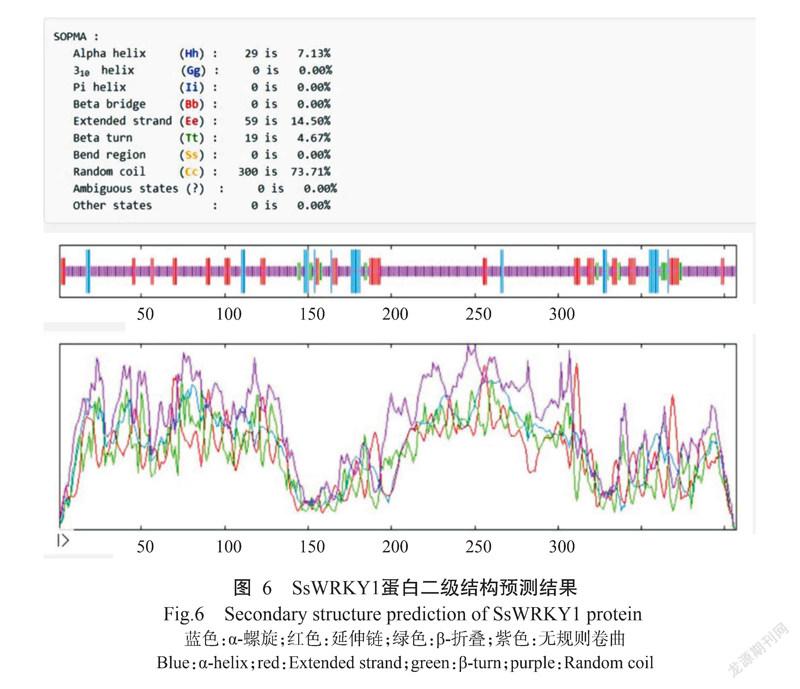
SsWRKY1蛋白的理论分子量为44.87 kD,分子式为C1908H3051N577O649S13,正电荷残基总数(Arg+Lys)为56个,负电荷残基总数(Asp+Glu)为57个,理论等电点(pI)为6.91,推测其为酸性蛋白;不稳定系数为64.67,为不稳定蛋白;亲水性系数为-1.125,表明SsWRKY1蛋白为亲水性蛋白;Cell-PLoc 2.0预测结果显示该蛋白亚细胞定位于细胞核上(图5)。SsWRKY1蛋白二级结构主要由α-螺旋、β-折叠、无规则卷曲和延伸链组成,分别占7.13%、4.67%、73.71%和14.50%(图6)。蛋白三级结构预测结果如图7所示。
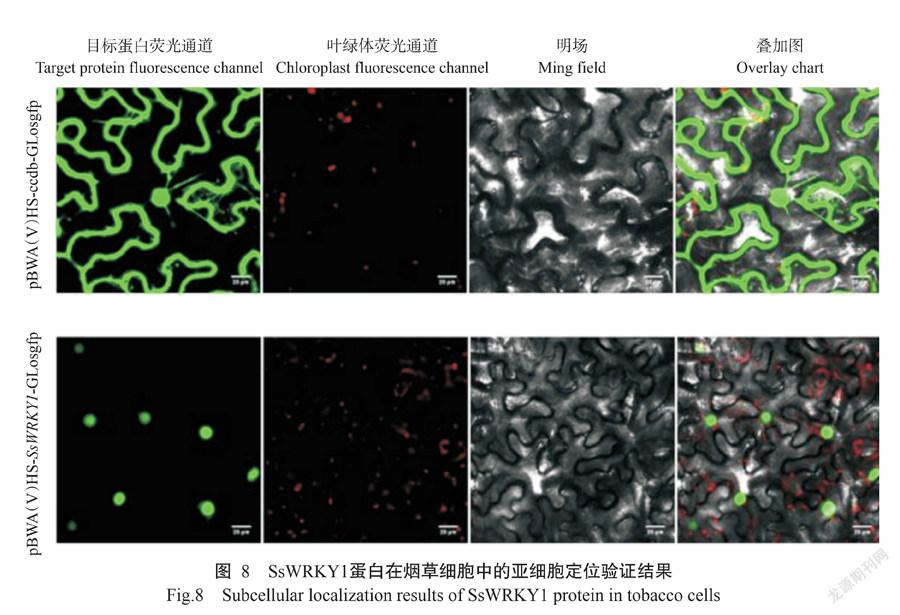
2. 3 SsWRKY1蛋白亚细胞定位验证结果
由图8可知,在含pBWA(V)HS-ccdb-GLosgfp空载体的烟草细胞中,细胞核、细胞质和细胞膜绿色荧光均分布有绿色荧光,但在含pBWA(V)HS-SsWRKY1-GLosgfp融合表达载体的烟草细胞中,仅细胞核均分布有绿色荧光,说明SsWRKY1蛋白亚细胞定位于细胞核上,与Cell-PLoc 2.0预测结果一致,符合转录因子特征,证明SsWRKY1蛋白在细胞核中发挥作用和功能。
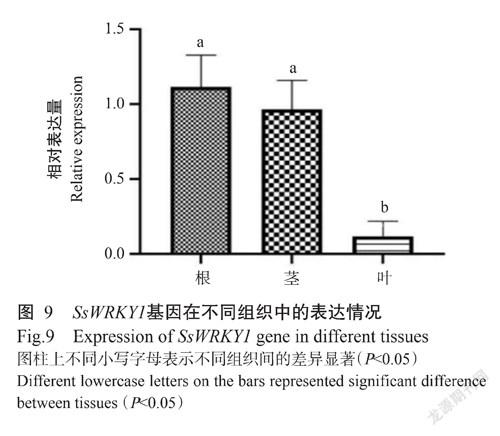
2. 4 SsWRKY1基因组织表达特性分析结果
由图9可知,SsWRKY1基因在蒜芥茄根、茎、葉中均有表达,但相对表达量存在明显差异,其中在根中的相对表达量最高,其次为茎,均显著高于叶片中的相对表达量(P<0.05,下同)。
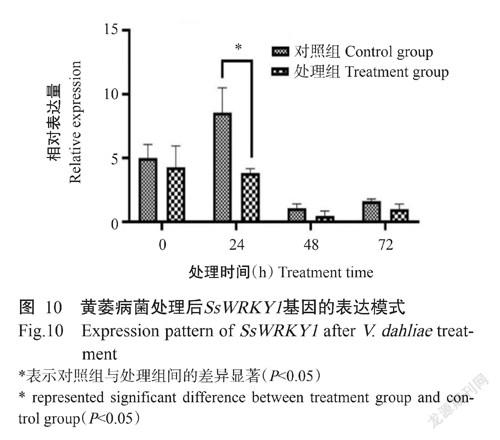
2. 5 接种黄萎病病原菌后SsWRKY1基因表达分析结果
利用qRT-PCR检测SsWRKY1基因在蒜芥茄接种黄萎病病原菌后72 h内的表达情况,结果(图10)显示,对照组中SsWRKY1基因的相对表达量呈先升高后降低再升高的变化趋势,其相对表达量在24 h达最高,48 h降至最低,但在黄萎病病原菌处理组中,SsWRKY1基因的相对表达量呈先降低后升高的趋势,48 h为SsWRKY1基因相对表达量的最低。同一时间点上,处理组中SsWRKY1基因的相对表达量均低于对照组,其中在24 h时二者差异最大,达显著水平。因此,24 h时可作为后续野生茄材料WRKY1基因的相对表达量与其病情指数的相关分析取样时间点。
2. 6 野生茄材料WRKY1基因的相对表达量与病情指数的相关分析结果
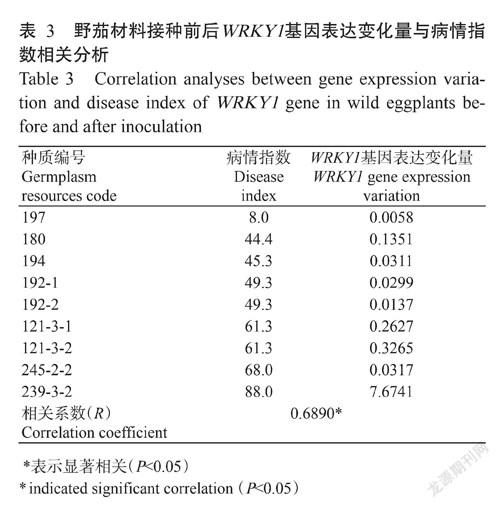
对9种野茄材料进行黄萎病抗性鉴定,结果(表3)显示,蒜芥茄(种质编号197)病情指数为8,属于高抗材料;180、194、192-1和192-2的病情指数为35~55,属于中抗材料;121-3-1、121-3-2和245-2-2的病情指数为55~75,属于感病材料;而239-3-2的病情指数为88,属于高感材料。利用qRT-PCR检测9种野生茄材料接种黄萎病病原菌24 h后叶片中WRKY1基因的相对表达量,并计算其与对照组之间的差值(基因表达变化量),结果(表3)显示,所有植株在接种黄萎病病原菌24 h后体内WRKY1基因的相对表达量较对照组发生变化。利用SPSS 22.0对表达变化量与病情指数进行相关分析,结果(表3)显示9种野生茄材料的病情指数与接种前后WRKY1基因表达变化量呈显著正相关,相关系数(R)为0.6890。
3 讨论
WRKY转录因子在植物复杂的调控网络中扮演着重要的角色(Rushton et al.,2010),近年来相关研究主要集中在模式植物的基因克隆、蛋白的功能研究,对茄子中WRKY转录因子的研究较少。由于本課题组前期转录组测序获得的WRKY1基因CDS序列不完整,为了获得完整的基因序列,本研究利用染色体步移技术从蒜芥茄克隆获得SsWRKY1基因完整ORF序列,将其编码的氨基酸序列与番茄、烟草等其他10种植物的WRKY1蛋白氨基酸序列高度相似,相似性达75.82%,其中WRKY功能结构域的一致性为100.00%,表明本研究克隆结果准确,方法可行,为克隆WRKY基因不完整序列提供技术参考。虽然现已证实WRKY转录因子在植物抗病过程中发挥重要作用,但有关WRKY基因及其编码蛋白的功能在茄子黄萎病抗性中的研究报道较少。本研究以黄萎病高抗材料蒜芥茄为研究对象,克隆得到黄萎病抗性候选基因SsWRKY1,并对其进行生物信息学及表达特征分析,不仅能为后续研究SsWRKY1基因的生物学功能打下基础,也为其他植物黄萎病抗性相关WRKY基因的挖掘鉴定及利用提供参考依据。
根据WRKY转录因子保守结构域的数量和锌指结构的特征,可将WRKY家族分为3类:Ⅰ类WRKY家族成员含有2个WRKY保守结构域,其锌指结构类型为C2H2型;Ⅱ和Ⅲ类成员均只含有1个WRKY结构域,但Ⅱ类成员的锌指结构为C2H2型,Ⅲ类成员的却是C2HC型(Eulgem et al.,2000)。本研究通过氨基酸序列比对发现,SsWRKY1蛋白的第433~597位和第964~1137位氨基酸各含有1个WRKY保守结构域和1个C2H2锌指结构,由此推测SsWRKY1属于Ⅰ类WRKY转录因子。研究发现,Ⅰ类WRKY起源最早(Ulker et al.,2004),而Ⅱ类是Ⅰ类WRKY丢失1个WRKY保守结构域形成的(Xie et al.,2005)。由此推测,SsWRKY1基因在蒜芥茄WRKY基因家族成员中起源较早,其与蒜芥茄Ⅱ和Ⅲ类WRKY基因家族成员的关系尚待研究。
较多研究表明,WRKY转录因子定位于细胞核内,如番茄SlWRKY6(周涛等,2020)、烟草NtWRKY53(刘万峰等,2021)和马铃薯StWRKY8(薛珍等,2015)。本研究首先通过Cell-PLoc 2.0对SsWRKY1蛋白的亚细胞定位进行预测,结果显示其可能位于细胞核中。为了进一步验证预测结果,利用烟草瞬时表达系统对SsWRKY1蛋白进行亚细胞定位验证,结果发现其确实位于细胞核中,符合转录因子特征,表明其可能参与细胞核基因转录水平的调控,与上述前人研究结果一致。
研究发现,烟草NtWRKY基因(向小华等,2016)、茄子SmWRKY65基因(刘开等,2021)和甘薯IbWRKY75基因(刘世芳等,2020)在根、茎和叶中均有表达,但不同基因在不同组织中的表达水平不同。qRT-PCR检测结果显示,SsWRKY1基因在蒜芥茄根中的相对表达量最高,在叶片中的相对表达量较低,与水茄StWRKY1的表达结果(李笑,2018)一致。目前,已有研究证实,WRKY基因的表达受到各种生物和非生物胁迫因子的诱导(李笑等,2017)。本研究发现,对照组中SsWRKY1基因的相对表达量呈先升高后降低再升高的变化趋势,2个拐点分别出现在24和48 h,而黄萎病病原菌处理组中,SsWRKY1基因的相对表达量呈先降低再升高的变化趋势,48 h为SsWRKY1基因相对表达量的最低点。因此,接种后的24和48 h是研究抗黄萎病基因的关键时间点,该结论在前人研究(Gayoso et al.,2010;Tan et al.,2015;李笑,2018)中也得到证实。本研究中,由于24 h时SsWRKY1基因相对表达量在处理组与对照组间差异最大,且达到显著水平,故选择黄萎病病原菌接种处理24 h作为后续研究SsWRKY1基因在蒜芥茄黄萎病抗病过程中的重要时间节点。此外,本研究对9种野生茄材料接种黄萎病病原菌后的病情指数与WRKY1基因表达变化量进行相关分析,结果显示二者之间呈显著正相关,由于病情指数与抗病性呈负相关,因此推测WRKY1基因可能在蒜芥茄抗黄萎病过程中起负调控作用。该研究结果进一步确认了WRKY1基因与植物黄萎病抗性紧密相关。虽然本研究中仅有9种野生茄材料参与相关分析,但其涵盖了不同黄萎病抗性水平的材料,可在一定程度上反映出WRKY1基因的表达水平与黄萎病抗性之间的关系,为后续筛选抗性基因提供研究思路。
4 结论
SsWRKY1属于第Ⅰ类WRKY转录因子,序列高度保守,在细胞核中表达,其基因具有组织表达特异性,黄萎病菌胁迫后该基因的表达下调,推测WRKY1在野生茄黄萎病抗性中起负调控作用。
参考文献:
郭堂勋,王益奎,莫贱友,王艳娜,黄穗萍,李其利,唐利华. 2015. 茄子品种资源对黄萎病的抗性鉴定[J]. 南方农业学报,46(11):1975-1979. [Gou T X,Wang Y K,Mo J Y,Wang Y N,Huang S P,Li L Q,Tang L H. 2015. Resistance identification of eggplant variety resources to verticillium wilt[J]. Journal of Southern Agriculture,46(11):1975-1979.] doi:10.3969/j:issn.2095-1191.2015.11.1975.
李笑,成玉富,杨旭. 2017. 茄科植物WRKY转录因子的研究进展[J]. 园艺学报,44(1):170-178. [Li X,Cheng Y F,Yang X. 2017. Research progress of WRKY transcription factors in Solanaceae plants[J]. Acta Horticulturae Sinica,44(1):170-178.] doi:10.16420/j.issn.0513-353x.2016-0703.
李笑. 2018. 水茄抗黄萎病相关StWRKY-1基因的克隆与功能分析[D]. 扬州:扬州大学. [Li X. 2018. Cloning and functional analysis of the StWRKY-1 gene from Solanum torvum[D]. Yangzhou:Yangzhou University.]
劉开,余炳伟,李丹丹,陈娜,曹必好. 2021. 茄子SmWRKY65基因克隆及其对青枯病的抗性分析[J]. 广东农业科学,48(3):42-52. [Liu K,Yu B W,Li D D,Chen N,Cao B H. 2021. Cloning of SmWRKY65 gene and its resistance to bacterial wilt in eggplant[J]. Guangdong Agricultural Sciences,48(3):42-52.] doi:10.16768/j.issn.1004-874X. 2021.03.006.
刘世芳,刘霞宇,张洁,刘俊卿,唐锐敏,贺立恒,贾小云. 2020. 甘薯IbWRKY75的克隆、亚细胞定位及表达特性分析[J]. 植物生理学报,56(5):969-980. [Liu S F,Liu X Y,Zhang J,Liu J Q,Tang R M,He L H,Jia X Y. 2020. Cloning,subcellular localization and expression analysis of IbWRKY75 in Ipomoea batatas[J]. Plant Physiology Journal,56(5):969-980.]doi:10.13592/j.cnki.ppj.2019.0594.
刘万峰,蒲文宣,杨爱国,高军平,王奇,孙明铭,张新要,孙楠,陈凯,王国平,李晓旭. 2021. 普通烟草NtWRKY53基因克隆、鉴定及表达分析[J]. 烟草科技,54(1):1-9. [Liu W F,Pu W X,Yang A G,Gao J P,Wang Q,Sun M M,Zhang X Y,Sun N,Chen K,Wang G P,Li X X. 2021. Cloning,characterization and expression pattern analysis of NtWRKY53 gene in Nicotiana tabacum[J]. Tobacco Science & Technology,54(1):1-9.] doi:10.16135/j.issn 1002-0861.2020.0228.
吴丽艳,郭志祥,曾莉,鲍锐,黎志彬,龚亚菊. 2017. 云南野生茄资源黄萎病苗期人工接种抗性鉴定分析[J]. 植物遗传资源学报,18(6):1046-1054. [Wu L Y,Gou Z X,Zeng L,Bao R,Li Z B,Gong Y J. 2017. Resistance identification of Yunnan wild eggplant resources to verticillium wilt[J]. Journal of Plant Genetic Resources,18(6):1046-1054.] doi:10.13430/j.cnki.jpgr.2017.06.007.
向小华,吴新儒,晁江涛,杨明磊,杨帆,陈果,刘贯山,王元英. 2016. 普通烟草WRKY基因家族的鉴定及表达分析[J]. 遗传,38(9):840-862. [Xiang X H,Wu X R,Chao J T,Yang M L,Yang F,Chen G,Liu G S,Wang Y Y. 2016. Genome-wide identification and expression analysis of the WRKY gene family in common tobacco (Nicotiana tabacum L.)[J]. Hereditas,38(9):840–862.]doi:10.16288/j.yczz.16-016.
薛珍,李卉,孔超越,段婷婷,郜刚. 2015. 受青枯菌诱导表达的马铃薯转录因子类StWRKY8的克隆与表达分析[J]. 中国农业科学,48(21):4219-4226. [Xue Z,Li H,Kong C Y,Duan T T,Gao G. 2015. Cloning and expression analy-sis of the potato transcription factor StWRKY8 like gene induced by Ralstonia solanacearum[J]. Scientia Agricultura Sinica,48(21):4219-4226.] doi:10.3864/j.issn.0578- 1752.2015.21.003.
张计育,佟兆国,高志红,罗昌国,渠慎春,章镇. 2011. SA、MeJA、ACC和苹果轮纹病病原菌诱导湖北海棠MhWRKY1基因的表达[J]. 中国农业科学,44(5):990-999. [Zhang J Y,Tong Z G,Gao Z H,Luo C G,Qu S C,Zhang Z. 2011. Expression of MhWRKY1 gene induced by the elicitors SA,MeJA,ACC and the apple ring spot pathogen[J]. Scientia Agricultura Sinica,44(5):990-999.]doi:10.3864/j.issn.0578-1752.2011.05.016.
鄭殿升,高爱农,李立会,刘旭. 2013. 云南及周边地区农作物野生近缘植物[J]. 植物遗传资源学报,14(2):193-201. [Zheng D S,Gao A N,Li L H,Liu X. 2013. Wild relatives of agricultural crop in Yunnan Province and its peripheral area[J]. Journal of Plant Genetic Resources,14(2):193-201.]doi:10.3969/j.issn.1672-1810.2013.02.001.
周涛,王娟,胡佳蕙,王柏柯,李宁,余庆辉. 2020. 番茄转录因子基因SlWRKY6的克隆与原核表达分析[J]. 西北植物学报,40(11):1824-1832. [Zhou T,Wang J,Hu J H,Wang B K,Li N,Yu Q H. 2020. Cloning and prokaryotic expression analysis of a WRKY transcription factor gene SlWRKY6 in Solanum lycopersicum[J]. Acta Botanica Boreali-Occidentalia Sinica,40(11):1824-1832.]doi:10. 7606/j.issn.1000-4025.2020.11.1824.
庄勇,王述彬. 2009. 茄子近缘种黄萎病抗性鉴定及遗传分析[J]. 江苏农业学报,25(4):847-850. [Zhuang Y,Wang S B. 2009. Identification and inheritance of verticillium wilt resistance in eggplant related species[J]. Jiangsu Journal of Agricultural Sciences,25(4):847-850.]doi:10.3969/j.issn.1000-4440.2009.04.026.
Collonnier C,Fock I,Kashyap V,Rotino G L,Daunay M C,Lian Y,Mariska I K,Rajam M V,Servaes A,Ducreux G,Sihachakr D. 2001. Applications of biotechnology in eggplant[J]. Plant Cell Tissue and Organ Culture,65(2):91-107. doi:10.1023/A:1010674425536.
Cui J,Jiang N,Meng J,Yang G L,Liu W W,Zhou X X,Ma N,Hou X X,Luan Y S. 2019. LncRNA33732-respiratory burst oxidase module associated with WRKY1 in tomato-Phytophthora infestans interactions[J]. The Plant Journal,97(5):933-946. doi:10.1111/tpj.14173.
Dang F F,Wang Y N,She J J,Lei Y F,Liu Z Q,Eulgem T,Lai Y,Lin J,Yu L,Lei D,Guan D Y,Li X,Yuan Q,He S L. 2014. Overexpression of CaWRKY27,a subgroup IIe WRKY transcription factor of Capsicum annuum,posi-tively regulates tobacco resistance to Ralstonia solana-cearum infection[J]. Physiologia Plantarum,150(3):397-411. doi:10.1111/ppl.12093.
Eulgem T,Rushton P J,Robatzek S,Somssich I E. 2000. The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science,5(5):199-206. doi:10.1016/S1360-1385(00)01600-9.
Fang X,Meng X,Cao S,Tang X,Fan T. 2021. AtWRKY1 negatively regulates the response of Arabidopsis thaliana to Pst. DC3000[J]. Plant Physiology and Biochemistry,166(1):799-806. doi:10.1016/J.PLAPHY.2021.06.044.
Fradin E F,Thomma B P H J. 2010. Physiology and molecular aspects of verticillium wilt diseases caused by V. dahliae and V. alboatrum[J]. Molecular Plant Pathology,7(2):71-86. doi:10.1111/j.1364-3703.2006.00323.x.
Freeborough W,Gentle N,Rey M E C. 2021. WRKY transcription factors in cassava contribute to regulation of to-lerance and susceptibility to cassava mosaic disease through stress responses[J]. Viruses,13(9):1820. doi:10.3390/V13091820.
Gayoso C,Pomar F,Novo-Uzal E,Merino F,de Ilárduya Ó M. 2010. The Ve-mediated resistance response of the tomato to Verticillium dahliae involves H2O2,peroxidase and lignins and drives PAL gene expression[J]. BMC Plant Biology,10(1):232. doi:10.1186/1471-2229-10-232.
Higuera J J,Garrido-Gala J,Lekhbou A,Arjona-Girona I,Caballero J L. 2019. The strawberry FaWRKY1 transcription factor negatively regulates resistance to Colletotrichum acutatum in fruit upon infection[J]. Frontiers in Plant Science,10:480. doi:10.3389/fpls.2019.00480.
Hofmann M G,Sinha A K,Proels R K,Roitsch T. 2008. Cloning and characterization of a novel LpWRKY1 transcription factor in tomato[J]. Plant Physiology and Biochemistry,46(5):533-540. doi:10.1016/j.plaphy.2008.02.009.
Inderbitzin P,Bostock R M,Davis R M,Usami T,Platt H W,Subbarao K V. 2011. Phylogenetics and taxonomy of the fungal vascular wilt pathogen verticillium,with the descriptions of five new species[J]. PLoS One,6(12):e28341. doi:10.1371/journal.pone.0028341.
Li C,He X,Luo X Y,Xu L,Liu L L,Min L,Jin L,Zhu L F,Zhang X L. 2014. Cotton WRKY1 mediates the plant defense-to-development transition during infection of cotton by Verticillium dahliae by activating JASMONATE ZIM-DOMAIN1 expression[J]. Plant Physiology,166(4):2179-2194. doi:10.1104/pp.114.246694.
Li J B,Luan Y S,Liu Z. 2015. Overexpression of SpWRKY1 promotes resistance to Phytophthora nicotianae and toleran-ce to salt and drought stress in transgenic tobacco[J]. Physiologia Plantarum,155(3):248-266. doi:10.1111/ppl. 12315.
Long Q,Du M X,Long J H,Xie Y,Zhang J Y,Xu L Z,He Y,Li Q,Chen S C,Zou X P. 2021. Transcription factor WRKY22 regulates canker susceptibility in sweet orange (Citrus sinensis Osbeck) by enhancing cell enlargement and CsLOB1 expression[J]. Horticulture Research,8(1):50. doi:10.1038/S41438-021-00486-2.
Marchive C,Léon C,Kappel C,Coutos-Thévenot P,Corio-Costet M,Delrot S,Lauvergeat V. 2018. Over-expression of VvWRKY1 in grapevines induces expression of jasmonic acid pathway-related genes and confers higher tolerance to the downy mildew[J]. PLoS One,8(1):e54185. doi:10.1371/journal.pone.0054185.
Oh S K,Baek K H,Park J M,Yi S Y,Yu S H,Kamoun S,Choi D. 2008. Capsicum annuum WRKY protein Ca-WRKY1 is a negative regulator of pathogen defense[J]. New Phytologist,177(4):977-989. doi:10.1111/j.1469-8137.2007. 02310.x.
Pandey S,Somssich I. 2009. The role of WRKY transcription factors in plant immunity[J]. Plant Physiology,150(4):1648-1655. doi:10.1104/pp.109.138990.
Rushton P J,Somssich I E,Ringler P,Shen Q J. 2010. WRKY transcription factors[J]. Trends in Plant Science,15(5):247-258. doi:10.1016/j.tplants.2010.02.006.
Sonia E V,Maldonado A M,Francisco A R,de Los Santos Berta,Fernando R,Fernando P,Juan M B,Caballero J L. 2009. Evidence for a positive regulatory role of strawberry (Fragaria×ananassa) FaWRKY1 and Arabidopsis AtWRKY75 proteins in resistance[J]. Journal of Experimental Botany,60(11):3043-3065. doi:10.1093/jxb/erp152.
Tan G X,Liu K,Kang J M,Xu K D,Zhang Y,Hu L Z,Zhang J,Li C W. 2015. Transcriptome analysis of the compatible interaction of tomato with Verticillium dahliae using RNA-sequencing[J]. Frontiers in Plant Science,6:428. doi:10.3389/fpls.2015.00428.
Ulker B,Somssich I E. 2004. WRKY transcription factors:From DNA binding towards biological function[J]. Current Opinion in Plant Biology,7(5):491-498. doi:10.1016/j.pbi.2004.07.012.
Wang X,Li J J,Guo J,Qiao Q,Guo X,Ma Y. 2020. The WRKY transcription factor PlWRKY65 enhances the resistance of Paeonia lactiflora (herbaceous peony) to Alternaria tenuissima[J]. Horticulture Research,7(1):57. doi:10.1038/s41438-020-0267-7.
Xie Z,Zhang Z L,Zou X L,Huang J,Ruas P,Thompson D,Shen Q X. 2005. Annotations and functional analyses of the rice WRKY gene superfamily reveal positive and nega-tive regulators of abscisic acid signaling in aleurone cells[J]. Plant Physiology,137(1):176-189. doi:10.1104/pp. 104.054312.
收稿日期:2021-09-17
基金項目:国家自然科学基金地区基金项目(31960594);云南省应用基础研究面上项目(2019FB059);云南省农业基础研究联合专项面上项目(2018FG001-022)
通讯作者:龚亚菊(1965-),https://orcid.org/0000-0002-7961-6523,研究员,主要从事蔬菜育种与栽培研究工作,E-mail:gongyaju@sina.com;吴丽艳(1981-),https://orcid.org/0000-0003-2974-6765,副研究员,主要从事蔬菜育种与栽培研究工作,E-mail:wly@yaas.org.cn
第一作者:尹梦莹(1996-),https://orcid.org/0000-0002-5851-6275,主要从事蔬菜分子辅助育种研究工作,E-mail:YinDream19@163.com
