冷冻消融治疗对肺腺癌细胞凋亡的影响
2022-07-13林事成刘殿娜庄垚雪梁天宇王潇凡胡凯文李泉旺
林事成,刘殿娜,庄垚雪,梁天宇,王潇凡,胡凯文,李泉旺
肺癌是最常见的恶性肿瘤之一,中国的发病率和病死率均排在第一[1],由于早期的肺癌症状不明显,多数病人发现时就已经是晚期,无法进行手术根治。冷冻消融是新兴的肿瘤微创治疗手段,安全有效,不良事件发生率低。已在前列腺癌、肺癌、肝癌等多种实体肿瘤上取得良好临床治疗效果。冷冻消融治疗过程中,在最大限度消灭肿瘤的同时又要保护正常组织,很难保证所有癌组织都能达到致死温度,将会形成一圈亚致死区。冷冻消融后残存肿瘤细胞及肿瘤微环境与肿瘤的复发、转移密切相关。冷冻消融后对残留肿瘤细胞存在的后续杀伤作用及其具体机制尚不明确。该课题将利用细胞实验和动物实验验证冷冻消融对肺癌细胞凋亡的影响,并初步探索其作用机制,以期为冷冻消融的临床应用提供新的实验依据。
1 材料与方法
1.1 材料人肺癌H1299细胞株(武汉普诺赛生命科技有限公司);小鼠肺癌Lewis细胞株(江苏凯基生物技术股份有限公司);SPF级雄性C57BL/6小鼠共8只(北京斯贝福生物技术有限公司),6周龄,体质量(20±2)g,许可证号:SCXK(京)2019-0010;氩氦刀冷冻治疗系统及1.2 mm冷冻刀头(美国Endocare公司);RPMI-1640培养基、DMEM高糖培养基(美国Hyclon公司);胎牛血清(美国Merck公司);Annexin V-Fitc/PI双染试剂盒(江苏凯基生物公司);Reveraid First Strand cDNA Synthesis Kit试剂盒(美国Thermo Fisher公司);SYBR qPCR SuperMix Plus试剂盒(苏州近岸蛋白公司);Bax及Bcl-2多克隆抗体及山羊抗兔(鼠) IgG二抗(武汉Proteintech公司)。
1.2 方法
1.2.1细胞培养 RPMI-1640完全培养基(RPMI-1640+10 %胎牛血清+1 %双抗)培养H1299细胞,DMEM高糖培养基(DMEM高糖+10 %胎牛血清+1 %双抗)培养Lewis细胞,均置于恒温细胞孵育箱中培养,待细胞生长至70%时进行传代,约2~3 d传代1次。
1.2.2细胞冷冻模型建立及分组 收集对数生长期的H1299细胞,调整细胞浓度5×105个/ml,取5 ml装入冻存管中,将其放入-80 ℃冰箱中冷冻7 min,37 ℃水浴复温,模拟亚致死区细胞;另外取5 ml细胞悬液装入冻存管中,将其放入液氮冷冻5 min,37 ℃水浴复温,模拟坏死细胞,离心收集细胞上清液,可得细胞坏死液。实验分组A组:正常细胞+完全培养基(未冷冻区域);B组:正常细胞+坏死液培养,完全培养基2 ∶1(接近冷冻区域正常细胞);C组:亚致死细胞+完全培养基(远离坏死的亚致死区);D组:亚致死细胞加坏死液培养,完全培养基2 ∶1(接近坏死的亚致死区)。各组以每孔5×105个细胞加入6孔板培养24 h后按上述分组加入不同培养液,继续培养24 h,收集细胞进行下一步实验。
1.2.3流式细胞术 各组细胞干预培养24 h后,PBS洗涤2次,离心并计数调整细胞数目为5×105个,加入500 μl的Binding Buffer重悬,再加入5 μl Annexin V-FITC 混匀后,最后加5 μl Propidium Iodide,振荡混匀,室温,避光反应15 min,用流式细胞仪分析细胞凋亡情况。
1.2.4Western blot实验 各组细胞经PBS洗涤3遍,加入RIPA裂解液150 μl,冰上裂解30 min,离心取上清液,BCA法进行蛋白定量,样品100 ℃变性,每组蛋白上样30 μg,120 V恒压电泳,100 V恒压转膜,10%脱脂奶粉封闭1 h,加入兔多克隆蛋白一抗工作液Bax(1 ∶8 000)、Bcl-2(1 ∶1 000)、GAPDH(1 ∶50 000)室温孵育1.5 h或4 ℃过夜,加入兔二抗(1 ∶10 000)室温孵育1 h,超敏ECL发光检测,使用Image J软件测量不同条带灰度值。
1.2.5荧光定量PCR技术检测Bax和Bcl-2基因的转录水平 根据厂家说明书使用Nucleozol试剂提取总RNA,逆转录成cDNA,qRT-PCR法检测Bax和Bcl-2 mRNA的表达,内参基因为β-actin,设定仪器运行程序为:95 ℃、1 min,95 ℃、20 s,60 ℃、1 min,共40个循环。引物序列Bax上游:5′-CGAACTGGACAGTAACATGGAG-3′,下游:5′-CAGT TTGCTGGCAAAGTAGAAA-3′;Bcl-2上游:5′-GACT TCGCCGAGATGTCCAG-3′,下游:5′-GAACTCAAA GAAGGCCACAATC-3′;β-actin上游:5′-CCTGGCAC CCAGCACAAT-3′,下游:5′-GGGCCGGACTCGTCAT AC-3′。按照2-ΔΔCt计算Bax和Bcl-2 mRNA的相对表达量。
1.2.6Lewis肺癌小鼠皮下移植瘤模型的建立 取对数生长期Lewis细胞,胰酶消化,DMEM基础培养基重悬,计数并调整细胞浓度为1×107个/ml,每只小鼠于右腿内侧皮下接种0.2 ml,约10 d,小鼠种植瘤瘤径可长至10 mm×10 mm,造模成功,开始实验。
1.2.7小鼠冷冻方案及分组 将实验小鼠通过随机数字法分为假手术组和冷冻组,每组各4只,冷冻组小鼠进行腹腔注射麻醉,固定于操作台,备皮,消毒,划开皮肤,暴露肿瘤组织,将1.2 mm冷冻刀头植入肿瘤中心。启动仪器,使肿瘤中心温度迅速降低至-120 ℃冷冻10 s,复温至15 ℃,继续上述冷冻过程1次。假手术组仅麻醉后划开皮肤,未做任何处理,直接缝合。每2 d消毒伤口,术后14 d,处死小鼠,完整剥离肿瘤组织。
1.2.8Western blot检测肿瘤组织中Bax和Bcl-2蛋白的相对表达水平 取50 mg组织加入强效RIPA裂解液500 μl,使用低温冷冻研磨仪充分研磨组织,离心取上清液,BCA法进行蛋白定量,样品100 ℃变性,每组蛋白上样30 μg,120 V恒压电泳,100 V恒压转膜,10%脱脂奶粉封闭1 h,加入兔多克隆蛋白一抗工作液Bax(1 ∶8 000)、Bcl-2(1 ∶1 000)、GAPDH(1 ∶50 000)室温孵育1.5 h,加入兔二抗(1 ∶10 000)室温孵育1 h或4 ℃过夜,超敏ECL发光检测,使用Image J软件测量不同条带灰度值。
1.2.9qRT-PCR检测肿瘤组织Bax和Bcl-2基因的转录水平 根据厂家说明书使用Nucleozol试剂提取总RNA,逆转录成cDNA,qRT-PCR法检测Bax和Bcl-2 mRNA的表达,内参基因为β-actin,反应程序为:95 ℃、60 s,95 ℃、20 s,60 ℃、60 s,共40个循环。Bax上游:5′-TTGCCCTCTTCTACTTTGCTAG-3′,下游:5′-CCATGATGGTTCTGATCAGCTC-3′;Bcl-2上游:5′-GATGACTTCTCTCGTCGCTAC-3′,下游:5′-GAACTCAAAGAAGGCCACAATC-3′;β-actin上游:5′-CTACCTCATGAAGATCCTGACC-3′,下游:5′-CACAGCTTCTCTTTGATGTCAC-3′。运用2-ΔΔCt法计算Bax和Bcl-2 mRNA的相对表达量。

2 结果
2.1 冷冻对H1299细胞凋亡的影响结果显示,肺癌细胞冷冻模型中B、C、D组的细胞凋亡率分别为(23.97±1.007)、(26.37±1.258)、(39.80±1.044)均高于对照组A组(15.70±4.355),且D组细胞凋亡率最高,高于其他组(F=52.957,P<0.05)。见图1。这说明冷冻细胞坏死后,坏死液可以促进残余肿瘤细胞凋亡,且越接近冷冻区域,对细胞的影响越大。

图1 细胞冷冻消融模型中各组H1299肺癌细胞凋亡情况(n=3)
2.2 冷冻对H1299细胞Bax和Bcl-2的mRNA和蛋白表达的影响Western blot和qRT-PCR实验结果表明,在H1299肺癌细胞冷冻模型中,与A组相比,B、C、D组能够促进Bax mRNA和蛋白的表达,且在mRNA水平上,C、D组Bax表达量高于A、B组,差异有统计学意义(F=162.165,P<0.05),Western blot结果显示B、C、D组Bax蛋白的含量高于A组,差异有统计学意义(F=4.906,P<0.05)。而Bcl-2的检测结果显示,mRNA相对表达量和蛋白表达量各组间差异均无统计学意义(F=0.242,P>0.05)。见图2。提示冷冻引起的H1299人肺腺癌细胞凋亡可能与Bax的调节密切相关。

图2 各组H1299细胞凋亡相关分子mRNA及蛋白相对表达情况(n=3)
2.3 冷冻消融对小鼠肿瘤凋亡相关分子表达的影响Western blot和qRT-PCR结果表明,与假手术组小鼠相比,经氩氦刀冷冻消融后小鼠肿瘤组织中Bax蛋白及mRNA表达水平均升高(t蛋白=5.253,P蛋白<0.05;tmRNA=4.889,PmRNA<0.05),而Bcl-2蛋白和mRNA表达水平均降低(t蛋白=3.3,P蛋白<0.05;tmRNA=3.388,PmRNA<0.05)。见图3。
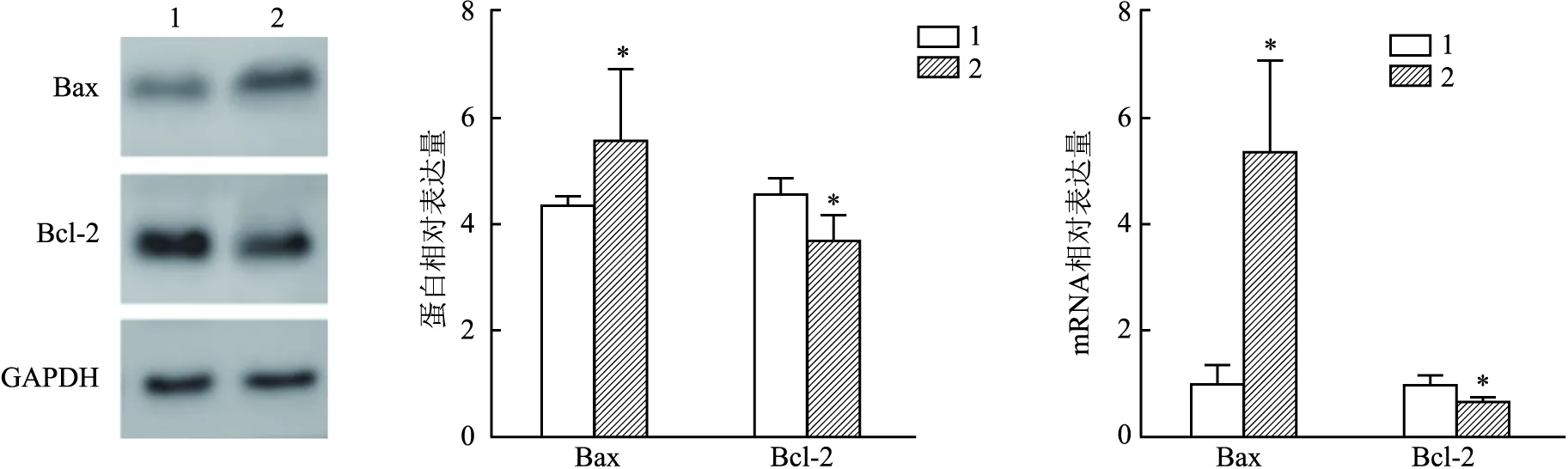
图3 氩氦刀冷冻消融对小鼠Bax、Bcl-2表达情况的影响(n=4)1:假手术组;2:冷冻消融组;与假手术组比较:*P<0.05
3 讨论
冷冻消融技术是一种微创超低温消融肿瘤技术,在肺癌的临床治疗中取得理想疗效,尤其是对中晚期患者提高了生活质量,减轻病痛,延长生存期[2-6]。美国国家综合癌症(NCCN)指南将其收入非小细胞肺癌治疗方案,作为部分无法被外科手术切除的肺癌患者的替代疗法。冷冻消融通常以氩气或液氮为冷冻媒介,通过短时间在肿瘤区形成-140~-160 ℃的冷冻冰球,再逐渐复温,从而达到在冷冻冰球区域裂解坏死肿瘤细胞的目的[3]。但随着肿瘤组织与刀尖距离的增加,温度将会不断上升,形成部分低温亚致死细胞及部分残留肿瘤细胞。该研究利用基础实验观察中心区域细胞裂解坏死液对残余肿瘤及亚致死肿瘤的迟发凋亡反应,对临床手术方案的设计,尤其是晚期减瘤姑息治疗中残留组织的解决有重大意义。
该研究利用不同温度干预的H1299肺癌细胞模拟体内冷冻冰球不同区域内细胞状态,同时B组和C组加入细胞坏死液验证细胞冷冻坏死产物对不同状态细胞凋亡情况的影响。实验结果表明冷冻消融后能通过细胞凋亡作用继续对残余肿瘤细胞造成杀伤作用,并且受低温损伤的肿瘤细胞凋亡效果更显著。
该实验进一步探讨了冷冻消融后引起肿瘤细胞凋亡的具体作用机制。研究结果表明Bcl-2家族在其中发挥着关键作用。Bcl-2家族是调控细胞凋亡的重要蛋白,与恶性肿瘤的发生发展密切相关。Bcl-2家族可以被分为抗凋亡因子及促凋亡因子两大类,其中抗凋亡因子Bcl-2和亲凋亡因子Bax是线粒体凋亡的两个关键调节器。当Bax被激活,大量的Bax同源二聚体占主导地位,转位至线粒体外膜上,诱导线粒体外膜的通透性,细胞容易发生程序性坏死[7]。Bcl-2在多种肿瘤中高表达,是主要的抗凋亡蛋白,可通过调节细胞氧化反应,抑制氧化作用对细胞的破坏,并且通过抑制Bax的细胞凋亡作用,促进肿瘤细胞的增殖[8]。目前认为Bcl-2/Bax的比值与细胞凋亡作用具有重要关系。该次细胞冷冻模型的实验结果表明冷冻消融可以有效的促进Bax表达的上调,且相对表达量变化的规律与流式凋亡检测结果大致相仿,Lewis小鼠冷冻实验的结果进一步验证了冷冻消融后凋亡与Bax表达上调密切相关;而Bcl-2表达在细胞水平上未见差异,在Lewis小鼠肿瘤组织中发现冷冻消融组较假手术组Bcl-2在mRNA及蛋白水平的表达均降低,这可能与小鼠体内肿瘤微环境中相互作用相关,有研究[9-10]表明内皮细胞、成纤维细胞分泌的细胞因子能调节Bcl-2表达,而微环境中炎症相关因素也能影响Bcl-2的表达[11-12],因此,体内可能存在其他途径受冷冻消融影响抑制了Bcl-2,进一步降低 Bcl-2/Bax比值,需要深入探索挖掘。
综上所述,冷冻消融肺癌组织后,低温引起肺癌组织发生细胞凋亡。冷冻后低温损伤及中心细胞坏死裂解液的浸润可能通过调节Bcl-2/Bax表达进一步影响残余肺癌细胞的凋亡。因此,在临床冷冻消融治疗施行过程中应尽量使冰球周围温度降低并维持一定的时间,冷冻消融手术后有必要通过中医药、放化疗等治疗手段巩固甚至促进残留肿瘤细胞的凋亡,提高冷冻治疗的效果,减少肿瘤的复发。
