重组PACAP13神经肽对小鼠胸腺功能的影响
2022-07-13吴倩妍刘贞银张华华
吴倩妍,梁 阳,刘贞银,张华华
胸腺是哺乳动物重要的中枢免疫器官,是T细胞发育成熟的重要场所。然而很多情况下,包括常见的病毒感染和精神压力、癌症治疗中使用的化学性和放射性疗法、器官移植后免疫抑制剂的长期使用,都会对胸腺造成损伤,从而影响T细胞发育成熟,导致T细胞短期或长期缺乏;此外,随着年龄的增加,胸腺出现萎缩,促进T细胞发育成熟的能力下降,将进一步加剧T细胞数量缺乏[1]。因此,修复胸腺损伤、促进胸腺再生及增加T细胞生成具有重要临床意义。垂体腺苷酸环化酶激活肽(pituitary adenylatecyclase-activating polypeptide, PACAP)是一种具有多功能的神经多肽,PACAP及其衍生肽具有抑制促炎因子分泌、促进抗炎因子产生的作用,参与T细胞的增殖、分化,具有抑制淋巴细胞凋亡及调节相关免疫功能等作用[2]。PACAP13肽是PACAP(1~13)序列的肽段(HSDGIFTDSYSRY),包含与特异性受体PAC1R的结合域及激活域,是PACAP中具有重要功能的部分[3]。此外,PACAP13肽肽链较短,相比PACAP具有更高的穿透能力,因而可能具有更好地与靶点接触的潜能。该研究旨在探讨PACAP13肽对胸腺淋巴细胞增殖和凋亡作用,胸腺初始T细胞生成作用及其对狼疮模型小鼠胸腺基因转录和自身抗体生成的影响,并初步探究其作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 4~5周龄SPF级Balb/c小鼠,由南方医科大学实验动物中心提供,实验动物合格证号:SCXK(粤)20160041。
1.1.2主要试剂 CCK-8试剂盒(日本同仁化学);鼠抗波形蛋白、鼠抗广谱角蛋白、降植烷、地塞米松 (dexamethasone,Dex)(美国Sigma公司); FITC Annexin V Apoptosis Detection Kit Ⅰ(美国BD公司);Gold ViewⅠ型核酸染料(北京索莱宝科技有限公司);FITC anti-mouse CD44、PE anti-mouse CD34(美国BioLegend公司);小鼠ELISA细胞因子检测试剂盒(上海酶联生物科技有限公司);血液/细胞/组织全基因DNA抽提试剂盒(北京天根生化科技有限公司);PCR引物PAGE纯化、DEPC水(上海捷瑞生物工程有限公司);TAKARA TaqTMPCR试剂盒、DL150000 DNA Marker(大连TaKaRa公司);SYBR Green qPCR SuperMix UDG试剂盒(美国invitrogen公司);小鼠抗核抗体(antinuclear antibody, ANA)、抗dsDNA抗体、抗核糖核蛋白/史密斯(ribonucleoprotein/smith, RNP/sm)抗体及免疫球蛋白G(immunoglobulin G, IgG)定量ELISA试剂盒(上海西唐生物科技有限公司)。
1.1.3主要仪器 FACS Canto Ⅱ流式细胞仪(美国BD公司);多功能酶标仪(美国BioTek公司);台式高速离心机TGL-16B(上海安亭科学仪器厂);CO2细胞培养箱、NanoDrop 5000(美国Thermo公司);EDC-810普通PCR仪(北京东胜创新生物科技有限公司);电泳仪(北京六一仪器厂);ABI7500实时荧光定量PCR仪(美国Applied Biosystems公司);倒置显微镜(重庆奥特光学仪器有限公司);台式冰冻离心机(上海力申科学仪器有限公司)。
1.2 方法
1.2.1胸腺上皮细胞(thymus epithelial ecll, TEC)和骨髓间充质干细胞(mesenchymal stem cell, MSC)的培养及PACAP13肽对胸腺细胞增殖、凋亡作用的检测
1.2.1.1TEC和MSC的培养及分组 处死Balb/c小鼠后,无菌取胸腺和双侧股骨和胫骨。胸腺置于DMEM培养液中清洗并剥离周围结缔组织和血管,剪成小于1 mm×1 mm×1 mm的块状,放置于培养瓶中,加入含10%胎牛血清DMEM培养液;股骨和胫骨用镊子去除周围组织并清洗,剪去骨头两端,用无菌注射器吸取培养液从一端冲洗骨髓腔内容物到无菌培养皿中,直至骨髓腔变透明,将培养皿中的培养基转移至培养瓶中。培养瓶置于37 ℃、5%CO2的培养箱中,每2 d换1次培养液,待细胞铺满底部80%左右,进行传代。原代培养的TEC和MSC传至二代,分别进行免疫组化法观察波形蛋白和广谱角蛋白表达及细胞表面抗原CD34和CD44检测,取纯度较高的细胞进行下一步实验。TEC和MSC的浓度调整为1×105/ml,根据细胞的组成分为4组,即淋巴细胞组、淋巴细胞+TEC组、淋巴细胞+MSC组和淋巴细胞+TEC+MSC组(TEC ∶MSC=1 ∶1)。淋巴细胞组直接加入胸腺淋巴细胞单细胞悬液(处死Balb/c小鼠取出胸腺组织,用研磨器在300目滤网上研磨并用培养基冲洗获得),其他组预先加入TEC和MSC到细胞培养板中,待细胞贴壁生长至融合率达80%,去除培养板中的培养基,随后加入胸腺淋巴细胞单细胞悬液。胸腺淋巴细胞单细胞悬液浓度为2×105/ml。
1.2.1.2PACAP13肽对淋巴细胞增殖作用的检测 用上述方法将4组细胞铺于96孔板,每组设6个孔,其中3个孔加入终浓度为10-5mol/L的PACAP13肽作为PACAP13组,其余3孔加入等量培养基作为对照组,并设无细胞纯培养基的空白孔。在37 ℃、5%CO2的培养箱中培养48 h后将孔内含悬浮的胸腺淋巴细胞的培养基转移至新的96孔板中并加入10 μl CCK-8,3 h后酶标仪检测在450 nm的OD值,计算胸腺淋巴细胞增殖率。细胞增殖率=(APACAP13组-A空白孔)/(A对照组-A空白孔)。实验重复3次。
1.2.1.3PACAP13肽对淋巴细胞凋亡作用的检测 用上述方法将4组细胞铺于24孔板,每组设6个孔,加入浓度为10-6mol/L的Dex诱导细胞凋亡,3孔加入终浓度为10-5mol/L的PACAP13肽作为PACAP13组,其余3孔加入等量培养基作为对照组,在37 ℃、5%CO2的培养箱中培养48 h后,吸取孔内含悬浮的胸腺淋巴细胞的培养基离心收集胸腺淋巴细胞,AnnexinⅤ-FITC/PI双染色,流式细胞仪检测细胞的凋亡情况,实验重复3次。
1.2.2胸腺体外培养 根据与胸腺共培养细胞的种类将实验分为4组,即胸腺组(仅有胸腺)、胸腺+TEC组(胸腺与TEC共培养)、胸腺+MSC组(胸腺与MSC共培养)和胸腺+TEC+MSC组(胸腺与TEC、MSC共培养,TEC ∶MSC=1 ∶1),每组6个孔。胸腺+TEC组、胸腺+MSC组和胸腺+TEC+MSC组预先将TEC和MSC调整浓度为1×105/ml,接种于24孔板,细胞生长达到80%融合率,将Balb/c小鼠处死后用75%乙醇浸泡2 min,移入超净台无菌操作取胸腺,去除周围结缔组织,放置于培养基中备用,吸走24孔板中的培养基,放入预先挖出小洞的无菌海绵,将胸腺置于海绵挖空的小洞中,加入与海绵持平的培养基,并加入终浓度为10-6mol/L的Dex诱导淋巴细胞凋亡。其中3个孔中加入终浓度为10-5mol/L的PACAP13肽作为PACAP13组,其余3个孔加入等量培养基作为对照组。
1.2.3降植烷诱导狼疮模型小鼠及分组 小鼠单次腹腔注射0.5 ml降植烷注射液,3个月后随机分为PACAP13组和模型组,PACAP13组每天根据体质量按12.5 ml/kg腹腔注射10-5mol/L的PACAP13肽溶液,模型组注射等量0.9%氯化钠溶液,连续注射14 d。
1.2.4qPCR检测体外培养胸腺和狼疮小鼠胸腺、脾脏信号结合T细胞受体删除环(signal joint T cell receptor rearrangement excision cricles, sjTREC)含量 1.2.2项的各组胸腺器官在培养箱培养48 h后,取出胸腺,提取基因组DNA,进行qPCR反应;1.2.3项的狼疮小鼠在PACAP13肽/0.9%氯化钠溶液连续注射14 d结束后处死,收集胸腺及脾脏,提取DNA进qPCR反应。具体方法为:构建TREC和RAG2标准重组质粒,并设置标准质粒阴性对照组、RAG2片段PCR组、TREC片段PCR组、RAG2阳性对照组、TREC阳性和阴性对照组,各组设置两个复管。标准重组质粒以浓度102、103、104、105、106、107、108拷贝/μl建立标准曲线。PCR反应条件为95 ℃、2 min去UDG,95 ℃、10 min预变性,95 ℃、10 s变性,60 ℃、34 s,进行50个循环。根据标准曲线和样本PCR反应Ct值得出样本的TREC和RAG2的拷贝数。以[(sjTREC拷贝数1+sjTREC拷贝数2)/(RAG2拷贝数1+RAG2拷贝数2)]×2×106,计算1×106个细胞中sjTREC的拷贝数。引物序列为:sjTREC,(F)5′-CATTGCCTTTGAACCAAGCTG-3′,(R)5′-TTATGCACAGGGTGCAGGTG-3′;RAG2,(F)5′-TGACGTGGTGTATAGTCGA-3′,(R)5′-TCCTGAAGTTCTGGGAGA-3′。
1.2.5ELISA检测细胞培养液中细胞因子和狼疮小鼠血清自身抗体水平 按1.2.1.1项分组培养的细胞添加终浓度10-5mol/L的PACAP13肽后在37 ℃、5%CO2的培养箱中培养48 h,吸取细胞培养液,根据ELISA试剂盒说明书测定每个样本的IL-1、IL-2、IL-6、TGF的表达水平。狼疮小鼠在PACAP13肽/0.9%氯化钠溶液连续注射14 d结束后经摘眼球取血,血液室温静置20 min后,3 000 r/min离心20 min并收集上层血清,根据说明书测定ANA、抗dsDNA抗体、抗RNP/sm抗体及IgG水平。每个样本和标准品设置双复孔,在450 nm波长下测量OD值,以标准品的梯度浓度和OD值绘制标准曲线,计算各样品的细胞因子含量。
1.2.6RT-PCR检测胸腺基因表达 狼疮小鼠连续14 d注射PACAP13肽/0.9%氯化钠溶液后处死,收集胸腺,提取RNA,去除基因组DNA后进行RT-PCR检测免疫相关基因CXC趋化因子配子13(CXC chemokine ligand-13, CXCL13)、自身免疫调节因子(autoimmune regulatory factor, Aire)、前脑胚锌指状蛋白2(forebrain zinc finger protein 2, Fezf2)、叉头状蛋白3(forkhead box protein 3, Foxp3)和转化生长因子β(transforming growth factor-β, TGF-β)表达水平。反应条件为:37 ℃、15 min,85 ℃、5 s,4 ℃、10 min。采用SYBR-Green进行PCR,反应条件为:95 ℃、30 s预变性;95 ℃、5 s,60 ℃、30 s,40个循环,通过Ct值定量法计算基因表达的比率,结果用2-ΔΔCt值表示,其中ΔΔCt=PACAP13组(Ct目的基因-Ct管家基因)-对照组(Ct目的基因-Ct管家基因)。引物序列见表1。

表1 引物序列

2 结果
2.1 TEC及MSC鉴定传至二代的TEC呈多边形贴壁生长,免疫组织化学结果显示,广谱角蛋白呈阳性表达,而波形蛋白呈阴性表达,见图1。传至二代的MSC呈圆形或梭形贴壁生长;经流式细胞仪检测,MSC表面CD34抗原阳性表达率为8.65%,CD44抗原表达率为99.9%,见图2。

图1 TEC的细胞形态及免疫组化 ×400

图2 MSC细胞形态及流式细胞仪鉴定
2.2 TEC、MSC、PACAP13肽对淋巴细胞增殖及凋亡的影响CCK-8检测淋巴细胞的增殖情况,根据OD值计算细胞增殖率,结果显示,与淋巴细胞组相比,淋巴细胞+TEC组、淋巴细胞+MSC组和淋巴细胞+TEC+MSC组的淋巴细胞的增殖率增加(F=4.102,P<0.05),其中淋巴细胞+TEC+MSC组增殖率增加程度最高。与不添加PACAP13肽的对照组相比,4组细胞在添加PACAP13肽后其淋巴细胞增殖率均增加,差异有统计学意义(t=-5.652,P<0.05),见图3。流式双染检测Dex诱导淋巴细胞凋亡的情况,与淋巴细胞+Dex组相比,淋巴细胞+TEC+Dex组、淋巴细胞+MSC+Dex组和淋巴细胞+TEC+MSC+Dex组的淋巴细胞的凋亡率下降(F=17.586,P<0.05),其中淋巴细胞+TEC+MSC+Dex组凋亡率下降程度最高,与不添加PACAP13肽的对照组相比,4组细胞在添加PACAP13肽后淋巴细胞凋亡率降低(F=18.842,P<0.01)。见图4。

图3 TEC、MSC、PACAP13肽对淋巴细胞增殖的影响

图4 TEC、MSC、PACAP13肽对Dex诱导淋巴细胞凋亡的影响
2.3 qPCR测定体外培养胸腺及狼疮小鼠胸腺、脾脏sjTREC含量根据标准曲线计算出各样本sjTREC和RAG2的拷贝数,得出1×106个细胞中sjTREC的含量,进行组间对比。结果显示,与胸腺组相比,胸腺+TEC组、胸腺+MSC组、胸腺+TEC+MSC组胸腺sjTREC的含量增加(F=41.553,P<0.05);与不添加PACAP13肽的对照组相比,添加PACAP13肽后胸腺sjTREC拷贝数增加(t=-7.434,P<0.05),见图5。与模型组相比,PACAP13肽组小鼠胸腺及脾脏sjTREC的含量均增加,其中胸腺sjTREC含量增加程度高(F=33.687,P<0.01),见图6。

图5 体外培养胸腺sjTREC的拷贝数
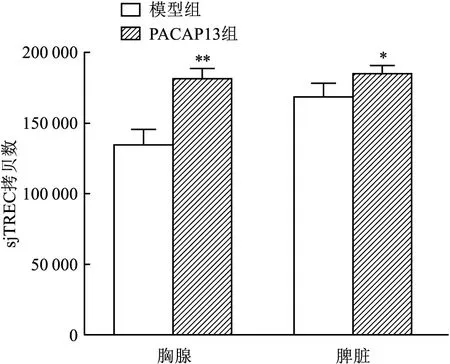
图6 狼疮小鼠胸腺、脾脏sjTREC的拷贝数
2.4 PACAP13肽对体外培养淋巴细胞的细胞因子及狼疮小鼠自身抗体的影响ELISA法检测各组体外培养淋巴细胞上层培养液细胞因子含量以及各组小鼠血清自身抗体含量,根据标准曲线求出各样本细胞因子或自身抗体含量。结果显示,与淋巴细胞+PACAP13组相比,淋巴细胞+TEC+MSC+PACAP13组细胞因子IL-1、IL-2、IL-6、TGF水平均显著增加(F=1 693.517,P<0.01;F=8 112.900,P<0.05;F=1 771.313,P<0.01;F=1 603.101,P<0.01);与淋巴细胞+PACAP13组相比,淋巴细胞+TEC+PACAP13组IL-1和IL-6水平明显增加(P<0.01);与淋巴细胞+PACAP13组相比,淋巴细胞+MSC+PACAP13组IL-1、IL-6、TGF水平均明显增加(P<0.05)。见表2。与模型组相比,PACAP13组血清ANA、抗dsDNA抗体、抗RNP/sm抗体的含量均下降(F=25.098,P<0.01;F=6.776,P<0.05;F=5.346,P<0.05),其中ANA下降幅度最为明显,而PACAP13组IgG含量有所下降但与模型组相比差异无统计学意义,见表3。
表2 各组细胞培养体系细胞因子的含量

表3 各组小鼠血清自身抗体含量
2.5 PACAP13肽对小鼠胸腺功能相关基因表达的影响与模型组相比,PACAP13组Aire、Fezf2、Foxp3、TGF-β mRNA相对表达量均上升(t=-10.405,P<0.01;t=-5.588,P<0.01;t=-5.912;t=-4.425,P<0.01),CXCL13 mRNA相对表达量则下降(t=6.109,P<0.01)。见图7。
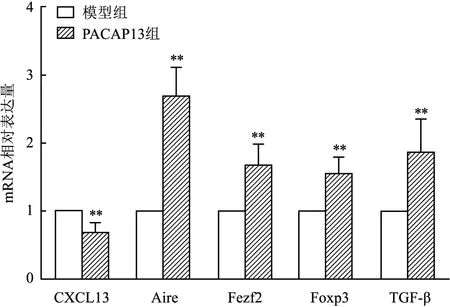
图7 狼疮小鼠胸腺mRNA相对表达水平
3 讨论
TEC是胸腺中主要的基质细胞,是构成胸腺微环境基质网架的主要细胞,将胸腺分为皮质区和髓质区;同时,TEC能分泌多种细胞因子,促进淋巴细胞的增殖与分化[4]。MSC具有干细胞的基本特征:多向分化潜能及自我更新能力,在胸腺微环境中可以作为淋巴细胞前体分化为成熟的淋巴细胞。此外,MSC还具有自分泌功能,能分泌多种细胞因子,促进淋巴细胞增殖生长及发挥免疫调节作用[5]。其中IL-1和IL-6是促炎细胞因子,具有诱导胸腺祖细胞分化为成熟的T淋巴细胞的作用[6]。IL-2促进调节性T细胞(regulatory T cells, Treg)分化,Treg与效应性T细胞的平衡是维持机体免疫及自我耐受的关键[7]。TGF-β,在维持稳态时对自身抗原的免疫耐受具有重要作用[8]。因此,该研究以TEC和MSC这两种细胞为对象与淋巴细胞共培养,体外探究TEC和MSC对胸腺淋巴细胞功能的作用,以及PACAP13肽对淋巴细胞、TEC和MSC的作用;TEC和MSC能促进淋巴细胞增殖并抑制凋亡,PACAP13肽也对淋巴细胞具有明显促增殖和抗凋亡作用。此外,PACAP13肽对与TEC和MSC共培养的淋巴细胞的增殖和抗凋亡作用优于单一的淋巴细胞,提示PACAP13肽不仅作用于淋巴细胞,同时还可以通过作用于TEC和MSC来增强这种效应。体外培养的淋巴细胞+TEC+MSC+PACAP13组培养液中细胞因子IL-1、IL-2、IL-6和TGF-β水平均显著增加,而淋巴细胞+TEC+PACAP13组和淋巴细胞+MSC+PACAP13组则只有部分细胞因子水平增加且增幅较低;一方面提示PACAP13肽能促进TEC和MSC细胞因子的分泌,另一方面TEC和MSC之间可能还存在相互作用,从而进一步促进细胞因子分泌。
胸腺是T淋巴细胞发育、分化、成熟及输出的场所,初始T细胞生成数量是胸腺状态和功能的重要评价指标,sjTREC是T细胞受体α基因重组过程中必须删除的T细胞受体δ基因片段,重排完成后经历阴性选择分化为单阳性细胞通过血液循环进入外周免疫器官,删除后的T细胞受体δ基因片段两端连接形成环状DNA结构,且它不随细胞的分裂而复制,因此能够代表近期初始T细胞输出的数量[9]。有研究[10]表明,降植烷诱导的狼疮小鼠胸腺T细胞出现异常分化的情况,双阳性T细胞显著减少,而双阴性T细胞增加,细胞从双阴性阶段到表达CD4和CD8进入双阳性阶段是T细胞发育的重要过程,双阴性和双阳性细胞数量异常提示狼疮小鼠T细胞发育受到阻滞。该研究显示,体外培养的胸腺,PACAP13肽干预后明显提高sjTREC的含量,提示PACAP13肽具有促进T细胞发育的作用。MSC或TEC与胸腺共培养都能使胸腺sjTREC的含量增加,TEC+MSC与胸腺共培养条件下,sjTREC的含量仅比TEC或MSC单一存在的情况下少量增加,表明TEC和MSC对初始T细胞生成的促进作用可能是有限度的,而添加PACAP13肽使sjTREC含量增加明显,提示PACAP13肽还能作用于TEC和MSC促进T细胞生成。在狼疮小鼠注射PACAP13肽后胸腺和脾脏的sjTREC含量提高,这也与体外的实验结果胸腺sjTREC含量增加的结果相一致;同时,小鼠体内实验还为下一步系统性研究PACAP13肽的作用机制提供基础。
Aire和Fezf2具有调节胸腺髓质上皮细胞表达组织性抗原的能力[11-12],清除自身免疫性细胞对免疫耐受的建立有重要作用。Treg细胞是发挥免疫抑制的重要亚群,叉头蛋白3(Foxp3)为Treg细胞特异性表达的转录因子,对Treg细胞的发育和功能起决定性作用,而Treg分泌的转化生长因子β(TGF-β)能抑制免疫活性细胞的增殖,降低机体的免疫反应[13]。CXCL13能趋化B细胞的迁移聚集,促进B细胞分化为浆细胞,从而促进抗体的产生[14]。该研究对狼疮小鼠胸腺以上几个基因mRNA表达水平进行研究,进而评价PACAP13肽对胸腺功能的影响。结果显示,PACAP13肽增加Aire、Fezf2、Foxp3、TGF-βmRNA的表达,同时降低CXCL13 mRNA的表达;表明PACAP13肽可能通过上调组织性抗原的表达和增强Treg细胞的免疫抑制功能,抑制B细胞分化为浆细胞,发挥免疫调节作用。同时,小鼠血清中狼疮相关自身抗体水平的下降,需要进一步验证PACAP13肽具有调节自身免疫耐受,抑制机体炎症的作用。
综上所述,PACAP13肽具有促进淋巴细胞增殖和抗凋亡作用,在体外及体内均具有增强初始T细胞生成和输出及减少狼疮小鼠自身抗体产生的免疫调节作用,其作用机制涉及对胸腺细胞因子分泌及基因转录的调控。
