无柄灵芝菌LZ02高产漆酶条件及部分酶学性质分析
2022-07-13杨新平谢玉清周留艳代金平王小武张慧涛王志方
杨新平,谢玉清,周留艳,代金平,王小武, 张慧涛,王志方,冯 蕾
(新疆农业科学院微生物应用研究所/新疆特殊环境微生物重点实验室,乌鲁木齐 830091)
0 引 言
【研究意义】漆酶广泛存在于自然界中,如植物、真菌、细菌、动物及昆虫中[1]。漆酶属于蓝色氧化酶家族,是一种含铜的多酚氧化酶,是重要的木质纤维降解酶之一,还能催化降解多种芳香族化合物,特别是酚类[2]。真菌漆酶作为具有重要生物学功能及应用价值的氧化还原酶,已成为农业环境、植物保护、微生物学、生物化工等领域的研究热点。无柄灵芝菌(G.resinaceum)属担子菌纲的多孔菌目,是漆酶最主要的生产者之一。真菌漆酶的生产模式包括固体发酵和液体发酵,工业生产基本以液体发酵为主,而高产酶发酵工艺的优化及漆酶稳定性的研究是工业化生产漆酶的关键[3]。漆酶是一种分布广泛的多酚氧化酶,在农业、食品、能源和环保等领域具有重要的应用价值。无柄灵芝菌可以合成分泌包括漆酶在内的多种木质纤维素降解酶,这些酶的活性会随着发酵工艺的不同而不同,所以对产酶发酵工艺进行优化,对于提高漆酶产量和酶活具有重要意义。【前人研究进展】真菌漆酶在真菌色素合成、病原菌致病性、形态建成及防御反应等多种生物学过程中发挥作用[4]。漆酶的作用底物广泛,能够催化木质素、酚类、胺类等芳香族、非芳香族化合物的氧化分解,将分子氧还原成水,被广泛应用于农业废弃物资源化利用,环保、造纸、纺织、食品加工、药品改良等领域[5]。真菌漆酶比细菌漆酶、植物漆酶等具有更好的热稳定性、金属离子耐受性及更高的底物催化氧化性[6]。【本研究切入点】无柄灵芝菌(G.resinaceum)漆酶的合成和分泌受到营养水平、培养条件、生长阶段以及培养基中诱导剂的严格调控,木质素或木质素相关的芳香类化合物、N源和C源也能调节漆酶的合成;漆酶活性对不同种类、不同浓度的金属离子以及诱导剂的响应不尽相同,其具有较复杂的生理功能及调控机制。无柄灵芝菌(G.resinaceum)漆酶对不同种类、不同浓度的金属离子以及诱导剂的响应不尽相同,其具有较复杂的生理功能及调控机制,需阐明漆酶作用机制提供基础。【拟解决的关键问题】对分离筛选到的无柄灵芝菌产漆酶的发酵条件及部分酶学性质进行研究,为真菌漆酶的规模化生产奠定理论基础。
1 材料与方法
1.1 材 料
1.1.1 菌 种
无柄灵芝菌(G.resinaceum)LZ02由采自新疆天山的菌种中分离筛选获得。
1.1.2 培养基
产酶基础培养基MF[7]:麦麸25 g,葡萄糖10 g,酒石酸铵1.84 g,NaCl 1.0 g、KH2PO42 g,琥珀酸钠1.18 g, VB110 mg,聚山梨酯-80 0.5 g,微量元素溶液70 mL,加水定容至 1 000 mL,pH调至5.5。
微量元素组成[8]:MgSO4·7H2O 3.0 g,MnSO4·H2O 0.5 g,ZnSO4·7H2O 0.1 g,CuSO4·7H2O 0.1 g,CaCl2·2H2O 0.1 g,KAl(SO4)2·12H2O 10 mg,H3BO310 mg,NaMnO4·2H2O 10 mg,加水定容至1 000 mL。
1.1.3 酶检测试剂
0.1 mol/L NaAc-HAc缓冲液(pH 4.0),0.5 mmol/L 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),漆酶(laccase)[9]。
1.2 方 法
1.2.1 漆酶活力测定
采用ABTS[2,2-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)]法[10-11]。反应体系组成为: 0.1 mol/L NaAc-HAc缓冲液(pH 4.0)1.95 mL、0.5 mmol/L 连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)2.00 mL和适当稀释的酶液50 μL, 相应反应温度下启动反应。并在3 min内连续测定反应液420 nm(ε=3.6×104mol/L/cm)处吸光值的增加值。该条件下,1 min使1 μmol/L的ABTS氧化所需的酶量定义为1个活力单位(U)。
漆酶活力计算公式:漆酶活力(U/L)=(n×△A×106×V1)/(3.6×104×3×V2).
其中:n为酶液稀释倍数;V1为反应总体积;V2为反应酶液体积;△A为3 min内反应液在420 nm处吸光度的变化值;3.6×104为ABTS氧化态的摩尔吸光系数(mol/L/cm)。
1.2.2 产漆酶发酵条件
1.2.2.1 碳源对发酵产漆酶的影响
采用单因素试验设计[12],在基础培养基MF的基础上进行碳源替换,分别以0.5%的麦芽糖、蔗糖、甘油、葡萄糖、羧甲基纤维素钠、淀粉、麦麸作为碳源,装液量50 mL/瓶,种子菌龄为5 d,接种量5%,pH调至5.5,发酵7 d后检测漆酶活性。
1.2.2.2 氮源对发酵产漆酶的影响
采用单因素试验设计,在基础培养基MF的基础上进行氮源替换,分别以0.5%的干酪素、酵母粉、蛋白胨、硝酸铵、硫酸铵、磷酸二氢铵、酒石酸铵作为氮源,装液量50 mL/瓶,种子菌龄为5 d,接种量5%,pH调至5.5,发酵7 d后检测漆酶活性。
1.2.2.3 金属离子添加对产酶的影响
以MF为产漆酶基础培养基,去除基础培养基中相对应的离子,分别添加浓度为0、0.1、0.5、1.0、2.0 mmol/L的Cu2+、Mg2+、Fe2+、Mn2+、Zn2+、Ca2+、Co2+,培养6 d,测定漆酶的活性(U/L)。
1.2.2.4 诱导剂对漆酶活性的影响
以MF为基础产漆酶培养基,pH调至5.5,装液量50 mL/瓶,种子菌龄为5 d,接种量5%,接种后第2 d添加不同诱导剂,诱导剂分别为藜芦醇、ABTS、没食子酸、单宁酸及愈创木酚,终浓度为0.025 mmol/L[13]。分别在第3、5、7、9、11 d测定酶活。
1.2.3 漆酶特性
1.2.3.1 最适反应温度和热稳定性
在pH 4.0的NaAc-HAc缓冲液中,分别在20、30、40、50、60、70、80℃条件下测定酶活,以酶活的最高值为100%,确定漆酶最适反应温度;在上述不同反应温度下继续保温10 min后,再次测定漆酶活性,以反应起始的酶活为对照,计算残留酶活,确定其热稳定性。
1.2.3.2 最适反应pH
分别用pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0的Na2HPO4-柠檬酸缓冲液配制反应底物,测定漆酶活力。
1.2.3.3 pH稳定性
将酶液加入pH分别为3.0、4.0、5.0、6.0、7.0、8.0的Na2HPO4-柠檬酸缓冲液配制的底物,放入40℃的水浴中保温24 h,测定酶活。
1.2.3.4 金属离子对漆酶稳定性的影响
用pH 4.0的NaAc-HAc缓冲液配制FeCl2、MnSO4、NaCl、CoCl2、ZnSO4、CaCl2、MgSO4、CuSO4、KCl、CdCl2、CrCl3、PbCl2、AgNO3、BaSO4溶液,使其终浓度为4 mmol/L,在最适反应温度下,以不添加上述金属离子的反应体系的酶活为100%,计算漆酶的相对活力。
1.2.4 LZ02漆酶蛋白性质
1.2.4.1 LZ02分泌蛋白SDS-PAGE
按最优的发酵条件获得漆酶发酵液,10 000 r/min、4℃、离心20 min,经过了30%~80%的硫酸铵分段盐析、Macro-Prep DEAE弱阴离子交换层析和Bio-Gel P-60 凝胶过滤层析系列纯化,纯化产物进行SDS-PAGE电泳分析[14-16],应用Bio-RAD quantity one软件对蛋白分子量进行分析[16]。
1.2.4.2 蛋白双向电泳、漆酶等电点测定及主要蛋白质谱
采用Bio-Rad蛋白质双向电泳系统测定无柄灵芝菌LZ02漆酶的等电点,将漆酶发酵液经过10 000 r/min、4℃、离心20 min后,分别收集上清液和沉淀,使用pH 7.5、20 mmol/L的Tris·HCl缓冲液将沉淀冲洗4~5次,然后加入Tris·HCl缓冲液进行超声波破碎(冷却进行)后,10 000 r/min、4℃、离心10 min,取上清液进行透析过夜、浓缩至所需体积即可。上清液则可直接进行透析过夜、浓缩至所需体积。等电点聚焦使用了Bio-Rad的IPG预制胶条,pH为3.0~10,pH梯度为线性梯度,通过Bio-Rad PDQuest 2-D Analysis software软件分析获得酶蛋白等电点pI[17]。第二向SDS-PAGE电泳对无柄灵芝菌LZ02发酵产酶高峰时的菌体及发酵液进行上样检测对比分析。并将表达量高的漆酶蛋白点切下进行质谱测序分析。并将表达量高的漆酶蛋白点切下进行质谱测序并利用GPS Explor软件进行分析[18]。
2 结果与分析
2.1 产漆酶发酵条件
2.1.1 碳源对LZ02产漆酶的影响
研究表明,以基础产酶培养基中麦麸加葡萄糖(CK)的碳源组合酶活相对较高,为6 393 U/L,麦麸产酶活性为532 U/L;添加麦芽糖、蔗糖、甘油、葡萄糖、羧甲基纤维素钠、淀粉替代基础培养基中的麦麸加葡萄糖均未检测到酶活,基础培养基MF中麦麸加葡萄糖的碳源组合为最佳。图1

注:1.麦芽糖;2.蔗糖;3.甘油; 4.葡萄糖;5.羧甲基纤维素钠;6.淀粉;7.麦麸;8.对照
2.1.2 氮源对LZ02产漆酶的影响
研究表明,添加干酪素替代基础培养基中的酒石酸铵时酶活最高,为6 365 U/L;其次为蛋白胨,酶活为5 343 U/L;再次为酵母粉,酶活为4 000 U/L;添加硝酸铵替代基础培养基中的酒石酸铵时,酶活为2 364 U/L;添加硫酸铵和磷酸二氢铵替代基础培养基中的酒石酸铵时,酶活分别为513和236 U/L;而以酒石酸铵(CK)作为氮源时,酶活为1 778 U/L,LZ02产漆酶的最佳氮源为干酪素,其次为蛋白胨。图2。

注:1.干酪素;2.酵母粉;3.蛋白胨;4.硝酸铵;5.硫酸铵;6.磷酸二氢铵;7.对照
2.1.3 金属离子浓度对LZ02产漆酶的影响
研究表明,Cu2+、Mg2+、Fe2+、Zn2+、Ca2+的添加对LZ02产漆酶有一定的促进作用,其中0.5 mmol/L Cu2+、0.1 mmol/L的Mg2+、1和 2 mmol/L Fe2+、2 mmol/L Zn2+、0.1和 0.5 mmol/L Ca2+的效果最明显。添加0.1 mmol/L的Mg2+在发酵第6 d所测得的酶活由对照组的0 U/L增加至4 276 U/L,1 mmol/L Fe2+在第6 d所测得的酶活由0增加到 5 150 U/L,添加0.1 mmol/L的Ca2+在发酵第6 d所测得的酶活由对照组的900 U/L增加至2 779 U/L,2 mmol/L Zn2+在第6 d所测得的酶活由1 171 U/L增加到 3 134 U/L;不同浓度Co2+的添加都使酶活明显下降,Co2+对产酶具有抑制作用。图3

图3 添加不同金属离子下LZ02产漆酶变化Fig.3 Effect of different metallic ion on the production of LZ02 laccase
2.1.4 诱导剂对LZ02产漆酶的影响
研究表明,藜芦醇和愈创木酚抑制产酶并使产酶高峰由第3 d推后至第9 d,添加没食子酸和ABTS对产酶影响不大;单宁酸对产酶具有抑制作用。图4

图4 不同诱导剂下LZ02产漆酶变化Fig.4 Effect of different inducer on the production of LZ02 laccase
2.2 漆酶部分酶学特性
2.2.1 LZ02漆酶的最适反应温度
研究表明,以最高酶活性60℃条件下测定的LZ02漆酶活性为100%,20℃到80℃温度区间内测定的反应液酶活分别为53.5%、64.7%、82.8%、97%、100%、84.4%、70%。图5

图5 LZ02漆酶最适反应温度Fig.5 The optimum reaction temperature of laccase
2.2.2 LZ02漆酶的热稳定性
研究表明,40℃时稳定性最好。图6

图6 LZ02漆酶热稳定性Fig.6 Thermal stability of laccase
2.2.3 LZ02漆酶的最适反应pH
研究表明,pH为2.0到4.0时所测定的酶活相对较高,pH为2.0时酶活为1 161 U/L,pH 3.0时酶活为1 126 U/L,pH为4.0时,酶活为1 044 U/L,pH为5.0以上时所测酶活为0。图7

图7 LZ02漆酶最适反应pHFig.7 Optimal pH of laccase
2.2.4 LZ02漆酶pH稳定性
研究表明,漆酶在40℃保温24 h,pH 3.0~4.0时酶活较稳定,pH 3.0时相对酶活为51.3%,pH 4.0时为59.3%,随着pH值的升高酶活逐渐降低,超过pH 6.0时残留酶活接近0。图8

图8 LZ02漆酶的pH稳定性Fig.8 pH on laccase stability
2.2.5 金属离子对漆酶稳定性的影响
研究表明,Mn2+、Zn2+、 Cu2+、Ba2+和K+对酶稳定性有一定的促进作用,其中在含有Cu2+和Zn2+的pH 4.0的NaAc-HAc缓冲液反应体系中,所测酶活为对照的145%和133%, Na+和Ag+对酶稳定影响不大;Co2+、Cd2+、Cr2+和Pb2+对酶的稳定性具有明显的破坏作用,其中加入Co2+时酶活为对照的57%;而Fe2+对漆酶活性完全抑制。图9

图9 不同金属离子下LZ02漆酶稳定性变化Fig.9 Effect of different metal ion on laccase stability
2.3 LZ02漆酶蛋白性质
2.3.1 SDS-PAGE电泳
研究表明,发酵培养基中含有多种蛋白及多肽,发酵液上清在61 KD左右有较明显的蛋白带,经过离子交换层析后基本呈单一条带,经过凝胶过滤层析后,SDS-PAGE电泳显示只有1条蛋白带。获得的漆酶已经达到了电泳纯级。根据标准蛋白相对分子量,得出木蹄层孔菌漆酶相对分子量约为61.5 KD。图10

注:M.蛋白相对分子量标样;1.硫酸铵盐析(60%);2.离子交换层析;3.硫酸铵盐析(80%);4.凝胶过滤层析
2.3.2 漆酶蛋白质双向电泳及等电点
研究表明,菌体蛋白检测出较多蛋白质点,而发酵液蛋白点则主要在同一等电点区域,酶蛋白pI为4.1,将菌体及发酵液表达量高的同一蛋白质点切下进行质谱分析。图11
2.3.3 漆酶质谱
研究表明,对主要表达蛋白进行MALDI TOF/TOF质谱分析,利用GPS Explor软件进行分析,MASCOT检索NCBI Nr蛋白质数据库,成功鉴定1个蛋白点(蛋白质得分>50,可信度>90),鉴定的蛋白为Laccase(GanodermaLucidum),其肽脂纹图谱中有5条序列均与Laccase蛋白匹配。,表1

注:a.菌体;b.发酵液
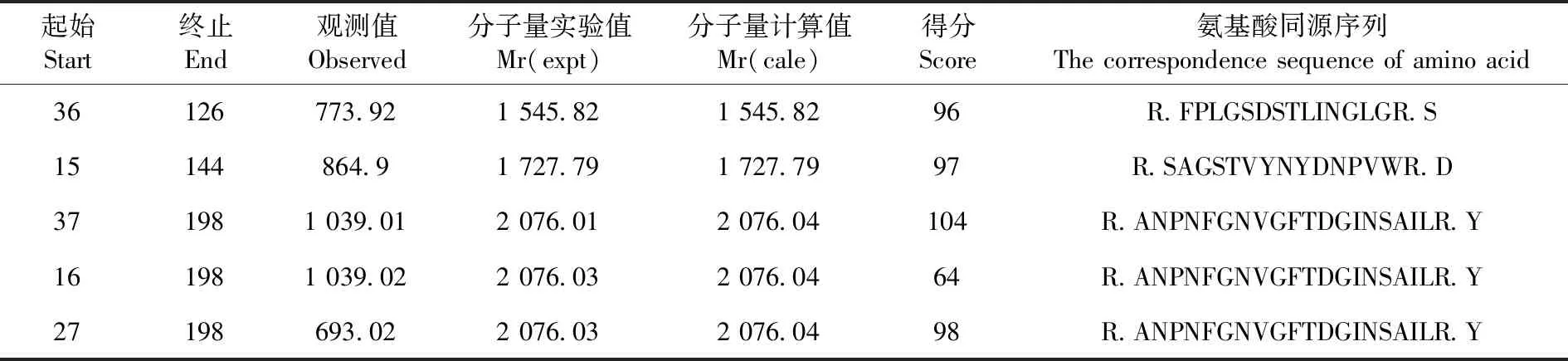
表1 无柄灵芝菌(G.resinaceum)LZ02漆酶质谱分析中基本信息和匹配的肽段序列Table 1 The basic information and match peptide sequences in mass spectrometry analysis of the laccase of G.resinaceum LZ02
3 讨 论
漆酶的合成和分泌受到营养水平、培养条件、生长阶段以及培养基中诱导剂的严格调控,木质素或木质素相关的芳香类化合物、N源和C源也能调节漆酶的合成[19-20]。
微生物酶类分为组成酶和诱导酶。组成酶是指微生物无论在任何培养基中,总是适量的存在的一些酶类;诱导酶是依赖于酶作用底物或底物结构类似物的存在而合成的酶类[21]。漆酶胞外组成酶产量较低,当添加与木质素或木质素衍生物相关的芳烃类和酚类诱导物时,能显著提高漆酶酶活。Yuan等[22]研究发现不产漆酶菌株胶红酵母(Rhodotorularmucilaginosa)与产漆酶菌株阿魏蘑(Pleurotuseryngiivar.ferulae)进行共培养时,可以有效提高漆酶发酵水平。Hao等[23]研究发现,ABTS、甲苯胺和对苯二酚对新疆野生巴尔喀什蘑菇产漆酶有明显的促进作用,而咖啡酸、没食子酸、邻苯二酚、2,6-二甲氧基酿和愈创木酸对产酶诱导不明显。研究表明[24,25],Pb2+、Cd2+、Cu2+和Fe2+4种重金属离子在液体培养条件下15个灵芝漆酶同工酶的转录表达影响存在差异性,其中5个漆酶基因(Glac4、Glac6、Glac10、Glac11和Glac12)转录表达发生上调。
4 结 论
确定0.5%酵母粉、2.5%麦麸、0.5%葡萄糖、0.5%磷酸二氢铵的最优组合,此时漆酶活性可达10 863 U/L。白腐菌SHIHU-X2产漆酶的最优培养基是:去皮马铃薯200 g/L,葡萄糖20 g/L,蛋白胨1.24 g/L,KH2PO41 g/L,酒石酸铵0.02 g/L,CuSO40.01 g/L,MgSO40.56 g/L,MnSO40.057 g/L。漆酶活力从初始产酶培养基1.11 U/mL 提高到响应面优化后的2.32 U/mL,漆酶活力提高了109%。
无柄灵芝菌(G.resinaceum)LZ02漆酶胞外分泌蛋白类型主要为Laccase(GanodermaLucidum),获得了该蛋白质的5个漆酶氨基酸序列片段。
