基于 TMT和PRM 技术筛选番茄响应盐胁迫差异表达蛋白
2022-07-13刘会芳韩宏伟庄红梅王柏柯
王 强,刘会芳,韩宏伟,庄红梅,王柏柯, 王 娟,杨 涛,王 浩,秦 勇
(1.新疆农业科学院园艺作物研究所/新疆蔬菜工程技术研究中心,乌鲁木齐 830091,2.新疆农业大学园艺学院,乌鲁木齐 830052)
0 引 言
【研究意义】番茄具有广泛的适应性,但由于土壤或灌溉水含盐量的增加,番茄的产量减少[1]。土壤盐渍化已成为世界范围内作物生产的主要威胁之一[2]。栽培番茄总体上被认为是中度(约70 mM NaCl)耐盐,大多数番茄品种具有耐受轻度至中度盐胁迫的遗传潜力[3]。钠是盐渍土中的主要离子,从根中吸收并积累在光合组织中,导致离子失衡、细胞毒性,降低产量。植物具有一系列的耐盐机制来应对盐胁迫,包括限制钠的吸收、增强钠的排除、调节细胞离子平衡以及在叶片中重新分配钠[4-6]。盐胁迫对植物生长产生负面影响,导致植物营养失衡、氧化应激、光合作用抑制和呼吸系统变化。近年来随着蛋白组学结合质谱分析技术的快速发展,研究番茄应答盐胁迫过程蛋白质变化,为开展番茄响应盐胁迫后的分子机制研究,在蛋白质组学层面研究番茄耐盐机理有重要意义。【前人研究进展】Zhang等[7]报道盐胁迫下参与碳水化合物和氨基酸代谢途径的一些重要基因表达谱发生明显变化。盐处理对番茄果实能量代谢、氧化还原反应和成熟过程相关蛋白的影响[8]。Keutgen和Pawelzik[9]发现盐处理提高了草莓的总氨基酸含量,并且盐处理改变了许多涉及细胞壁代谢和类黄酮和苯丙酸途径的关键基因[10]。在番茄中,与蔗糖代谢途径相关的酶活性,如酸性转化酶和蔗糖合酶活性在盐处理下都得到了增强[11]。Chen和Plant[12]发现,在不到4 d的胁迫下,番茄可以瞬时合成出未确认的盐响应蛋白,研究还证明脱落酸在大多数这些蛋白质的合成中并不起主要作用。Amini等[13]鉴定出5个受24 h盐胁迫调节的番茄蛋白,而chen 等[14]在处理7 d盐胁迫时鉴定出23个盐胁迫响应蛋白,比较了敏感和耐基因型,一些抗氧化蛋白、热休克蛋白和碳水化合物代谢相关蛋白表达上调。植物的每个生长发育阶段(种子萌发、营养生长和生殖生长)都表现出对盐胁迫的敏感性,导致作物生产和产量下降[15-16]。【本研究切入点】比较蛋白质组学分析在鉴定与基因型特性相关的蛋白质变化方面非常有效。例如,在盐胁迫下,盐生植物盐芥与甜土植物拟南芥中表达不同的胁迫蛋白质组[17]。对干旱敏感栽培番茄和耐旱野生番茄(Solanumchilense)根系蛋白质组的iTRAQ分析表明,2份材料中的大量蛋白质受失水影响[18]。这些差异表达的蛋白质可以作为选择耐性性状的候选标记。盐胁迫是造成番茄产量损失和品质严重下降的关键非生物胁迫之一。【拟解决的关键问题】研究以76 份野生番茄SolanumpennelliiLA716 为供体、栽培番茄M82为受体的渐渗系群体,研究采用 TMT(Tandem Mass Tag)标记技术,结合 PRM(Parallel Reaction Monitoring)验证技术,筛选并验证番茄幼苗在盐胁迫后的蛋白质变化,从蛋白质组学的角度分析番茄幼苗在盐胁迫应答过程中的作用,发现与盐胁迫相关的潜在靶标蛋白,为深入认识番茄盐胁迫的耐性分子调控机制奠定基础。
1 材料与方法
1.1 材 料
试验于2019年4月在新疆农业科学院安宁渠试验站日光温室内进行,将番茄耐盐渐渗系IL7-5-5(ST)与番茄盐敏感M82(SS)的种子播种在草炭、珍珠岩、蛭石(1∶1∶1)基质中,按常规温室育苗管理。待幼苗长到4片真叶时,将幼苗根部的草炭、珍珠岩和蛭石清洗干净,移栽到1/2浓度Hoagland标准营养液中进行水培,整个水培系统培养箱大小一致,整个系统用增氧泵提供氧气。室内环境控制标准:温度控制在白天25℃,晚上18℃,空气湿度40%,光周期为白天14 h/夜晚10 h。每日补充空气 3 次、每次 30 min,每隔 2 d将蒸发掉的水分用无离子水补充到原体积,1 周后开始试验,共设 2 个处理:①对照(CK):1/2 Hoagland营养液;②盐胁迫处理(S):在 1/2Hoagland营养液中添加NaCl使其终浓度达到 200 mmol/L,分别在 0、12 h采样。每个处理设置 3 次重复,选取待测材料同一部位叶片,利用液氮速冻后储藏于-80℃冰箱中待用。
1.2 方 法
1.2.1 蛋白质提取
用液氮研磨样品,然后将粉末转移到5 mL离心管中,并在裂解缓冲液(包括1%TritonX-100、10 mM二硫苏糖醇、1%蛋白酶抑制剂鸡尾酒和2 mM EDTA)中使用高强度超声波处理器在冰上超声3次。加入等量的饱和苯酚(pH值8.0)。然后,将混合物进一步涡旋5 min。离心(4°C,10 min,12 000 g)后,将上层苯酚相转移到新的离心管中。通过添加至少四体积的饱和甲醇硫酸铵沉淀蛋白质,并在-20℃下培养至少6 h。在4°C下离心10 min后,丢弃上清液。剩余沉淀物用冷甲醇洗涤,然后用冷丙酮洗涤3次。蛋白质在8 M尿素中重新溶解,使用BCA试剂盒测定蛋白质浓度。
1.2.2 胰蛋白酶消化
将样品缓慢加入到最终浓度为20% (m/v)的TCA中以沉淀蛋白质,然后涡旋混合并在4℃孵育2 h。通过在4℃下以4 500 g离心5 min收集沉淀。用预冷却的丙酮洗涤沉淀的蛋白质3次并干燥1 min。将蛋白质样品重新溶解在200 mM TEAB中并超声分散。胰蛋白酶以1∶50胰蛋白酶与蛋白质的质量比加入,用于第1次消化过夜。样品在37℃用5 mM二硫苏糖醇还原60 min,并在室温黑暗中用11 mM碘乙酰胺烷基化45 min。最后,肽通过C18固相萃取柱脱盐。
1.2.3 TMT标记
胰蛋白酶肽首先溶解在0.5 M TEAB中。每个肽通道用各自的TMT标记试剂盒(Thermo Scientific)说明书标记,并在室温下孵育2 h。将每个样品的5 μL混合,脱盐并通过质谱进行分析,以检查标记效率。标记效率检查后,样品通过加入5%羟胺淬灭。然后将合并的样品用Strate XC18固相萃取柱脱盐,并通过真空离心干燥。SS样本用TMT标记126、127和128,而ST样本用TMT标记129、130和131。 进行3个独立的生物实验,技术重复3次。
1.2.4 高效液相色谱分离
肽段用高pH反向高效液相色谱分级,色谱柱为Agilent 300Extend C18(5 μm粒径,4.6 mm 内径,250 mm长)。肽段分级梯度为8%~32%乙腈、pH10,80 min时间分离80个组分,随后肽段合并为14个组分,合并后的组分经真空冷冻干燥后进行后续操作。
1.2.5 液相色谱-串联质谱法鉴定蛋白质
肽段用液相色谱流动相A相(0.1% (v/v) 甲酸水溶液)溶解后使用EASY-nLC 1000超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和90%乙腈的水溶液。液相梯度设置:0~23 min,9%~26%B;23~32 min,26%~38%B;32~36 min,38%~80%B;36~40 min,80%B,流速维持在350 nL/min。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离然后进Q Exactive质谱进行分析。离子源电压设置为2.0 kV,肽段母离子及其二级碎片都使用高分辨的Orbitrap进行检测和分析。一级质谱扫描范围设置为400~1 500 m/z,扫描分辨率设置为70 000;二级质谱扫描范围则固定起点为100 m/z,二级扫描分辨率设置为17 500。数据采集模式使用数据依赖型扫描(DDA)程序,即在一级扫描后选择信号强度最高的前20肽段母离子依次进入HCD碰撞池使用28%的碎裂能量进行碎裂,依次进行二级质谱分析。自动增益控制(AGC)设置为5E4,信号阈值设置为6.3E4 ions/s,最大注入时间设置为64 ms,串联质谱扫描的动态排除时间设置为30 s避免母离子的重复扫描。
1.2.6 生物信息学分析
差异蛋白是以某个蛋白的log1.5(差异倍数) > 1 or < -1且统计检验P<0.05 ,即可认为是上调或下调显著差异蛋白。利用 GO 对鉴定差异蛋白进行功能分析,蛋白的 GO 注释信息主要来源于 UniProt-GOA 数据库(www. http://www.ebi.ac.uk/GOA/),采用 hypergeometric 检测方法,P<0.05 的GO term 即为统计上显著富集的 GO Term。首先, 将蛋白的 ID 转换为 UniProtKB 数据库的 ID 然后根据 UniProKB 的 ID 在 UniProt-GOA 中找到对应的 GO 注释信息。如果有一些鉴定的蛋白在数据库中没有被注释到,将使用 InterProScan 同序列比对的方法去注释蛋白的 GO 分类。每个蛋白的分类根据GO注释可以分为 3 大类: 生物进程、分子功能、细胞组成。
1.2.7 PRM 验证
根据 TMT结果,采用液相色谱-质谱联用系统对番茄样品中目标蛋白进行相对定量比较。采用基于质谱的PRM技术)对相关蛋白进行靶向定量分析,肽段用液相色谱流动相A相溶解后使用EASY-nLC 1000超高效液相系统进行分离。经由超高效液相系统分离后被注入NSI离子源中进行电离然后进Q ExactiveTMPlus质谱进行检测和分析。数据采集模式使用数据非依赖型扫描(DIA)程序。
1.2.8 数据处理
二级质谱数据使用Maxquant (v1.5.2.8)进行检索。检索参数设置:数据库为Solanum_lycopersicum_Uniprot(34 640条序列),添加了反库以计算随机匹配造成的假阳性率(FDR),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为Trypsin/P;漏切位点数设为2;肽段最小长度设置为7个氨基酸残基;肽段最大修饰数设为5;First search和Main search的一级母离子质量误差容忍度分别设为20和5 mg/kg,二级碎片离子的质量误差容忍度为0.02 Da。将半胱氨酸烷基化设置为固定修饰,可变修饰为甲硫氨酸的氧化,蛋白N端的乙酰化,脱酰胺化(NQ)。定量方法设置为TMT-6plex,蛋白鉴定、PSM鉴定的FDR都设置为1%。
PRM肽段参数:蛋白酶设置为Trypsin[KR/P],最大漏切位点数设置为0,肽段长度设置为7~25个氨基酸残基,设置半胱氨酸烷基化为固定修饰。Transition参数:母离子电荷设置为2、3,子离子电荷设置为1,离子类型设置为b、y。碎片离子选择从第3个开始到最后1个,离子匹配的质量误差容忍度设置为0.02 Da。
2 结果与分析
2.1 番茄幼苗响应盐胁迫的差异蛋白表达模式
研究表明,在ST12 vs ST0 对比组中,鉴定出 191 种差异共同表达蛋白,其中有上调蛋白119种(P≤ 0.05,fold change>1.5),下调蛋白 72 种(P≤ 0.05,fold change < 0.67)。在 SS12vsSS0 中,共鉴定到差异表达蛋白种类为157种,84 种蛋白上调表达,73 中蛋白下调表达。耐盐品种中大量蛋白质被盐胁迫激活。盐处理分别有129和95个差异蛋白特异于ST和SS。有62个差异蛋白共表达,其中 28 个在 ST和SS中均上调,15 个均为下调,表现出对盐胁迫的一致响应。19个差异蛋白在差异材料中不同表达,有5个蛋白质在ST中下调,在SS中上调,14个差异蛋白在ST中上调,在SS中下调。在2种材料中,一些蛋白质对盐处理有相似的反应(诱导或抑制)。一些蛋白在SS中被诱导,而在ST中被抑制或没有改变,反之亦然。2种材料在盐胁迫下均表现出蛋白质表达的动态变化,其中一些变化与2种材料耐盐基因型特性有关。图1
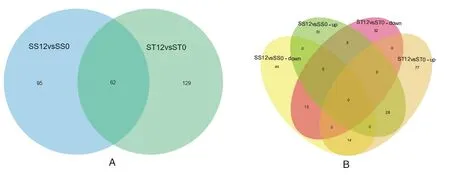
注:(A)差异表达蛋白(DEPs)比较的数量。(B)两个番茄幼苗DEPs蛋白的维恩图
2.2 番茄幼苗响应盐胁迫差异蛋白的GO富集
研究表明,在对盐敏感SS和耐盐ST番茄叶片差异蛋白的 GO 富集分析中,盐敏感M82在盐胁迫处理下,差异蛋白主要参与的生物学过程也是以代谢过程、单组织过程以及细胞过程最多,分别占显著差异蛋白的 34%、22%和 24%。刺激响应过程、生物调节、定位、细胞成分、细胞构成组织和其他差异蛋白次之,分别占 7%、7%、3%、3%和 2%,细胞组分条目里,主要富集于细胞、细胞器、 分子复合物和膜分别占34%、27%、17%、20% ; 在分子功能条目里,富集于前 3 位的条目分别是催化活性、绑定和分子功能调控分别占42%、39%、7%。
主要参与的生物学过程也是以代谢过程、单组织过程以及细胞过程最多,占富集到该生物学过程中差异蛋白的 35%、24%和 23%。刺激反应、生物调节、定位和其他差异蛋白次之,分别占 6%、6%、4%和 2%,细胞组分条目里,主要富集于细胞、细胞器、分子复合物和膜,分别占39%、27%、12%、13% ; 在分子功能条目里,富集于前 3 位的条目分别是催化活性、绑定和分子功能调控,分别占43% 、41%、8%,番茄在盐胁迫下差异表达蛋白具有多种分子功能,并参与了多个生物过程。图2

注:A、D分别代表SS12 vs SS0、ST12 vs ST0生物学过程;图B、E分别代表SS12 vs SS0、ST12 vs ST0细胞成分;图C、F分别代表SS12 vs SS0、ST12 vs ST0分子功能
2.3 番茄幼苗响应盐胁迫差异蛋白的KOG功能分类
研究表明,耐盐ST中有121种显著差异蛋白质获得注释,分为21种KOG功能,分别用A~Z表示。功能聚类主要有[R]一般功能预测、[E]氨基酸转运与代谢,[J]翻译,核糖体结构与生物发生,[G]碳水化合物转运与代谢,[I]脂类转运与代谢,[Q]次生代谢产物的生物合成,转运与分解代谢,[C]能量生产与转化, [O]翻译后修饰,蛋白质转换,伴侣。分别包含17、15、11、10、9、9、9、8种差异蛋白质。这表明耐盐ST幼苗在盐胁迫下主要影响了的R、E、J、I、Q、C的功能。
感盐SS中有97种显著差异蛋白质获得注释,分为18种KOG功能,分别用A~Z表示。功能聚类主要有 [R]一般功能预测,[O]翻译后修饰,蛋白质翻转,伴侣蛋白,[J]翻译,核糖体结构和生物发生,[Q]次生代谢产物的生物合成,运输和分解代谢,[I]脂质运输和代谢分别包含20、13、10、9、6 种差异蛋白质。盐胁迫下主要影响了感盐SS的R、O、J、Q、I功能。图3,图4

图3 ST12vsST0响应盐胁迫差异蛋白的KOG功能分类Fig.3 KOG functional classification of ST12vsST0 differential proteins in response to salt stress

图4 SS12vsSS0响应盐胁迫差异蛋白的KOG功能分类Fig.4 KOG functional classification of SS12vsSS0 differential proteins in response to salt stress
2.4 番茄幼苗响应盐胁迫差异蛋白的PRM验证
研究表明,11个蛋白在 TMT和PRM的定量结果总体趋势在ST、SS中都表现一致性较高,筛选到的差异蛋白质可能是番茄幼苗响应盐胁迫的标志蛋白质,研究结果将为番茄幼苗盐胁迫响应蛋白标志物的筛选提供参考依据。表1

表1 PRM 和 TMT 的定量结果比较Table 1 Comparison of PRM and TMT quantification result
3 讨 论
3.1 差异蛋白涉及翻译、核糖体结构和生物合成
基因表达是由转录和转录后调控的。在盐胁迫后番茄幼苗中鉴定出了参与蛋白质翻译、核糖体结构和生物合成的蛋白质。40S核糖体蛋白S13(K4CYU9)、40S核糖体蛋白S13样(A0A3Q7GKU3)均在ST中表达丰度上调,在SS的表达丰度下降。与PRM蛋白水平变化相一致,说明盐胁迫下耐盐番茄幼苗核糖体蛋白质的上调可能与转化机制的总体增强有关。PRM是靶向质谱的最新发展,比选择性反应监测更具特异性和敏感性,并已被广泛用于定量和检测靶蛋白[19-20]。研究结果表明, 许多种核糖体蛋白除了构成核糖体、 参与蛋白质生物合成的功能外, 还具有参与复制、转录、自体翻译及细胞周期调控、细胞凋亡等其他功能[ 21-22]。研究结果显示,40S核糖体蛋白S26(A0A3Q7FYD2、A0A3Q7GRY8)、40S核糖体蛋白S27(A0A3Q7GX32)都在SS中下调表达。说明蛋白质合成过程中受到盐胁迫诱导与rRNA结合的核糖体蛋白的丰度受到影响,进而减少感盐番茄蛋白质的合成表达下调。
翻译延伸因子1α是重要的翻译因子,参与翻译控制、信号传导、凋亡、细胞骨架组成、病毒复制及转化等重要的细胞过程。孙伟等[ 23]在盐胁迫下的盐地碱蓬获得的1 000个表达序列结果表明,7个编码翻译延伸因子1的氨基酸序列完全相同,在碱蓬叶子中。延伸因子1-α基因是一个中等丰富度的基因,其表达水平表明延伸因子1-α基因可能是盐诱导基因。研究结果显示,延伸因子1-α(A0A3Q7J0Z4)在ST中受盐胁迫表达丰度上调表达,SS的表达丰度下降,盐胁迫诱导了延伸因子1-α蛋白的表达。
3.2 差异蛋白涉及细胞过程和信号转导
当植物遭遇盐胁迫环境时,多种盐响应信号通路被激活以抵抗损害。ABA信号通路在植物对非生物胁迫的响应中起着至关重要的作用,它通过调控气孔的关闭以限制胁迫条件下的水分流失。在研究中,参与ABA信号转导途径的脱落酸胁迫成熟蛋白4(A0A3Q7GZ60)仅在耐盐IL-7-5-5的叶片中上调表达。脱落酸胁迫成熟蛋白是一种小的亲水性蛋白,在脱落酸和各种胁迫下会增加其表达水平[ 24]。从谷子中提取的一种新基因SIASR1在烟草中的过度表达显著提高了对干旱和氧化胁迫的耐受性,并且SIASR1C可以调节一些氧化相关基因的转录水平[ 25]。
脱落酸胁迫成熟蛋白(ASR4)在耐盐IL-7-5-5中增长2.74倍。有研究显示番茄也受到盐胁迫的诱导[ 26]。这些结果表明,ARS4是番茄耐盐的重要蛋白,这些防御反应是由ABA信号通路介导的[ 27-28]。其次,与ABA代谢相关的DEGs或TFs参与了盐胁迫的响应,包括黄色素脱氢酶基因(ABA2)、以及锌指蛋白WRKY类[29]。 研究显示黄色素脱氢酶(A0A3Q7G430)与锌指蛋白GIS2亚型X1在耐盐IL-7-5-5中上调表达,在M82中下调表达。因此,与IL-7-5-5表达水平的增加可能通过诱导信号传导相关基因影响耐盐性的增强。
3.3 差异蛋白涉及脂类转运与代谢
脂肪酸生物合成途径中的乙酰辅酶A羧化酶生物素羧载体蛋白(A0A3Q7I603)、乙酰辅酶A-乙酰转移酶(A0A3Q7FY19)在ST中丰度增加,而在M82中没有改变。有研究显示,盐处理后,乙酰辅酶 a 乙酰转移酶、生物素羧化酶和酰基辅A合成酶参与了脂肪酸合成的合成,盐胁迫使玉米幼苗3种蛋白质丰度增加[30]。在研究中,参与脂肪酸和核苷三磷酸合成的蛋白在盐胁迫后ST中的丰度增加。脂肪酸的合成可能参与了番茄对盐胁迫的防御反应。
胚胎发育晚期富集蛋白(LEA)是近年来备受关注的一类响应逆境胁迫诱导蛋白[31]。脱落酸(ABA)和包括盐碱在内的各种非生物胁迫均可显著诱导LEA蛋白[32]。LEA蛋白基因AtLEA14的过表达可增强拟南芥耐盐性[33]。此外,在拟南芥中过度表达狗尾草SiLEA14可增强转基因幼苗对盐胁迫和渗透胁迫的耐受性[34]。在NaCl处理后12 h叶片中,2个晚期胚发生丰富蛋白LEA(E1AZA3)在耐受基因型IL-7-5-5/敏感性M82均上调表达,但耐盐型IL-7-5-5蛋白丰度均显著高于盐敏感性M82。IbLEA14高表达愈伤组织中的木质素含量比对照愈伤组织有所增加[35]。推测较高丰度的LEA蛋白可能参与调节木质素的产生,从而提高耐盐性。
3.4 差异蛋白涉及氨基酸转运与代谢
氨基酸生物合成和代谢对植物生长、发育和对胁迫的反应至关重要[36-39]。蛋白质合成和降解之间的平衡在调节生物体的细胞过程以及它们对发育或环境信号的反应中起着至关重要的作用[40-41]。研究发现盐胁迫改变了番茄中许多参与氨基酸生物合成和代谢的蛋白质物种的丰度,包括精氨酸和脯氨酸代谢;色氨酸代谢;赖氨酸降解;缬氨酸、亮氨酸和异亮氨酸降解。在耐盐性ST中,已鉴定的蛋白质精氨酸酶(A0A3Q7EK65)的丰度因盐胁迫而增加,其丰度表现出与验证的PRM水平很好的相关。天冬酰胺合成酶(A0A3Q7GRS5)诱导ST/SS上调表达,这与前人有关天冬酰胺合成酶在耐盐性和耐寒性中起着关键作用,受到盐胁迫、渗透胁迫和脱落酸的上调表达一致[42-43]。盐处理也能诱导甲酸脱氢酶(Q5NE18)在耐盐ST中上调表达。这种酶控制着甲酸盐的体内平衡,也被认为在AtMKK1(一种应激反应激酶)调节的体内起着重要作用[44]。说明这些氨基酸的合成可能有利于耐盐性。
3.5 差异蛋白涉及次生代谢产物的生物合成
γ-氨基丁酸 (γ-aminobutyric acid,GABA) 常被作为缓解植物逆境胁迫生长过程中的外源物质[45-46]。作物在受到逆境胁迫时,体内GABA 含量也会发生变化,来调控代谢从而减少对作物的伤害。周翔等[47]研究发现,NaCl 处理玉米幼苗后,根系内的 GABA 含量逐渐上升,处理后 36 h 含量最高。盐胁迫下在耐盐ST中GABA1(Q84P54)特异显著上调了1.6倍,可能与GABA 在植物体内的积累,增强植株抗盐性有关。在盐胁迫下,感盐SS中1-氨基环丙烷-1-羧化物氧化酶(P05116)上调表达量是ST的2倍。相关研究表明,1-氨基环丙烷-1-羧化物氧化酶基因编码蛋白能将1-氨基环丙烷-1-羧酸(乙烯生物合成的前体)转变成乙烯,乙烯及乙烯的前体1-氨基环丙烷-1-羧酸处理能提高水稻和拟南芥的抗盐性,1-氨基环丙烷-1-羧酸对高盐环境下的野生型拟南芥幼苗能显著增加抗盐能力[48]。研究表明,感盐SS易于受到盐胁迫的诱导乙烯产生速率较高,进而诱发根部1-氨基环丙烷-1-羧酸(ACC)的积累并转移到叶片,加速叶片中1-氨基环丙烷-1-羧酸向乙烯的转化,抵抗盐胁迫的伤害。而乙烯是一种公认的衰老诱导激素,抑制1-氨基环丙烷-1-羧酸合成酶减少渗透胁迫中多胺氧化酶介导的过氧化氢产生[49],并且多胺氧化酶受乙烯强烈诱导[50],研究结果显示,盐胁迫下,在耐盐ST中多胺氧化酶2(A0A3Q7J1Y7)上调表达2.3倍,耐盐ST在盐胁迫下,多胺氧化酶的增加,有利于抵抗植物的耐盐性。
3.6 差异蛋白涉及能量生产与转化
由于植物对盐胁迫的反应通常伴随着许多胁迫反应蛋白的诱导,因此,可以预期其中一些蛋白在耐盐番茄体内的丰度会发生特别的变化。为了保护细胞免受过多的活性氧(ROS)引起的氧化损伤,植物通常采用一系列复杂的防御机制,例如增强抗氧化酶的活性[51]。过氧化物酶(POD)酶参与ROS信号和氧化还原反应,高POD含量可提高植物的耐盐性[52]。研究表明,耐盐基因型IL-7-5-5中过氧化物酶(A0A3Q7E8T9)在盐胁迫下显著上调,而在敏感品种中蛋白水平没有变化。而过氧化物酶(A0A3Q7ITH0)在盐胁迫下耐、感材料中都上调表达,盐胁迫通常提高ROS的产生,通过细胞膜损伤和对大分子的攻击导致植物细胞氧化损伤。据报道,植物耐盐性与抗氧化酶和抗氧化活性的增加有关[53-54]。盐胁迫下高水平的抗氧化酶参与了防止氧化损伤。
3.7 差异蛋白涉及细胞骨架
植物在盐胁迫下,渗透胁迫和离子毒性往往会对植物细胞结构造成巨大破坏。在研究中,发现在ST中微管蛋白相关蛋白(A0A3Q7F8W6)上调,而SS中下调表达,与PRM验证结果一致。该蛋白与植物盐胁迫适应相关,在真核细胞中构建微管骨架结构,控制细胞扩张和细胞形状,并与GTP结合参与翻译后修饰[55-56]。
4 结 论
286 种响应盐胁迫差异蛋白(变化倍数≥1.5,P<0.05) 在ST/SS分别表达上调的 119/84 种,表达下调的72/73种, 11 种盐胁迫显著差异蛋白,以及一些可能作为番茄耐盐潜在靶标蛋白。番茄幼苗组织中代谢过程、细胞组分以及催化活性响应最明显;PRM 验证结果和 TMT 实验结果总体趋势一致性较高。
