基于学科大概念促思维发展的单元复习课教学
2022-07-13黄凤翔汲丛家
黄凤翔 汲丛家





摘要:以“水溶液中的离子反应与平衡”为例,基于学科大概念设计单元复习课。依据要符合课程标准、要能提纲挈领联接其它小概念、能够落实思维方法等三个原则提炼出本章节大概念“化学平衡在溶液体系中的应用”。在此大概念的统领下,经梳理知识、定性分析、定量分析等三环节的课堂教学,将水溶液中的离子平衡知识结构化。既帮助学生在具体的情境下解决问题,形成学科思维方法,又促进化学核心素养的提升,让学习真实地发生,实现复习课功能。关键词:学科大概念;单元复习课;水溶液中的离子反应与平衡;思维方法
文章编号:1008-0546(2022)07-0064-05中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.07.016
一、引言
学科大概念是近年我国学者研究的热点。其包括三个层面的内容:一是学科大概念具有一定抽象性,是其他概念的联接。王喜斌指出:学科大概念是能反映学科本质,能将学科关键思想和相关内容联系起来的关键的、特殊的概念[1]。二是学科大概念具有结构化的特点。《普通高中课程方案(2017年版)》(下称“新方案”)要求我们“进一步精选学科内容,重视以学科大概念为核心,使课程内容结构化,以主题为引领,使课程内容情境化”。三是学科大概念对核心素养的形成能起到关键作用。新方案指出学科大概念能促进学科核心素养的落实。
相比常规的单元复习,用学科大概念的思想来进行单元复习课的教学设计,有很大的优势。常规的单元复习课大多数是罗列知识清单,缺少对学生思维的指导。而大概念教学需要对不同知识进行关联,从而精准掌握知识的本质,同时还可以提高课堂效率[2]。本文以“水溶液中的离子反应及平衡”复习课为例,阐述学科大概念如何应用于单元复习课的教学中。
二、基于学科大概念的单元复习教学实践
本文阐述的基于大概念单元复习课设计流程,按照五步进行。第一步,确定章节大概念。要提炼出教学内容所蕴含的学科大概念需要遵循三个原则,首先要符合课程标准;其次要提纲挈领,联接其他小概念;再次要能够落实思维方法培养。第二步,学情分析。精准的学情分析,有助于明确学生的认识发展点,也是制定教学目标的依据和实现精准教学的保障。为了确保学情分析结果的“精准”,需要运用技术手段分析前测数据、问卷调查数据,再结合以往教学经验进行研判。第三步,确定教学目标及评价目标。在精准判断学情的基础上,结合課标、考纲精准确定教学目标及评价目标,即明确单元复习课教学之后学生应该达到的认识水平。第四步,设计教学情境,开展教学活动。教学情境需有利于让学生思维外显,将学科大概念与基本概念联接起来,然后通过开展教学活动落实化学核心素养。第五步,教学反馈。即评估教学效果,实现“教、学、评”一体化,评价结果不仅是本节课终点,还是下节课的起点,从而实现“教、学、评”水平的不断上升。大概念下的五步单元复习课设计流程见图1。
1.确定章节大概念,构建知识结构图
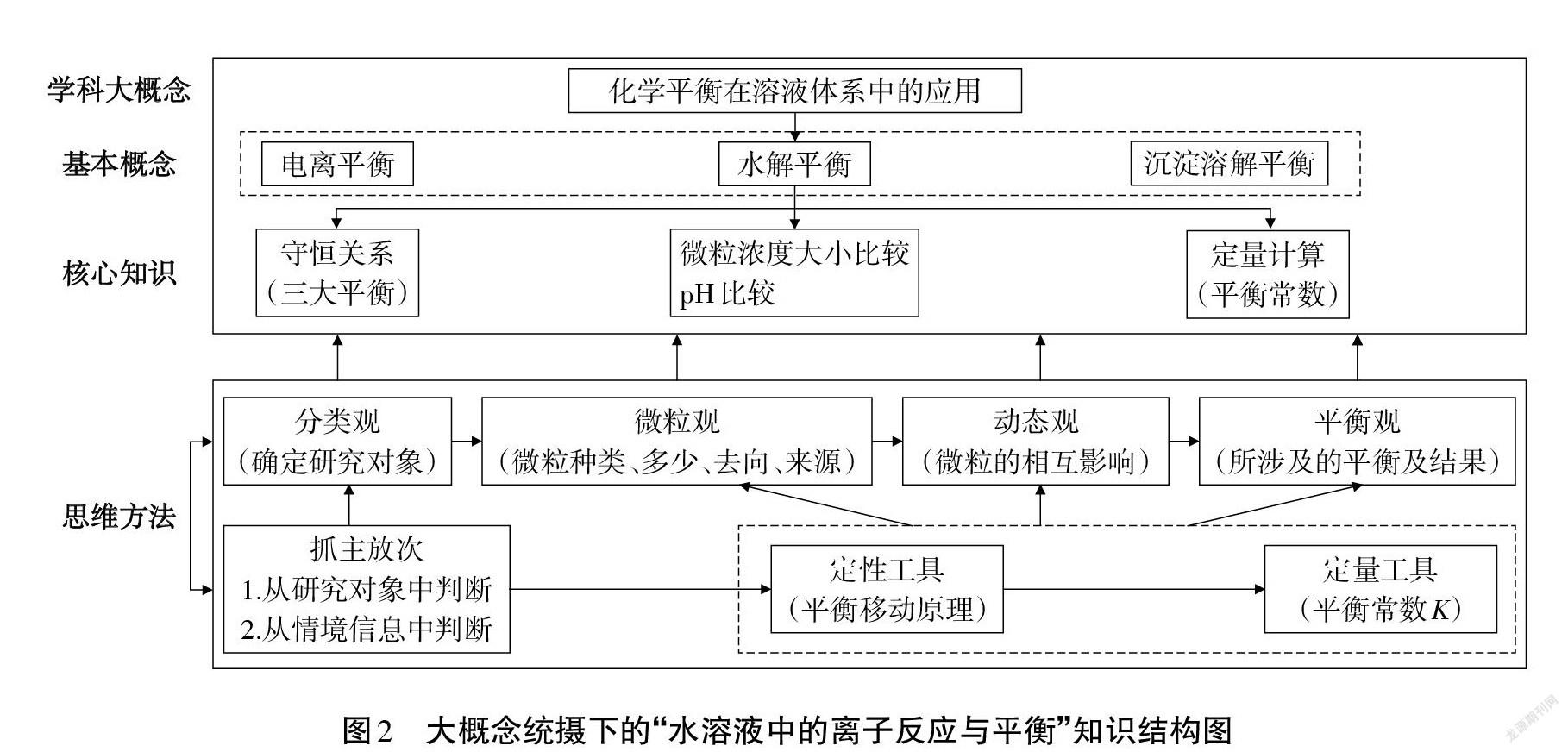
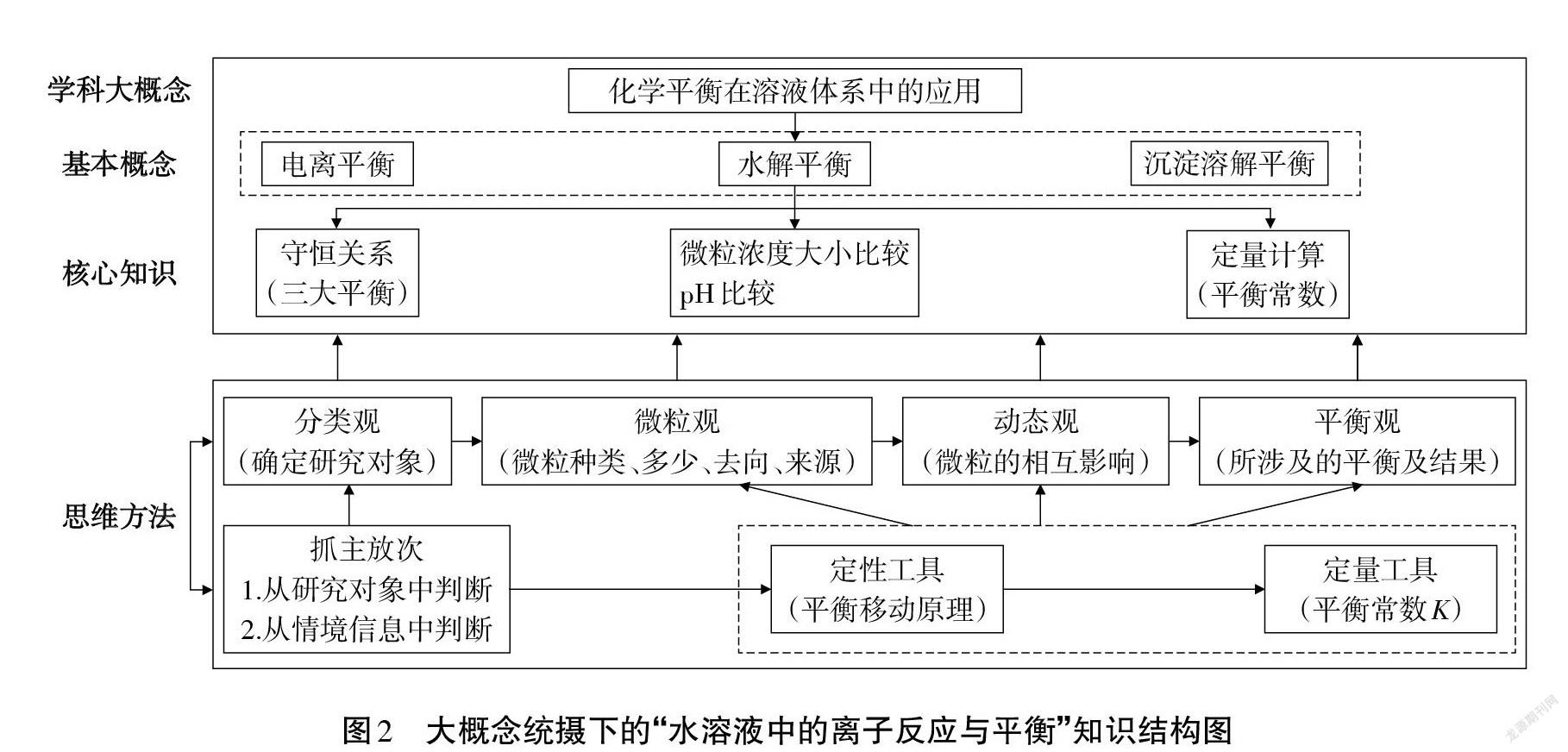
高考对“水溶液中的离子反应及平衡”的考查,偏重离子平衡的微观过程和对于整个溶液系统的整体分析,利用化学平衡的一般思路,解决溶液中的复杂问题[3]。此章节研究的环境是:水溶液;研究的内容是:离子平衡;理论依据是:化学平衡移动原理及平衡常数。也就是用化学平衡原理来解决溶液体系中的离子平衡,实则是化学平衡的应用,因此,此章节内容涵盖在“化学平衡在溶液体系中的应用”这一学科概念之下。该概念联接其它内容,起提纲挈领作用,且能够落实分类观、微粒观、动态观、平衡观等化学思维方法。因此确定为此章节的大概念,以这一大概念为统领,可提炼出图2所示的知识结构图,该结构图呈现出学科大概念统摄下的基本概念、核心知识及解决此类问题的思维方法。
2.精准获取学生学情,明确学生的认识发展点
“水溶液中的离子反应与平衡”是中学化学基本理论的一个重要部分,也是学生整个中学阶段的难点。本章内容比较抽象,综合性强,难点和易混淆点较多,因此学生的迷思概念也比较多。结合前测及问卷调查数据,可以确定学生主要存在以下认识障碍:
第一,对于化学平衡、电离平衡、水解平衡、沉淀溶解平衡的理论体系缺乏整体认识,对其适用对象没有清晰的定位(电解质存在电离平衡还是水解平衡?出现混乱)。
第二,面对多种平衡共存时,分不清平衡的主次,导致分析问题时思维混乱。
第三,对电解质溶液的分析没有形成良好的思维习惯和分析技能,习惯定性思维而欠缺定量思维。
第四,综合分析问题的能力不强,不能熟练运用宏观与微观、定性与定量等化学学科思维方法去分析具体问题。
3.确定单元复习教学目标及评价目标,评判学生应该达到的认识水平
(1)教学目标
①通过课前梳理氨水、碳酸饮料、饱和 BaCO3溶液中存在的平衡,明确溶液中的三大平衡体系的研究对象及离子行为;并通过分析含 NaHCO3晶体的饱和溶液在水里的行为,巩固从物质分类的角度抽取各种平衡的思维方法,落实微粒观、变化观。
②以NaHCO3溶液滴入FeCl3溶液、CaCl2溶液为载体,根据溶液中存在的平衡,预测宏观现象、实验检验、理论分析,在分析解决问题的过程中落实了一个思想:对于多平衡体系,要结合具体的情境抓住主要矛盾,透析问题的本质;并构建了用平衡原理解决分析问题的思维模型;落实宏观辨识、微观探析和证据推理、模型建构核心素养。
③通过从定量角度分析 NaHCO3、NH4HCO3溶液的酸碱性,明确研究水溶液体系中的平衡除了有定性工具——平衡移动原理,还有定量工具——K。
(2)评价目标
①通过分析不同的电解质存在的平衡,诊断学生的分类观、微粒观及变化观。
②通过分析混合体系,诊断学生证据获取能力,结合具体的情境抓住主要矛盾,透析问题本质的能力,并感受动态平衡思想的形成过程。
③通过分析电解质溶液的酸碱性,诊断学生从定量角度分析问题的能力。
4.设计教学情境,进行教学活动,落实化学核心素养,优化学生思维方法
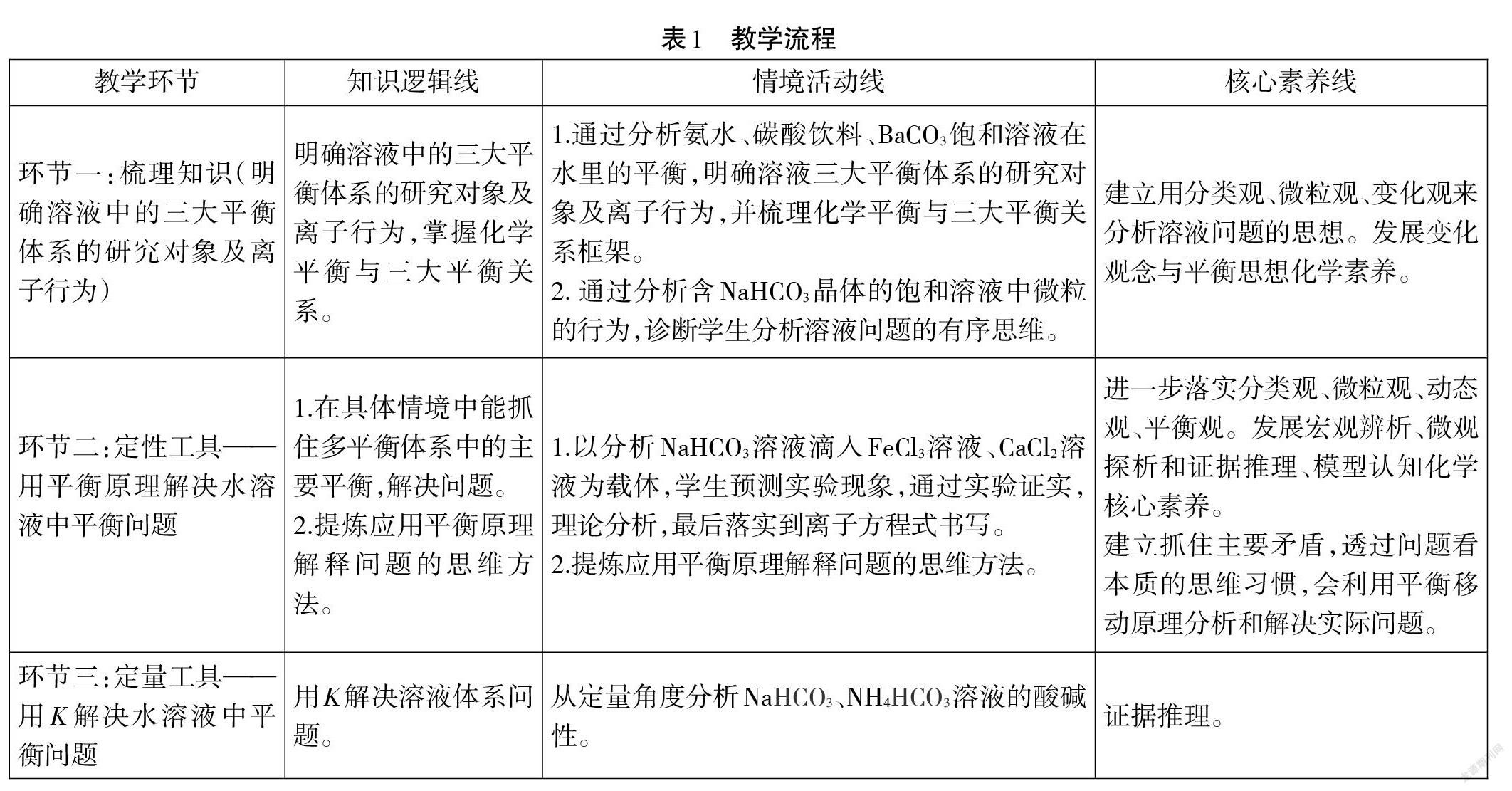
课堂教学流程见表1。
教学实录如下。
(1)环节一:梳理知识,巩固从物质分类的角度抽取各种平衡的思维方法,落实微粒观、变化观。
【学习任务1】分析氨水、碳酸饮料、饱和BaCO3溶液中存在的主要平衡。
【学生出现的问题】氨水体系存在:NH4(+)+H2ONH3· H2O+H+情况;碳酸饮料体系存在:HCO 3(-)+ H2OH2CO 3(-)+OH-情况;饱和 BaCO3漏写 CO3(2)-的水解平衡。
【引导】先把电解质进行分类,氨水和碳酸饮料的溶质都属于弱电解质,存在的主要平衡是电离平衡, NH4(+)及HCO 等微粒在体系中含量很少3(-),故不再分析其存在的水解平衡。饱和 BaCO3存在溶解平衡,同时 BaCO3是强电解质,在水里完全电离,故体系中存在着相对较大量的CO 故体系中应存在CO3(2)-的水解平衡。
【归纳、梳理】分析溶液中微粒行为的思维方法:溶质分类→抽取对应的平衡(溶质是弱电解质,对应的是电离平衡;溶质是盐,对应的是水解平衡;溶质是难溶电解质或是饱和溶液,对应的是溶解平衡)→抓主放次。水溶液中三大平衡及对象,三大平衡与化学平衡的关系如图3所示。
【课堂检测1】一份含NaHCO3晶体的饱和溶液中,存在什么平衡?按主次顺序分别写出各个平衡。
【学生情况】有了思维方法:溶质分类→抽取对应的平衡→抓主放次,学生分析思路没问题,但出现了 NaHCO3(s)=Na+(aq)+HCO3(-)(aq)情况。
【引导】这是混淆了电离反应式和沉淀溶解平衡。
设计意图:以典型电解质为载体梳理电离平衡、水解平衡、沉淀溶解平衡的研究对象,对知识点进行适当的整合,消除以往对三种平衡认识上的误区和盲点。让学生明确溶液中的三大平衡体系的研究对象及离子行为,并通过NaHCO3体系作为课堂检测,评价学生是否具备有序分析溶液问题的思维方法。选择 NaHCO3晶体饱和溶液的原因,是因其刚好囊括三类平衡。首先,从分类角度来看,属于电解质(含晶体的饱和溶液),存在溶解平衡;又可归属为盐,存在水解平衡;还可归属为弱电解质(HCO3(-)),存在电离平衡。
(2)环节二:定性工具——用平衡原理解決水溶液中平衡问题。
【学习任务2】根据实验现象,分析NaHCO3饱和溶液在条件变化时的离子行为(见表2)。
【演示实验】见图4。
【讨论1】表2中条件的变化,对NaHCO3饱和溶液产生什么影响?【讨论2】主要影响哪个平衡?如何影响?
【学生答题情况】根据实验现象,部分同学能够正确分析实验1 的沉淀是 Fe(OH)3,实验2 的沉淀是 CaCO3,从而能够正确得出实验1 主要影响 HCO3(-)的水解平衡;实验2主要影响 HCO3(-)的电离平衡,对应的离子方程式为:3HCO3(-)+Fe3+ =Fe (OH)3 ↓ +3CO2↑;2HCO3(-)+Ca2+=CaCO3↓+ H2O+CO2↑。
出现问题一:认为沉淀是Fe2(CO3)3,离子方程式:6HCO3(-)+2Fe3+=Fe2(CO3)3↓ +3H2O+3CO2↑;出现问题二:认为沉淀是 Ca(OH)2,离子方程式为:2HCO3(-)+ Ca2+=Ca(OH)2 ↓+2CO2↑。
【学生讨论得出结论】问题1:Fe2(CO3)3沉淀不存在,Fe3+与 CO3(2)-在溶液中存在双水解,最后生成沉淀 Fe(OH)3;问题2:Ksp [Ca(OH)2]>>Ksp (CaCO3),所以沉淀CaCO3更容易析出,沉淀2是CaCO3更合理。
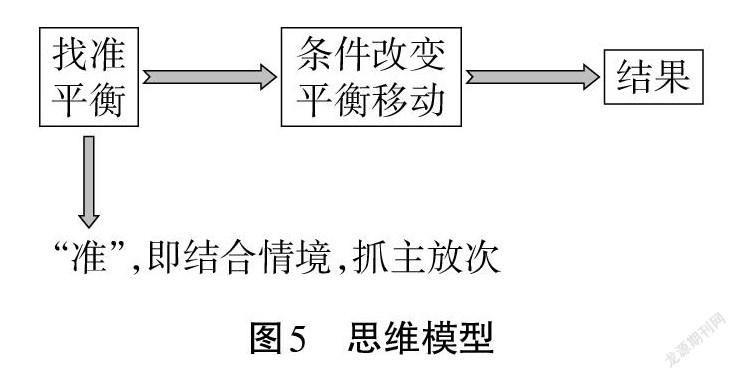
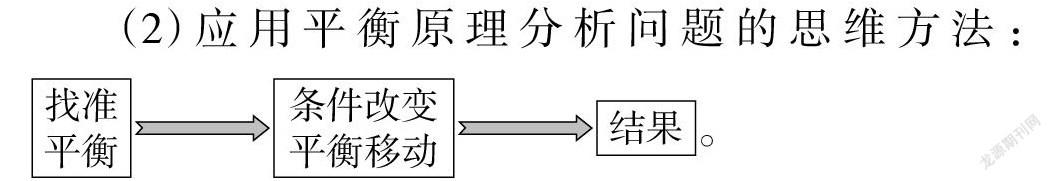
【归纳、梳理】第一,对于多平衡体系,要结合具体的情境抓住主要矛盾,透析问题的本质。
第二,提炼出应用平衡原理解释问题的思维方法(见图5):
【课堂检测2】向0.1 mol · L-1 NH3· H2O 中加入 NH4Cl 晶体,溶液的pH变小,请结合化学平衡移动原理解释原因。
【学生情况】大部分学生能根据图5所示模型,正确分析原因。但出现个别答案:氨水中存在电离平衡 NH3· H2ONH +OH 加入的NH4Cl 晶体显酸性,H+与OH-结合,使得OH-浓度减小,溶液的pH变小。
【学生评价】加入NH4Cl,该物质是强电解质,完全电离出NH4(+),而体系中的 H+是NH4(+)微弱水解得到的产物,故c(NH4(+))>>c(H+),因此NH 对NH4(+)3 · H2O 电离的影响大于H+,出现多个影响因素时,要抓主放次。
设计意图:大概念统摄下的教学,充分暴露学生问题,使学生思维外显,有利于深入理解知识的本质;建立良好的逻辑思维习惯,利用平衡观和平衡移动原理分析和解决实际问题,在分析解决问题的过程中落实了一个思想:对于多平衡体系,要结合具体的情境抓住主要矛盾,透析问题的本质;此外构建了用平衡原理解决分析问题的思维模型;落实宏观辨识、微观探析和证据推理、模型认知核心素养。
(3)环节三:定量工具——用K 解决水溶液中平衡问题。
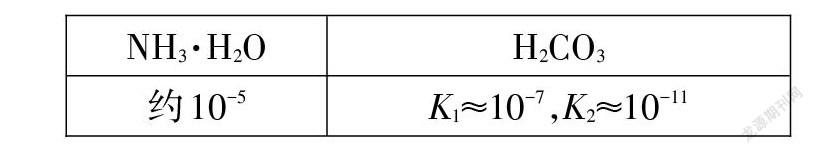
【学习任务3】已知下列物质的电离常数:
(1)NaHCO3溶液显(),通过计算说明;
(2)NH4HCO3溶液显(),通过计算说明。
【思路评析】求酸式盐的酸碱性,第一步,准确判断电离常数;第二步,计算水解常数;第三步,比较电离常数和水解常数大小,谁大显谁性。以 NaHCO3溶液为例,Ka=Ka2≈10-11;Kh=Kw/Ka1≈10-7;Kh>Ka,而HCO3(-)水解显碱性,故NaHCO3溶液显碱性。
【实验验证】用pH试纸测定NH4HCO3溶液的pH。
设计意图:通过从定量角度判断物质的酸碱性,明确研究水溶液体系中的平衡除了有定性工具——平衡移动原理,还有定量工具——K。通过实验验证落实证据推理素养。
课堂总结:(1)水溶液体系学习的方法:找平衡(抓主放次),定性、定量两种工具分析水溶液中平衡问题。
(2)应用平衡原理分析问题的思维方法:
学生领悟第三章学习的灵魂:找平衡(抓主放次),定性工具分析,定量工具分析。
三、教学效果与反思
1.教学效果
通过访谈,学生认为通过大概念教学后,对水溶液体系的分析思路更清楚。有以下三点收获:①寻找水溶液体系的平衡,根据:溶质分类→抽取对应的平衡→抓主放次。②用平衡原理分析问题时,找准平衡的依据是根据题干信息;分析影响因素,而同时存在多个影响因素时要抓主放次(量大影响大或从结果逆向分析影响因素)。③明确K 的分析思路。平衡移动原理无法解决的问题,需用到平衡常数K,K 也是解决问题的工具。
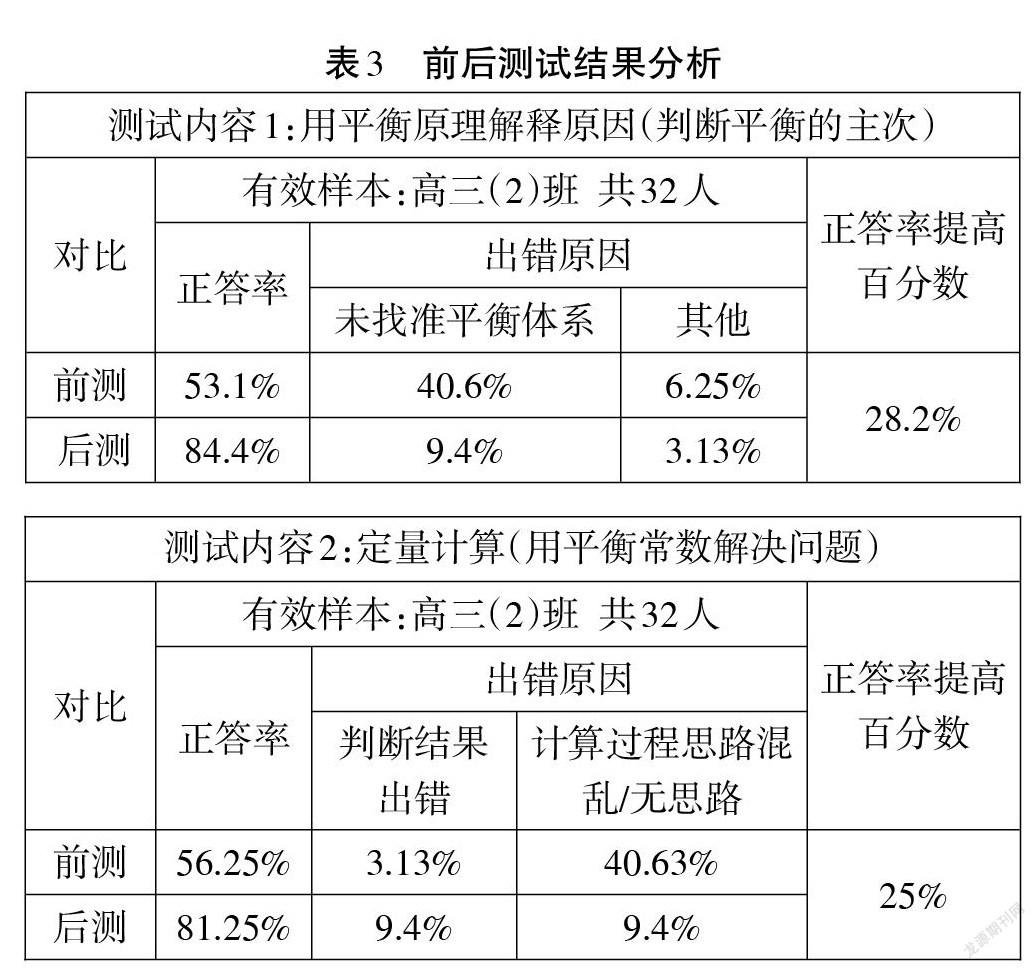
本案例采取前后测对比。测试结果表明:第一,通过大概念教学后,学生在使用平衡原理解释问题的题型上进步明显,正答率提高了28.2%。原来这类题型的错因主要体现在未能正确找准体系的平衡,教学后,学生能够在多平衡体系里,正确判断主平衡。第二,定量计算能力进步明显,正答率提高25%。通过教学后,此类题型的分析思路清晰。结果分析见表3。
2.教学反思
(1)“双新双减”背景下,基于大概念的教学可以实现“减负、提质、增效”的目的
“双新”即新课堂新教材;“双减”即减轻校内作业负担,减轻校外辅导机构文化课的辅导。双减后,教育的分层决定于课堂,高效的课堂至关重要,促思维发展的课堂才是高效的课堂。学科大概念是指向具体学科知识背后的更为本质、更为核心的概念或思想,因此,基于大概念的教学能提升学生思维能力,减轻学生的学习负担,提高课堂质量,从实践可看出教学效果显著。
(2)大概念教學促学生思维能力发展
2019人教版选择性必修1第三章“水溶液中的离子反应及平衡”,教材内容的编排顺序按照“弱电解质的电离→水的电离和溶液的酸碱性→盐类的水解→难溶电解质的溶解平衡”这样的框架,学生关注单一知识点的学习,难以突出化学平衡理论的指导作用,学生对这些知识整合在一起的思考要薄弱些,难以建立起对水溶液体系的整体认识框架,面对综合题时常常弄不清楚这是一个什么溶液体系,该用哪个平衡进行分析。为了弥补各知识点在新授课学习时相对孤立的不足,在进行单元复习教学时,基于学科大概念,以典型电解质为载体梳理电离平衡、水解平衡、沉淀溶解平衡的研究对象,对知识点进行适当的整合,消除以往对三种平衡认识上的误区和盲点;从定性角度(平衡原理)、定量角度(使用平衡常数K)来指导水溶液中离子平衡的学习;在分析问题时落实了一个思想:对于多平衡体系,要结合具体的情境找准主要矛盾,透析问题的本质;搭建用平衡原理解决分析问题的思维模型。
参考文献
[1] 王喜斌.学科“大概念”的内涵、意义及获取途径[J]. 教学与管理,2018(24):86-88.
[2] 黄建萍.基于学科大概念的生物单元教学设计研究[D].南昌:南昌大学,2020.
[3] 胡久华,袁丽琴,王澜,丁芬,郇乐,赵荣梅.基于学生认识发展点的高三水溶液复习教学研究[J]. 化学教育,2014,35(13):46-51.
