油田污染土壤土著菌的高盐高油驯化液理化特性研究
2022-07-12桑义敏艾贤军沈齐英戴铁诚刘小娟
刘 畅,桑义敏*,艾贤军,2,沈齐英,刘 婧,戴铁诚,刘小娟
(1.北京石油化工学院环境工程系,北京 102617; 2.北京建工集团环境修复有限公司,北京 100015)
全球石油年产量约35 亿t,而在开采、运输及再加工过程中泄漏量可达20万t至200万t[1]。目前,我国现有油气田约400 个,所处场地土壤均受到不同程度的污染,部分污染土壤石油含量超自然土壤背景值500~1 000倍[2]。石油进入环境后会自主扩散到土壤、地下水及空气中,危害周边人群身体健康[3-4]。在现有场地修复技术中,物理和化学技术存在一定局限性,常存在消耗大量能源和化学品、带来二次污染等问题[5-6]。生物法修复石油污染土壤的优势在于效率高、成本低、无二次污染[7]。美国环保署指出,相比于以分离污染物为目的的常规修复技术,生物修复法的优势在于能够直接消除污染物[8]。生物修复的核心是高效降解菌对污染物的快速清除作用,菌种的特性是修复成败的关键。
然而,在实际的修复实践中,往往面临低温、高温、重金属、盐碱等各类极端环境,常规微生物难以生存,大大增加了微生物修复的难度和挑战。其中,高盐碱环境下的石油烃污染形势尤为突出。石油污染常伴随着盐碱环境存在,在我国境内分布的大量盐碱地中都有丰富的油气资源[9]。此外,海面漏油、海岸线输油管道破裂等问题都会造成沿岸盐碱土壤受到污染[10]。土壤盐渍化对生物降解石油烃具有很大的抑制作用,高盐胁迫条件制约了石油烃降解菌的生长及其对石油烃的修复能力,进而造成高盐碱石油污染环境中生物修复技术普及应用的瓶颈和障碍[11]。
笔者从国内典型盐碱地油田长期受污染土壤中提取耐盐石油烃降解菌,通过人为手段不断增强胁迫菌株生存的环境,加速耐盐石油降解菌株的自然迭代过程,期间持续测定耐盐菌株驯化培养液各项理化性质变化,表征菌株对于自身所处环境带来的积极/消极影响,以期为微生物修复盐碱化石油污染土壤提供一定的菌种和理论支撑。
1 实验部分
1.1 实验材料
1.1.1 土著菌来源
驯化的土著菌来源于新疆维吾尔自治区克拉玛依市白碱滩区长期受石油污染的油田老化土壤。白碱滩区位于准格尔盆地西北边缘,地貌总体为戈壁荒漠,1956年石油工人勘探时是茫茫盐碱地。长期的石油开采形成了石油污染老化土壤,同时考虑其盐碱地的固有属性,这里蕴含着丰富的适应盐碱胁迫环境的石油烃降解菌。
1.1.2 驯化培养基
(1)富集培养基各组分配比:牛肉膏3 g、蛋白胨10.0 g、NaCl 5.0 g、蒸馏水1 000 mL、pH7.5;
(2)无机盐培养基各组分配比:NH4Cl 0.5 g、KH2PO40.5 g、K2HPO41.0g、MgSO40.5 g、CaCl20.2 g、KCl 0.1 g、微量元素溶液10 mL、水1 000 mL;
(3)高含盐/油培养基各组分配比:无机盐培养液100 mL、润滑油0.1 mL、NaCl 3.0 g;
(4)微量元素溶液各组分配比:FeSO4·7 H2O 0.5 g、ZnSO4·7 H2O 0.2 g、MnSO4·H2O 0.06 g、CaCl23 g、蒸馏水1 000 mL。
1.1.3 实验仪器
DDHZ-300台式恒温振荡器;GDYQ-720S快速恒温培养箱;JSM280G-18手提式压力蒸汽灭菌器;GT-9600超净工作台;DH-101-2BS电热恒温鼓风干燥箱;TD5102电子天平;HACH2100N浊度仪;UV-2600紫外分光光度计;Multi 3620 IDS便携多通道多参数水质测量仪;Mastersizer 2000激光散射粒度分析仪。
1.2 实验方法
1.2.1 耐盐石油烃降解菌的筛选与驯化
(1)耐盐菌群初筛
取5 g克拉玛依白碱滩油田污染土壤,加入100 mL无机盐培养基中,25 ℃、120 r/min恒温振荡培养3 d。取无机盐培养基中菌液10 mL加入富集培养基,25 ℃、120 r/min恒温振荡继续培养3 d,获得耐盐菌菌群。最后,取无机盐培养基中菌液10 mL加入高含盐/油培养基中,25 ℃、120 r/min恒温振荡培养9~10 d,获得耐盐石油烃降解菌菌群,培养完成后将菌液于4 ℃冰箱保存,留待进一步实验。
(2)耐盐石油烃降解菌的驯化
采取高含盐/油培养基模拟菌株自然生存环境,以人为手段加速菌株适应胁迫环境的过程,通过将初筛后获得的耐盐石油烃降解菌菌群投放至高浓度含盐/油无机盐培养基中,不断增强盐/油浓度胁迫环境的强度,无法适应该环境的菌株会因盐浓度过高导致渗透压失衡或过高浓度石油烃的毒害作用而被淘汰,最终筛选驯化出能够在高浓度盐/油条件下存活且有效利用石油烃的耐盐菌株,具体的菌株驯化流程如图1所示。除Stage 1外,各驯化阶段分别接入上一驯化阶段结束后的菌液10 mL进行培养,培养条件为100 mL无机盐培养基,加入相应浓度油/盐,在25 ℃、120 r/min恒温振荡培养3 d。
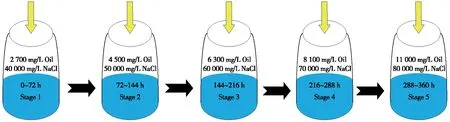
图1 耐盐石油烃降解菌的驯化流程Fig.1 Domestication procedural design of halophilic petroleum-degrading bacteria
1.2.2 菌株驯化培养液理化性质测定方法
菌株驯化分为5个阶段Stage 1~Stage5,每个阶段的第12、24、36、48、60、72 h时分别测定耐盐菌驯化培养液浊度(Turbidity Degree,TD)、光密度(Optical Density at 600 nm,OD600)、pH、氧化还原电位(Oxidation-Reduction Potential,ORP)、电导率(Electric Conductivity,EC)、总溶解性固体(Total Dissolved Solids,TDS)等指标,每个时刻取样测定3次,以平均值和误差棒表示最终的数据结果。每次采用UV-2600紫外分光光度计测定OD600,利用美国哈希HACH 2100N型台式浊度仪测定TD,利用Multi 3620 IDS便携多通道多参数水质测量仪测定pH、ORP、EC、TDS等指标。
2 结果与分析
2.1 驯化过程中培养液的TD和OD600变化
微生物培养过程中,随着时间的延长,菌株数量不断增加,培养基菌液会出现不同程度的浑浊[12],体现出TD的变化,此外,菌液中微生物细胞浓度的变化也会体现在一定光吸收波长下的OD变化。Stage1~Stage5阶段驯化培养液的TD和OD600变化情况如图2所示。总之,菌液中微生物细胞浓度与液体的TD、OD成正比,与透光度成反比[13]。
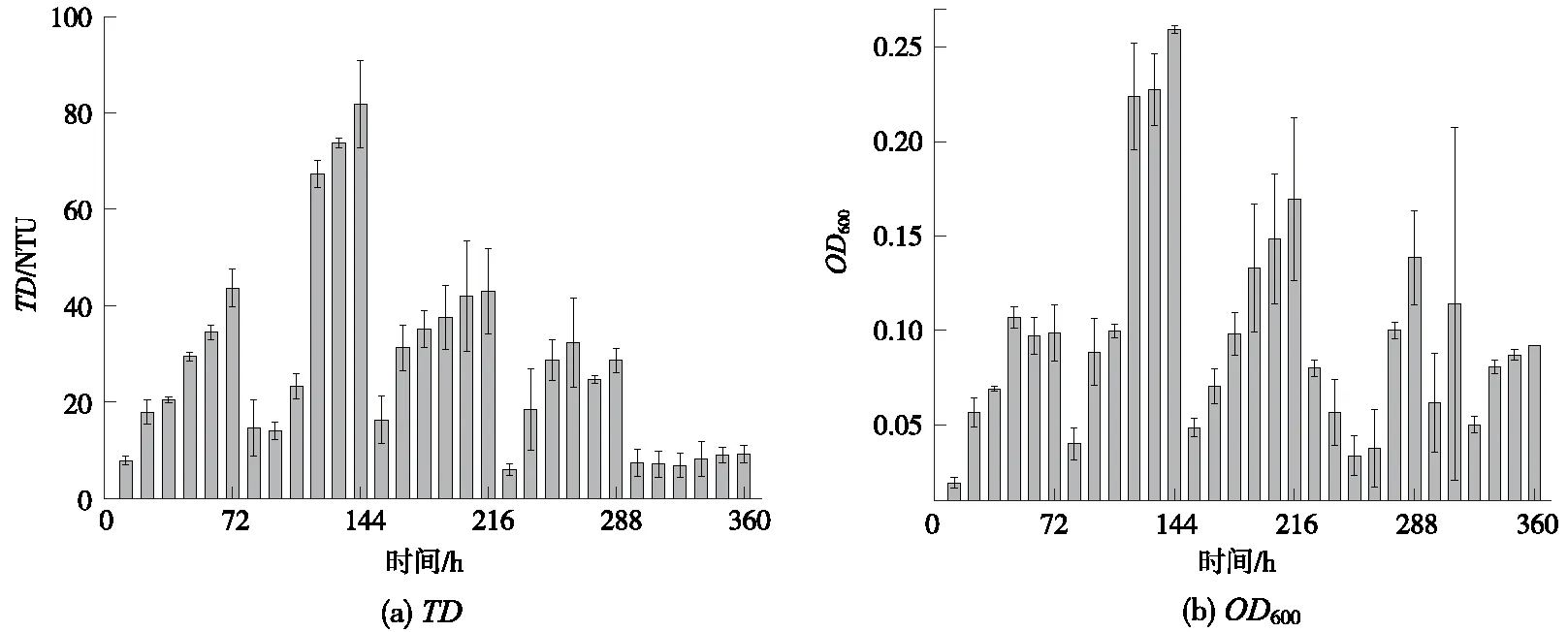
图2 Stage1~Stage5阶段驯化培养液的TD和OD600变化情况Fig.2 TD and OD600 variation of culture medium in domestication Stage 1~5
由图2可知,在Stage1~Stage5阶段TD与OD具有较好的相关性。对于Stage1~Stage4阶段,TD和OD都稳步增大,说明菌种逐渐适应新的更高强度的高盐、高油胁迫环境,菌种数量逐渐增大,预示着驯化目标的成功达成。其中,在Stage 4阶段(驯化时间为216~288 h),胁迫环境中的油质量浓度已经达到8 100 mg/L,盐质量浓度已达70 000 mg/L,但是,仍然取得了较好的驯化效果,驯化后的高效菌株数量增加明显。对于Stage 5阶段(驯化时间为288~360 h),胁迫环境中的油质量浓度已经达到11 000 mg/L,盐质量浓度已达80 000 mg/L,驯化后菌株数量呈现缓慢的增长,说明该高胁迫条件接近菌株短期承受的临界值。但是,如果在保持胁迫条件不变的情况下继续适当延长驯化时间,或调整引入新的刺激菌株生长条件,还是有望获得适应更高高胁迫条件的菌株。
2.2 驯化过程中培养液的pH变化
生境或培养基中pH对于微生物生命活动的影响是多方面的:一方面,pH高低影响细胞膜所带的电荷,从而影响细胞对营养物质的吸收状况;另一方面,pH高低还可改变培养基中的有机化合物的离子化程度,进而影响某些化合物分子进入细胞的状态,最终促进或抑制微生物的生长[14]。Stage1~ Stage 5阶段驯化培养液的pH变化情况如图3所示。

图3 Stage1~Stage5阶段驯化培养液的pH变化情况Fig.3 pH variation of culture medium in domestication Stage1~Stage5
由图3可知,在Stage1~Stage5整个驯化阶段(0~360 h),培养基菌液pH变化范围基本在5.9~8.1,驯化初始阶段pH均值约为7.6,结束阶段pH均值约为5.9,总体来看pH呈降低趋势。对于每个阶段,培养基中微生物经过一段时间的适应性降解后,菌液pH先增加为弱碱性后逐渐降低。烃类物质本身是极弱的酸,离解后会产生强碱介质[15],无机盐培养基本身为中性,在初始驯化阶段加入少量的石油烃,对于溶液的酸碱性无明显影响,而微生物在盐/油胁迫环境中生长繁殖阶段,以石油烃为唯一碳源,对于烃类物质的离解导致菌液向碱性转变;结合菌液TD和OD变化可知菌株大量繁殖,在微生物进一步充分降解石油烃之后会产生酸性物质,导致菌液pH降低。以微生物降解直链烷烃为例,直链烷烃的次末端受到微生物作用时,在链内插入氧生成仲醇,再进一步氧化生成酮,接着酮代谢为酯,酯键裂解生成脂肪酸与伯醇,脂肪酸再经过ω-羟基化反应使双末端甲基被氧化生成二羧酸,伯醇继续氧化生成醛与羧酸,羧酸按照β-氧化进一步氧化分解,最终生成CO2与H2O[16-17],该微生物降解直链烷烃过程可以一定程度的佐证菌液的酸碱性变化规律。
2.3 驯化过程中培养液的ORP变化
微生物的新陈代谢生命活动是一切生物化学氧化还原反应的总称。一方面,周围环境的ORP高低,一定程度上决定了微生物的生化反应性质是氧化还是还原,也会影响酶的活性、细胞同化能力、代谢途径和代谢产物;另一方面,微生物的生化反应进程与新陈代谢活动也会改变周围环境的ORP。因此,监测驯化培养液的ORP,可以间接判断驯化菌种的活性。该驯化菌株是好氧菌(aerobes),以氧为呼吸链的最终电子受体,最后与氢离子结合成水。在呼吸链的电子传递过程中释放出大量能量,供细胞维持生长和合成反应使用。Stage1~Stage5阶段驯化培养液的ORP变化情况如图4所示。

图4 Stage1~Stage5阶段驯化培养液的ORP变化情况Fig.4 ORP variation of culture medium in domestication Stage1~Stage5
由图4可知,对于每个驯化阶段,整体上看趋势基本上是ORP在升高,这与pH总体上下降的变化趋势相一致。氧化还原电位与氧分压有关,也受pH的影响。pH低时,氧化还原电位高;pH高时,氧化还原电位低[18-19]。ORP升高的另一个原因是空气的氧气溶解进入培养液。整个驯化过程中,菌液ORP波动范围较大(40~120 mV)。ORP值在+100 mV以上时,可满足驯化好的耐盐石油烃降解菌的生长;ORP值在+100 mV以下时,应该是耐盐石油烃降解菌不断变异、适应环境或被淘汰的自然筛选过程。
2.4 驯化过程中培养液的EC和TDS变化
耐盐菌通过调节渗透压适应高盐环境,其适应机制在于:一是在细胞内积累高浓度的K+抵抗胞外的高渗环境;二是在细胞内积累或产生相容性介质以适应高盐环境;三是嗜盐菌对高浓度Na+的依赖性,嗜盐菌细胞壁糖蛋白中的酸性氨基酸的羧基需要Na+来稳定,故高Na+浓度可以维持细胞壁结构完整,同时保证细胞功能正常[20]。反应培养基盐浓度的指标就是EC和TDS。Stage1~Stage5阶段驯化培养液的EC和TDS变化情况如图5所示。

图5 Stage1~Stage5阶段驯化培养液的EC和TDS变化情况Fig.5 EC and TDS variation of culture medium in domestication Stage1~Stage5
由图5可知,菌液EC和TDS的变化趋势几乎完全一致,反应均是盐质量浓度的变化水平。对于每个单独驯化阶段,培养液的EC和TDS均存在一个先升高后降低的过程,说明耐盐菌在逐渐调整渗透压进而适应高盐高油胁迫条件,与驯化菌种数量不断增加的事实一致。在整个驯化阶段Stage 1~Stage5(0~360 h),EC和TDS的基本趋势是逐渐增大,源于培养液不断提高的盐的质量浓度。在菌株驯化的Stage 1阶段(0~72 h),菌液EC和TDS波动幅度较低,说明该盐度条件对于菌株细胞内外离子交换影响较小。在菌株驯化的Stage 5阶段的300 h时,菌液EC和TDS显著增大,这是因为高胁迫度条件使部分菌株无法适应环境,从而细胞膜遭到破坏,其半透性丧失,且流动性也降低,进而菌体的保护屏障被打破,内部电解质大量溶入培养液所致[21]。
3 结论
对新疆白碱滩油田污染老化土壤中的土著菌进行了提取、驯化、筛选,探讨了驯化培养液的理化参数变化。结果表明:
(1)TD、OD600不断增大,预示短期(72h)内成功驯化出了一定数量的适应高盐(70 000 mg/L)、高油(8 100 mg/L)胁迫环境的菌株;
(2)pH由7.6逐渐降为5.9,因为耐盐菌降解石油烃之后,可能生成羧酸、CO2等酸性物质;
(3)受pH降低趋势的影响,ORP逐渐增大;
(4)EC和TDS质量浓度逐渐变大,源于培养液不断提高的盐质量浓度;单个驯化阶段内先升高后降低,是逐渐调整渗透压进而适应高盐高油胁迫条件的过程;过高的胁迫条件(油质量浓度为11 000 mg/L,盐质量浓度为80 000 mg/L)使细胞膜遭到破坏,进而菌体的保护屏障被打破,内部电解质大量溶入培养液,致EC和TDS突然升高。
总之,菌株盐耐受度越高,对Na+的转化能力越强,修复盐渍土壤的效果就越好,耐盐菌通过调节内外渗透压来适应高盐度环境保障自身生长繁殖,故选择耐盐且可高效降解石油烃的菌株对修复原油污染的盐渍化土壤具有重要的实际意义。
