急性StanfordA型主动脉夹层术后行连续肾脏替代疗法的危险因素分析
2022-07-11张雪花董柱毕生辉喻雪飞李雅玲杨博王晓武
张雪花 董柱 毕生辉 喻雪飞 李雅玲 杨博 王晓武,
1广州中医药大学研究生院(广州510010);2南方医科大学珠江医院(广州510280)
急性Stanford A 型主动脉夹层(acute type A aortic dissection,AAAD)是指主动脉夹层发病时间≤14 d 的Stanford A 型主动脉夹层,进展迅速,病死率高[1-2],是心血管外科最凶险的疾病之一。未经手术治疗的患者发病1 周病死率超过70%[3],应及时行手术治疗。急性肾损伤是AAAD 术后常见并发症之一,可增加患者手术后的恢复时间及家庭的经济负担。所以如何甄别AAAD 术后急性肾损伤的危险因素及针对危险因素采取有效干预措施成为AAAD 术后围手术期管理的一大重要关注。本研究通过收集总结本中心115 例AAAD 患者围手术期各项数据,分析患者的各项资料,筛选出术后行连续肾脏替代疗法(CRRT)的独立危险因素,并针对这些独立危险因素制定有效围手术期评估标准及干预措施,从而降低患者术后行CRRT 的风险,使患者术后住院时间及家庭负担得到有效控制。
1 资料与方法
1.1 一般资料 收集南方医科大学珠江医院2020年9月至2021年12月收 治 的115 例AAAD 数 据,心脏手术后在监护室行CRRT 患者23 例,余92 例患者未行CRRT 治疗。其中男93 例,女22 例,年龄(53.16±11.43)岁,体质量(71.18±10.21)kg,身高(169.89 ± 6.42)cm,术前肾小球滤过率(59.36 ±31.09)%,术前血肌酐(164.49 ± 141.90)μmol/L,低流量脑灌注时间(17.70 ± 15.72)min,阻断时间(140.13 ± 25.91)min,体外 循环 时间(239.41 ±60.76)min,手术时间(498.78±106.96)min。
1.2 方法
1.2.1 手术方式 患者仰卧位,正中开胸。右侧腋动脉和一侧股动脉插管,上、下腔静脉插管后建立体外循环。左颈总动脉插管行双侧顺行性脑灌注。CPB 降温后,阻闭升主动脉,冷灌心脏停搏,行双侧顺行性低流量脑灌注。切开升主动脉,行Sun's 手术(升主动脉置换+全弓置换+降主动脉象鼻支架植入术)。复温至36 ℃循环稳定后停体外循环,常规关胸。
1.3 统计学方法 本研究资料应用SPSS 20.0 软件进行数据处理。计量资料以表示,CRRT 组与非CRRT 组两组间计数资料比较采用采用χ2检验,计量资料采用两独立样本t检验,将单因素分析中差异有统计学意义的变量纳入logistic 回归分析,确定AAAD 患者术后行CRRT 的独立危险因素。ROC曲线可获得行CRRT的独立危险因素的检验效能,同时得到截断值,计算曲线下面积(area under the curve,AUC)及95%置信区间(95%CI)。P<0.05 为差异有统计学意义。
2 结果
2.1 AAAD 患者围手术期资料 115 例AAAD 患者围手术期死亡19 例,占比16.25%,死亡的原因包括MODS 10 例,低心排血量综合征4 例,呼吸衰竭3 例,脑出血2 例。其中CRRT 组死亡9 例,非CRRT 组死亡10 例,两组病死率差异有统计学意义(χ2=10.655,P=0.001)。
2.2 AAAD 术后行CRRT 的危险因素筛选及其单因素分析 根据筛选AAAD 术后急性肾损伤可能相关因素,将各项围手术期资料分为术前资料(年龄、身高、体质量、性别、术前心梗、肥胖、高血脂病史、术前心包积液、术前肢体缺血、夹层累及冠脉、夹层累及肾动脉、夹层累及瓣膜、吸烟史、术前糖尿病、术前肾小球滤过率、术前肌酐水平、术前肝功能不全、术前射血分数、术前贫血、术前COPD、术前感染、术前心功能、术前高血压病史);术中资料(升主动脉阻断时间、体外循环时间、低流量脑灌注时间、手术时间、术中输红细胞量、术中输血浆量、术中输血小板量);术后资料(术后呼吸机辅助时间、ICU 时间、术后肺部感染、术后低心排)。单因素分析提示夹层累及肾动脉(P<0.001),术前肌酐(P<0.001)、术前肾小球滤过率(P<0.001)、阻断时间(P<0.001)、手术时间(P<0.001)、术中输红细胞量(P<0.001)、术中输血浆量(P=0.006),证实上述变量与急性Stanford A 型主动脉夹层术后行CRRT 有关,见表1、2。
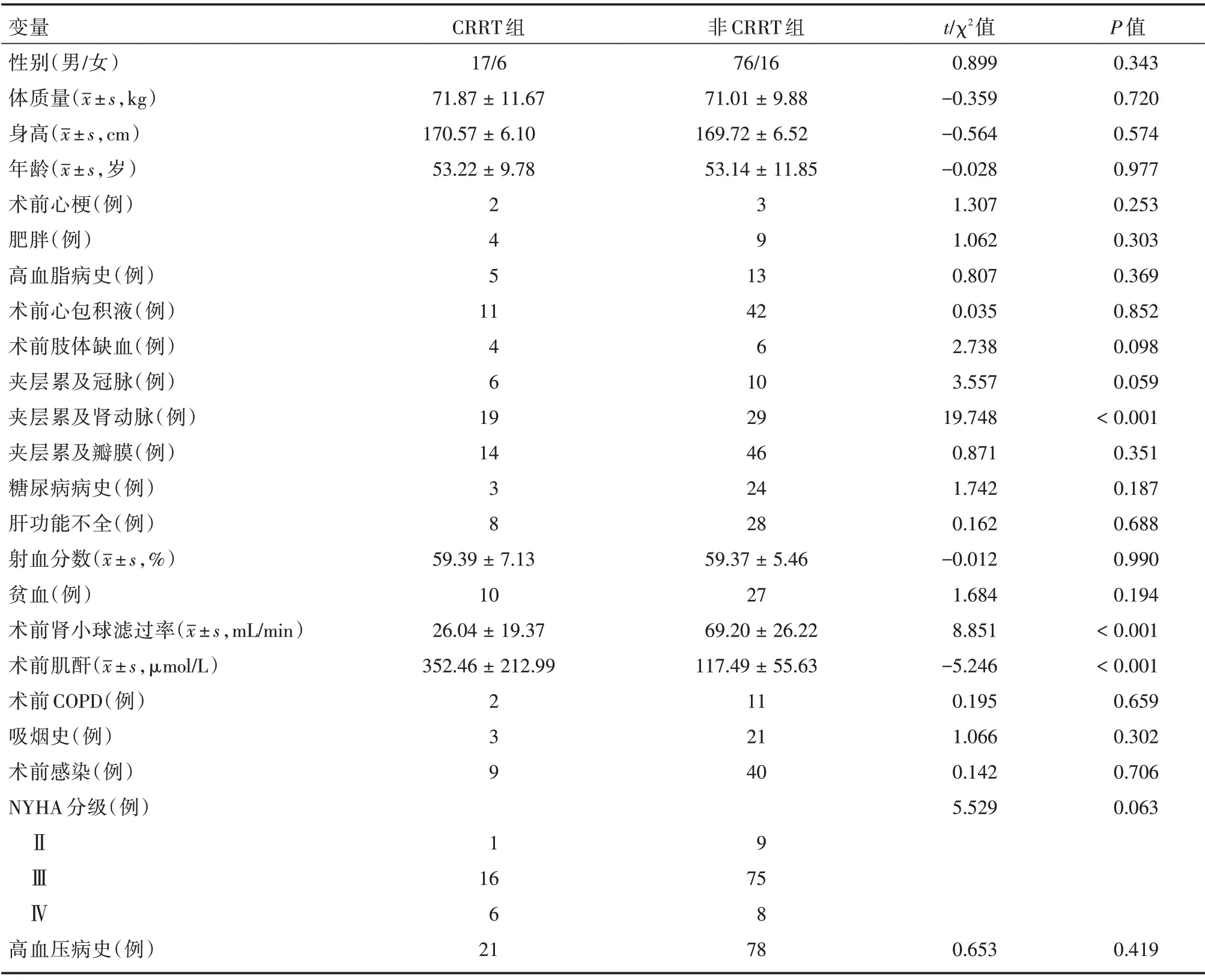
表1 CRRT 组与非CRRT 组两组主动脉夹层患者基线水平一般资料对比Tab.1 Comparison of baseline general data of patients with aortic dissection between the CRRT group and no-CRRT group
2.3 AAAD 术后行CRRT 多因素Logistic 回归分析结果 将表2 中单因素分析获得的相关危险因素中存在统计学意义的指标纳入多因素logistic 回归分析,模型构建成功(χ2=82.149,P<0.001),结果如下:术前肌酐(OR= 1.875,P= 0.014)、阻断时间(OR= 1.874,P= 0.008)、手术时间(OR= 1.014,P= 0.012)、术中输红细胞量(OR= 2.183,P=0.017),证实这些指标是AAAD 术后行CRRT 的独立危险因素。见表3。
表2 CRRT 组与非CRRT 组两组主动脉夹层患者术中及术后资料对比Tab.2 Comparison of intraoperative and postoperative data of patients with aortic dissection between the two groups±s
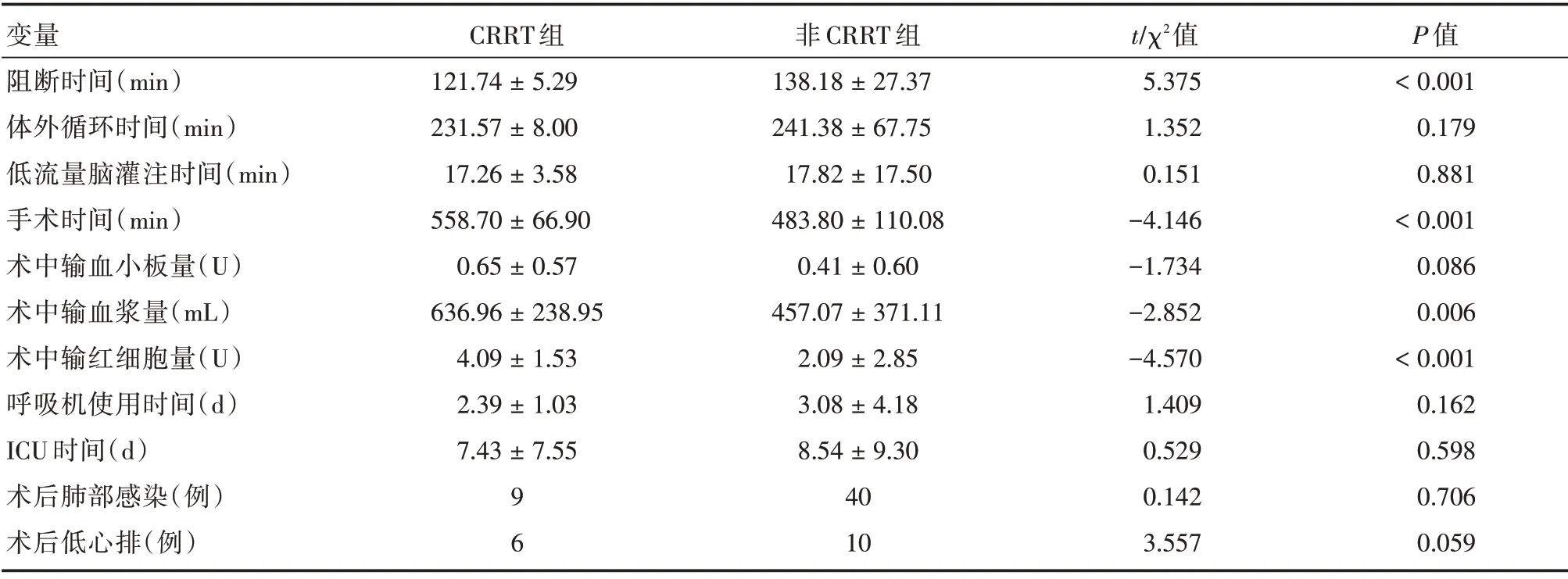
表2 CRRT 组与非CRRT 组两组主动脉夹层患者术中及术后资料对比Tab.2 Comparison of intraoperative and postoperative data of patients with aortic dissection between the two groups±s
变量阻断时间(min)体外循环时间(min)低流量脑灌注时间(min)手术时间(min)术中输血小板量(U)术中输血浆量(mL)术中输红细胞量(U)呼吸机使用时间(d)ICU 时间(d)术后肺部感染(例)术后低心排(例)CRRT 组121.74±5.29 231.57±8.00 17.26±3.58 558.70±66.90 0.65±0.57 636.96±238.95 4.09±1.53 2.39±1.03 7.43±7.55 9 6非CRRT 组138.18±27.37 241.38±67.75 17.82±17.50 483.80±110.08 0.41±0.60 457.07±371.11 2.09±2.85 3.08±4.18 8.54±9.30 40 10 t/χ2值5.375 1.352 0.151-4.146-1.734-2.852-4.570 1.409 0.529 0.142 3.557 P 值<0.001 0.179 0.881<0.001 0.086 0.006<0.001 0.162 0.598 0.706 0.059

表3 AAAD 术后行CRRT 危险因素的logistic 回归分析Tab.3 Logistic regression analysis of CRRT risk factors after AAAD surgery
2.4 AAAD 患者术后CRRT 危险因素预测效能分析 经过ROC 曲线(图1)分析得出,术前肌酐水平在预测急性Stanford A 型主动脉夹层术后感染的效能最高。见表4。

图1 独立危险因素预测术后行CRRT 的ROC 曲线Fig.1 ROC curve of CRRT independent risk factor

表4 CRRT 独立危险因素ROC 曲线下面积Tab.4 Area under ROC curve of CRRT independent risk factor
3 讨论
AAAD 是一种起病凶险、病情发展迅速、死亡率极高的一种疾病。有研究[4]显示AAAD 手术治疗病死率低于保守治疗。其中术后急性肾损伤是导致患者住院时间延长及预后的重要原因之一。本研究筛选了可能导致术后急性肾损伤的各种因素,回顾性分析本单位115 个AAAD 患者的病例,通过单因素分析及logistic 回归分析的统计学方法,探究AAAD 术后行CRRT 的相关因素、独立危险因素及术后CRRT 危险因素预测效能,结果显示术前肌酐、阻断时间、手术时间、术中输红细胞量为AAAD 术后感染的独立危险因素,术前肌酐水平在预测急性Stanford A 型主动脉夹层术后感染的效能最高。针对术后行CRRT 的独立危险因素进行有效评估及制定对应措施,可降低AAAD 术后行CRRT 的风险。
急性肾损伤(AKI)的病因主要包括肾性和肾前性因素,其中血流动力学、炎性反应和肾脏毒性等因素发挥重要的作用,多种因素相互交织,导致肾脏病理生理改变,从而促成AKI 的发生[5]。有研究指出主动脉夹层开放术后AKI 发生率差异较大[6-8],手术类型和AKI 诊断标准的不同会影响AKI发生率的统计。目前常用的AKI诊断标准有RIFLE标准[9]、AKIN 标准、KIDGO 标准[10]。
体外循环时血流特点是低流量、低血压、低温、非搏动灌注状态。有研究[11]证实体外循环是术后并发AKI 的高危因素,可能是由于长时间的阻断,肾脏无法获得稳定的灌注压力,肾脏出现缺血,进而使邻近肾小管坏死加重了炎性反应;同时由于患者血液与CPB 非生理性管路长时间接触,可激活补体系统,引起炎性因子释放,从而导致SIRS 的发生[12],各器官出现间质水肿,从而引发AKI;另外当主动脉夹层累及肾动脉时,手术消灭主动脉弓及以上夹层的假腔后,肾血流灌注会得到有效改善的同时,肾脏重新恢复供血后将出现缺血/再灌注损伤,从而使血肌酐明显上升[13-14]。其机制是缺血/再灌注损伤激活TNF 转录因子,其可上调NF-κB,后者继续上调TNF 和其他炎症因子的表达,形成正反馈的炎症级联反应,导致血肌酐上升和肾小球滤过率降低。本研究中CRRT组中要明显高于非CRRT组。肾脏功能在经历长时间体外循环的低流量、低温打击之后,缺血再灌注损伤及炎症因子的释放可造成血肌酐进行性升高[15]。
本研究证实术前血肌酐异常是AAAD 术后行CRRT 的独立危险因素,其预测AAAD 患者术后行CRRT 的效能最高。有研究[16-17]指出,术前即存在肾功能损伤的患者中术后肾功能进一步恶化及需要CRRT 的患者对比术前肾功能正常者比例较高,这和本研究得出的结果是一致的。
本研究结果显示术中红细胞输注量是术后行CRRT 的独立危险因素之一。原因可能是由于红细胞在血库保存过程中会发生不可逆的形态学和生理学改变,输入后导致炎症反应和机体氧化应激反应的发生[18]。有研究[19-20]显示红细胞的大量输入可使T 细胞激活,引起对应的免疫反应。同样红细胞的双凹圆饼状的特殊结构,当红细胞进入各组织的微循环时会自动改变形态,其与血浆与外界接触面积最大,其受损的程度较其他细胞更为严重。对于术前血色素正常的AAAD 患者,本中心尝试使用血液分离及回收装置,一方面可以回收红细胞,减少红细胞的输注量;另一方面其可以分离富含血小板血浆,这可以有利于止血,缩短体外循环时间及手术时间,减少红细胞的破坏。从而降低AAAD 术后行CRRT 的风险。
本研究也存在一些局限性,本研究为本中心的单中心病例回顾研究,病例数有限,需更多样本予以证实。同时本研究提示应重视围手术期的评估与干预,通过采取有效的措施,从而降低AAAD 患者术后行CRRT 的风险。下一步将联合多中心开展相关研究,同时注重术后的中远期随访,探究AAAD 患者术后的中远期生存情况。
AAAD 术后急性肾损伤严重影响了患者的预后,而术前肌酐、阻断时间、手术时间、术中输红细胞量是术后行CRRT 发生的独立危险因素,围绕这些独立的危险因素,术前有效的评估与干预,可降低AAAD 患者术后行CRRT 治疗的风险。
