猪链球菌LPxTG蛋白HP0197与外源蛋白的融合表达及融合蛋白抗原活性的检测
2022-07-11朱金鲁高广娟刘思国张跃灵
朱金鲁,卫 东,高广娟,陈 平,刘思国,张跃灵
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究创新团队,黑龙江 哈尔滨 150069)
细菌表面展示技术是将外源蛋白或多肽展示与细菌的表面,其原理是将待展示的外源蛋白(乘客蛋白)融合到某种具有转运信号和表面锚定基序的载体蛋白上,借助载体蛋白的转运信号和表面锚定基序,将乘客蛋白转运和锚定到细胞壁并展示于细菌的表面[1-2]。为了将乘客蛋白锚定到细胞壁并展示于细菌表面发挥功能,需要充分考虑载体蛋白的结构,选择合适的融合位点,以确保载体蛋白和乘客蛋白均能正常发挥功能,而对于多联疫苗而言,确保载体蛋白和乘客蛋白各自的抗原活性十分重要。
革兰氏阳性菌中研究较多的载体蛋白是LPxTG(Leu-Pro-x-Thr-Gly,x 表示任何氨基酸)蛋白,该类蛋白N 端有信号肽,C 端有典型的LPxTG 细胞壁锚定基序(Cell wall anchor motif,CWA),由LPxTG 保守基序、疏水结构域和带正电荷的尾部组成[3]。研究表明,将乘客蛋白与乳酸菌LPxTG 蛋白的N 端信号肽和C 端CWA 基序融合,并保留适当长度的铰链序列,能够实现外源蛋白在乳酸菌表面的展示[4-5]。
猪链球菌(Streptococcus suis)为革兰氏阳性菌,是一种重要的猪病病原[6-7],常与猪瘟病毒、猪圆环病毒、猪繁殖与呼吸综合征病毒等混合感染或者继发感染。因此,利用细菌表面展示技术将外源抗原展示在S.suis表面,对开发猪病多联疫苗意义重大。本实验室前期利用S. suis的10 种LPxTG 蛋白的信号肽和CWA 基序,融合GFP,首次构建了S. suis蛋白的表面展示系统,并通过western blot 检测到了用于表面锚定的成熟GFP[8]。但是,由于铰链序列较短(10个氨基酸),GFP 难以展示在菌体表面。基于此,本研究通过分析S. suis的LPxTG 蛋白序列,选定其HP0197 蛋白,将GFP 融合至HP0197 蛋白的18 ku 结构域和Loop区之间,延长了乘客蛋白与信号肽和CWA基序之间的铰链序列,通过体外表达和纯化融合蛋白并免疫小鼠,检测其抗原活性,在蛋白水平上评价HP0197 蛋白作为载体蛋白用于在S.suis表面展示外源抗原的可行性,为进一步构建S.suis表面蛋白展示系统奠定基础。
1 材料与方法
1.1 主要实验材料S. suis05ZYH33 菌株,于2005年从四川分离[9],由中国农业科学院哈尔滨兽医研究所蔡雪辉研究员惠赠;大肠杆菌DH5α 和BL21(DE3)感受态细胞、细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;表达载体pET-28a 由本实验室保存;质粒pUC57-gfp由六合华大基因科技(北京)有限公司合成;GFP 蛋白由本实验室纯化和保存;5 周龄BABL/c 雌性小鼠购自维通利华实验动物技术(北京)有限公司;限制性内切酶购自Thermo Scientific 公司;质粒DNA 提取试剂盒和胶回收试剂盒购自BioFluX 公司;重组酶连接克隆试剂盒(SoSoo Cloning Kit)购自擎科生物科技(北京)有限公司;LB培养基购自美国BD 公司;卡那霉素、IPTG 购自美国Amresco 公司;SDS-PAGE 蛋白胶购自金斯瑞生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma 公司;小鼠阴性血清采自BABL/c 雌性小鼠;HRP 标记的山羊抗小鼠IgG(IgG-HRP)购自中杉金桥生物技术有限公司。
1.2 HP0197 蛋白氨基酸序列分析及相应基因的引物设计采用NCBI Conserved Domain Search 软件,并参考文献[10],分析SS 05ZYH33 菌株HP0197 蛋白(SSU05_0196)的氨基酸序列,并分别利用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)与TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)软件分析HP0197 的转运信号肽和CWA 基序。针对HP0197 相应结构域,根据HP0197 蛋白的编码基因序列采用Premier 软件设计相应引物(表1),由北京擎科生物科技有限公司合成。

表1 本实验所用引物信息Table 1 Primers used in this study
1.3hp0197基因片段的PCR 扩增以提取的05ZYH33 菌株基因组DNA 为模板,以28a-0197F/28a-0197R引物经PCR扩增HP0197蛋白的功能区编码基因片段(去除了HP1097 全长蛋白aa1~aa40 的转运信号肽序列和aa524~aa56 的CWA 基序),PCR 产物命名为hp0197(其5'末端和3'末端分别引入了19 bp和17 bp与线性化pET28a 载体两端相同的序列,用于同源重组)。
1.4hp0197::gfp重组基因片段的构建 以05ZYH33菌株的基因组DNA 为模板,分别以28a-0197F/18ku-R引物经PCR 扩增hp0197-18ku 基因片段(HP0197 蛋白aa41~aa200 编码的基因片段,即HP0197 蛋白的18 ku结构域,3'末端引入氨基酸序列GSAGSAAGSGEA,用于分隔相邻的18 ku 结构域和GFP),以Loop-F/28a-0197R 引物经PCR 扩增hp0197-Loop 基因片段(HP0197 蛋白aa201~aa523 编码的基因片段,即除了18 ku 之外的HP0197 蛋白结构域)。以质粒pUC57-gfp为模板,以GFP-F/GFP-R 引物PCR 扩增gfp基因片段。以hp0197-18ku、gfp和hp0197-Loop 混合片段作为模板,以28a-0197F/28a-0197R 引物经重叠延伸PCR 扩增上述3 基因片段的融合片段,命名为hp0197::gfp融合基因片段(5'末端和3'末端分别引入了19 bp 和17 bp 与线性化pET28a 载体两端相同的序列,用于同源重组)。
1.5hp0197和hp0197::gfp基因重组表达质粒的构建 将1.3 制备的hp0197基因片段和1.4 制备的hp0197::gfp融合基因片段分别与经NdeI 和XhoI 双酶切后的pET-28a 载体同源重组,构建的重组质粒以28a-cfmF/28a-cfmR 引物经PCR 鉴定,阳性重组质粒由吉林库美生物科技有限公司测序鉴定。测序正确的hp0197和hp0197::gfp基因表达质粒分别名为pET28a-hp0197和pET28a-hp::gfp。
1.6 HP0197 蛋白和HP-GFP 融合蛋白的表达和纯化将pET28a-hp0197和pET28a-hp::gfp质粒分别转化大肠杆菌BL21(DE3),于37 ℃180 r/min 培养至OD600nm=0.6~0.8 后分别加入终浓度为0.8 mmol/L 的IPTG,16 ℃160 r/min 过夜诱导蛋白表达,4 000 r/min离心10 min 后,重悬于结合缓冲液(20 mmol/L Tris-HCl,pH7.9;150 mmol/L NaCl;20 mmol/L 咪唑)中。在冰浴条件下超声破碎后,8 000 r/min 离心15 min,将全蛋白和离心后获得的上清分别经SDS-PAGE 鉴定。上清采用Ni-NTA 亲和树脂纯化,采用不同浓度的咪唑洗涤后,250 mmol/L 咪唑洗脱。洗脱液采用超滤柱(30 ku-cut off,Millipore)浓缩后,采用SDS-PAGE 检测纯化效果。并利用微量分光光度计检测两种重组蛋白的浓度。
1.7 HP0197 蛋白和HP-GFP 融合蛋白免疫小鼠及抗原活性的检测 将纯化获得的HP0197 蛋白和HPGFP 融合蛋白,稀释到0.8 mg/mL,分别与佐剂1:1(v/v)乳化后采用皮下注射途径免疫小鼠。将12 只5周龄BALB/c 雌性小鼠随机分为3 组:(1)PBS 组,2只小鼠,免疫剂量为0.2 mL/只;(2)HP0197 组,5 只小鼠,免疫剂量为0.2 mL/只(含80 μg/0.1 mL HP0197蛋白);(3)HP-GFP 组,5 只小鼠,免疫剂量为0.2 mL/只(含80 μg/0.1 mL HP-GFP 融合蛋白)。初次免疫使用弗氏完全佐剂, 14 d 后2 次免疫,使用弗氏不完全佐剂,免疫途径为背部皮下多点注射。分别于首免后7 d、14 d、21 d、28 d,通过尾静脉采血并分离血清。分别以纯化的HP0197 蛋白和GFP 作为包被抗原,包被浓度为10 μg/mL,分别以2 倍倍比稀释(1:200~1:409 600)的各组小鼠血清作为一抗,山羊抗小鼠IgG-HRP(1:5 000)作为二抗,经间接ELISA 分别检测血清中HP0197 和GFP 的抗体水平,待测样品OD450nm值与阴性样品OD45nm值的比值大于2,判为阳性,计算每组的平均值作为最终结果。
2 结 果
2.1 HP0197 蛋白的氨基酸序列分析 采用NCBI Conserved Domain Search 软件,并结合袁增智等的研究[10],分析HP0197 蛋白氨基酸序列。结果显示,HP0197 蛋白长度为561 个氨基酸,包含5 个结构域,分别为N 端18 ku 结构域(aa55~aa200)、C 端G5 结构域(aa418~aa472)、连接18 ku 和G5 结构域的Loop 区(aa201~aa417),以及N 端信号肽和C 端CWA 基序(图1)。根据不破坏HP0197 蛋白的功能结构域,又在外源GFP 蛋白与HP0197 蛋白的转运信号肽和CWA基序之间保留足够长铰链序列的原则,选定18 ku 结构域和Loop 区结构域之间,作为外源蛋白GFP 的融合位点。
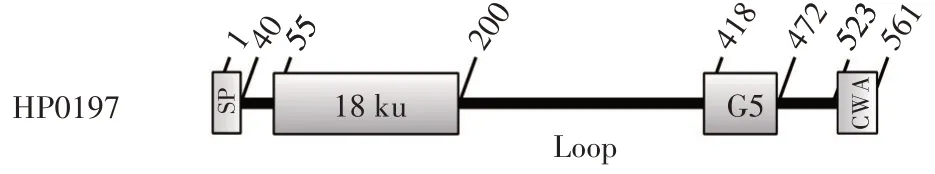
图1 HP0197蛋白的结构域示意图Fig.1 Schematic diagram of the domain of HP0197 pre-protein
2.2hp0197和hp0197::gfp基因片段的PCR 扩增以05ZYH33 基因组为模板,采用28a-0197F/28a-0197R 引物PCR 扩增hp0197基因片段。结果显示,获得了约为1 500 bp 的hp0197基因片段,与预期一致(图2A),hp0197基因片段编码的HP0197 蛋白功能区结构域如图2B 所示。分别以05ZYH33 基因组和质粒pUC57-gfp为模板,采用PCR 方法分别扩增了hp0197-18ku(531 bp)、gfp(764 bp)、hp0197-Loop(1 006 bp)基因片段,与预期大小一致(图3A)。采用重叠延伸PCR 方法扩增获得了上述3 基因片段的融合基因片段hp0197::gfp(2 199 bp),与预期大小一致(图3A)。hp0197::gfp融合基因片段编码的HP-GFP融合蛋白结构域如图3B 所示。

图2 hp0197基因片段的扩增(A)及HP0197蛋白功能区的结构域示意图(B)Fig.2 Amplification of hp0197 gene fragment(A)and diagram of functional domain of HP0197 protein(B)

图3 各基因片段的扩增(A)以及HP-GFP融合蛋白结构域示意图(B)Fig.3 Amplification and fusion of gene fragments(A)and schematic diagram of the HP-GFP protein domain(B)
2.3hp0197和hp0197::gfp基因重组表达质粒的构建 将hp0107和hp0197::gfp基因片段分别克隆至pET-28a 载体,构建的重组质粒以28a-cfmF/28a-cfmR为引物分别经PCR 鉴定并测序。结果显示,分别获得了与预期大小一致的基因片段(图4)。测序后证实,序列均正确,表明正确构建了HP0197 和HP-GFP 融合蛋白的表达载体pET28a-hp0197和pET28a-hp::gfp。

图4 重组质粒的PCR鉴定结果Fig.4 Identification of recombinant plasmids by PCR
2.4 HP0197 蛋白和HP-GFP 融合蛋白表达和纯化的鉴定 将重组质粒pET28a-hp0197和pET28a-hp::gfp转化大肠杆菌BL21(DE3),IPTG 诱导后经SDSPAGE 检测,结果显示,分别获得了大小为56.6 ku的HP0197 蛋白和86.1 ku 的HP-GFP 融合蛋白,且目的蛋白均存在于上清中(图5),表明HP0197 蛋白和HP-GFP 融合蛋白均获得了表达且均为可溶性蛋白。通过Ni2+亲和层析纯化后经SDS-PAGE 检测,结果显示,分别在56.6 ku 和86.1 ku 处出现了单一目的条带(图5)。表明HP0197 蛋白和HP-GFP 融合蛋白的纯化效果均较好。利用微量分光光度计测得HP0197 和HP-GFP纯化蛋白的浓度分别为3.0 mg/mL、1.9 mg/mL。

图5 HP0197蛋白(A)及HP-GFP融合蛋白(B)的表达及纯化的SDS-PAGE检测结果Fig.5 Detection of expression and purification of HP0197 protein(A)and HP-GFP fusion protein(B)by SDS-PAGE
2.5 免疫小鼠血清抗体的检测结果 通过间接ELISA 方法分别检测免疫后7 d、14 d、21 d、28 d 小鼠血清中HP0197 和GFP 的抗体水平。结果显示,在单独免疫HP0197 蛋白后7 d、14 d 的小鼠血清中检测到了效价分别为1:25 600 和1:51 200 的HP0197 抗体,未检测到GFP 抗体,而免疫融合蛋白HP-GFP后7 d、14 d 的小鼠血清中,既能检测到HP0197 抗体,也能检测到GFP 抗体,且7 d、14 d 二者的效价均分别达到了1:25 600 和1:51 200,而对照组小鼠血清均未检测到任何抗体(图6A、6B)。通过二次免疫(首免后21 d、28 d)进一步证实了免疫HP0197 的小鼠血清中只能检测到HP0197 抗体,而免疫HPGFP 的小鼠血清中能够同时检测到HP0197 和GFP 的抗体,并且首免后21 d、28 d 的二者的效价均分别达到了1:102 400 和1:204 800(图6C、图6D)。上述结果表明,HP-GFP 融合蛋白在保留了HP0197 抗原活性的前提下,还有效发挥了外源蛋白GFP 的抗原活性。

图6 小鼠血清中HP0197和GFP抗体水平的检测结果Fig.6 Detection of anti-HP0197 and anti-GFP antibody levels in mouse serum
3 讨 论
研究结果显示,在S. suis中类似于HP0197 蛋白具有转运信号和细胞壁锚定基序的LPxTG 蛋白数量较多,可达二三十种,它们的功能各不相同,分子量大小也不一,但均可通过转运信号和细胞壁锚定基序将其转运并锚定到细胞壁[8]。这为筛选用于S.suis表面展示外源蛋白的载体蛋白提供了广泛的选择。
本研究中选择S. suis05ZYH33 株的LPxTG 蛋白HP0197 作为载体蛋白,原因主要有以下3 个方面:(1)HP0197 的结构和功能研究得比较清楚[10];(2)HP0197 已被证实为一种有效的S. suis保护性抗原[11];(3)HP0197蛋白在S.suisLPxTG蛋白中的分子量较小(61.3 ku)[8],在插入外源蛋白后不至于过大而难以表达和转运加工。根据报道,HP0197 的5 个结构域中,其N端富含α-螺旋的18 ku结构域(aa55~aa200)是HP0197 蛋白的功能结构域,并可以结合宿主细胞。HP0197 C 端的G5 结构域(aa418~aa472)存在于多种酶中,包括链球菌IgA 肽酶[12]和各种细菌糖基水解酶[13]。18 ku 结构域和G5 结构域之间为富含脯氨酸的Loop区(aa201~aa417),无结合宿主细胞的位点。因此,为了避免影响HP0197 蛋白的功能和抗原活性,选择HP0197 的18 ku 结构域和Loop 区的连接处作为外源GFP 蛋白的融合位点。本研究利用PCR 分别扩增了hp0197、hp0197-18ku 和hp0197-Loop 基因片段,并通过融合PCR 将gfp基因融合至HP0197 蛋白的18 ku结构域和Loop 区编码基因之间,构建了融合基因hp0197::gfp。通过原核表达系统分别表达并纯化了HP0197 蛋白和HP-GFP 融合蛋白,通过小鼠免疫试验证实HP0197 蛋白的单抗原活性和HP-GFP 融合蛋白的双抗原活性。表明在HP0197 蛋白的18 ku 结构域和Loop 区之间插入外源蛋白,并不影响HP0197 蛋白本身以及外源蛋白的抗原活性。此外,选择GFP为外源报告蛋白,一方面是GFP 自带荧光,便于后期荧光显微镜观察融合蛋白的表达情况;另一方面GFP抗体已经商品化,构建S. suis蛋白表面展示系统后,可以利用超高分辨荧光显微观察和western blot 定性、定量检测S.suis表面展示的蛋白,便于后期评价蛋白表面展示的效果。
综上,本研究以GFP 蛋白为外源报告蛋白,以S.suis05ZYH33 菌株的LPxTG 蛋白HP0197 的18 ku 结构域和Loop 区之间作为外源蛋白插入位点,并表达纯化获得了HP0197 蛋白与GFP 的融合蛋白HP-GFP,通过小鼠免疫试验证实HP-GFP 融合蛋白具有很强的HP0197 和GFP 双抗原活性,在蛋白水平上证实了将HP0197 蛋白作为载体蛋白用于在S. suis表面展示外源抗原的可行性,为进一步构建S.suis表面蛋白展示系统奠定了实验基础。
