双重特异性磷酸酶15 基因对吗啡敏化的调控作用
2022-07-11朱永生
张 茜,王 翌,明 智,朱永生,党 伟
(1. 宁夏医科大学基础医学院生物化学与分子生物学系,宁夏银川 750001;2. 西安市精神卫生中心,陕西西安 710100;3. 西安交通大学医学部法医学院,陕西西安 710061)
毒品成瘾是一种慢性复发性脑疾病,主要表现为不顾恶性后果的强迫性药物使用,反复的戒断和复吸。伏隔核(nucleus accumbens, NAc)是毒品奖赏强化与戒断引起负性情感的关键核团,参与成瘾行为调控与学习记忆的功能调节,是目前临床治疗毒品成瘾的靶向脑区[1]。丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPK)家族主要包括3 个亚型:细胞外信号调节激酶(extracellular-regulated protein kinase, ERK)、c-Jun 氨基末端激酶和 p38 激酶。ERK 在大脑中广泛表达,尤其在中脑边缘系统中含量最为丰富,参与了药物敏化、奖赏、相关记忆的巩固、再巩固及戒断后药物寻觅[2]。目前有关ERK 活化(磷酸化)的机制已进行了较全面的研究,然而有关ERK 失活(去磷酸化)的机制鲜有报道。
MAPK 失活最有效的机制是由一个或两个苏氨酸/酪氨酸残基快速直接去磷酸化完成。介导MAPK 去磷酸化的主要酶为双重特异性磷酸酶(dual-specificity phosphatases,DUSPs)超家族。DUSP包括一个蛋白酪氨酸磷酸化酶的亚组即MKP,它可以使MAPK 苏氨酸/酪氨酸残基特异性去磷酸化[3]。除了脱磷酸的作用,DUSP 还可以用来锚定或者运输MAPKs 并且控制他们的亚细胞定位[4],可作为人类疾病治疗的潜在分子靶点[5]。最新研究提示,DUSP15 负性调控了吗啡成瘾记忆形成及消退[6]。本文旨在研究DUSP15 对小鼠吗啡敏化的影响。
1 材料与方法
1.1 实验动物
本研究所有实验均采用C57BL/6J 雄性小鼠,8 周龄,体质量18~25 g,饲养于恒温(24±2)℃、恒湿(50%~60%)及12 h/12 h(光照时间:7∶00~19∶00)恒定昼夜节律的SPF 级动物房。所有动物实验均遵照宁夏医科大学实验动物委员会实验动物管理和使用条例执行。
1.2 药品、抗体及病毒载体
盐酸吗啡购自中国食品药品检定研究院(1 mg/mL)。DUSP15 过表达病毒载体(pAAV-CAG-eGFP-2ADUSP15-3FLAG,滴度:3.12×1012vg/mL)及对照病毒(pAAV-CAG-eGFP-2A-MCS-3FLAG,滴度:8.87×1012vg/mL)由和元生物技术有限公司构建合成。兔抗NeuN(货号:ab177487)及羊抗兔IgG H&L(Alexa Fluor 594;货号:ab150080)购自英国 Abcam,DAPI 购自北京索莱宝科技有限公司(货号:C0065)。抗体名称、货号、稀释比例、分子量大小及生产厂家具体信息见表1。
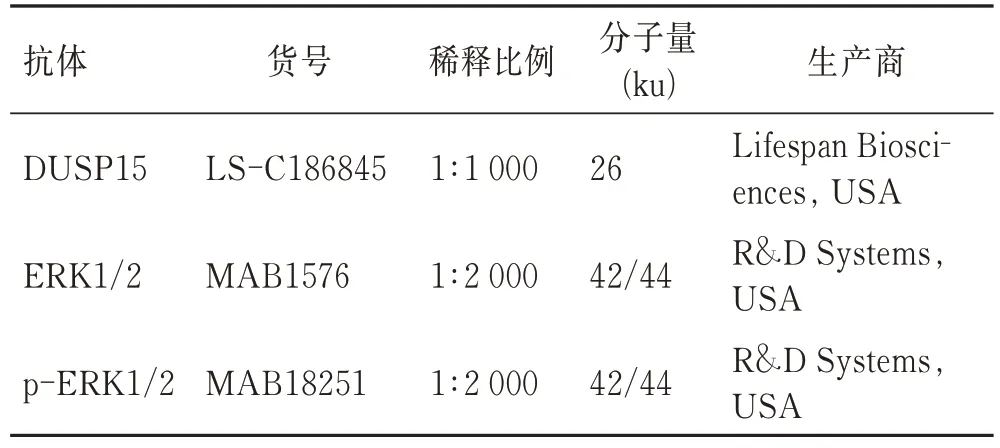
表1 抗体信息Tab. 1 Antibody and virus vector information
1.3 行为学实验
将小鼠随机分为2 组,分别为吗啡组及生理盐水组,每组10 只。敏化行为过程包括形成期(第1 天-第7 天),转化期(第8 天-第14 天)和表达期(第15 天)三个阶段。敏化形成期间吗啡采用腹腔注射,早晨9∶00 注射生理盐水,下午 5∶00 注射吗啡(10 mg/kg),连续7 d。转化期,停止生理盐水及吗啡注射,连续7 d。表达期,第15 天通过向小鼠腹腔注射1 针吗啡(10 mg/kg),通过旷场实验(open field test, OFT)评估敏化效应。
1.4 Western blotting 蛋白定量分析
将小鼠颈椎脱位处死后,分离NAc。提取总蛋白并进行定量,用120 g/L 聚丙烯酰胺凝胶电泳分离总蛋白。经过转印、脱脂牛奶封闭后,加入一抗,置于摇床,4 ℃孵育过夜。第2 天洗膜后加入二抗(稀释比为1∶1 000),室温下置于摇床,孵育70 min。洗膜后用BIO-RAD molecular imager 凝胶成像系统进行蛋白条带图像采集,Image Lab 软件进行蛋白条带数据分析。
1.5 脑立体定位注射实验
30~50 mL/L异氟烷诱导麻醉小鼠,参照G.Paxinos小鼠脑立体定位图谱,定位NAc 坐标(AP,+1.4 mm;ML,±2.0 mm;DV,-4.6 mm;10° angle)。根据该坐标,微量注射器以10°夹角进行NAc 脑区立体定位注射。两侧NAc 核团均注射pAAV-CAG-eGFP-2A-DUSP15-3FLAG(AAV-DUSP15)及对照病毒pAAV-CAG-eGFP(AAV-对照),小鼠恢复 5 d,期间连续注射5 d 青霉素预防感染。
1.6 统计学分析
CPP 数据采用双因素(药物与时间)重复测量方差分析(two-way repeated measures of ANOVA)结合Turkey’s 多重检验进行比较。蛋白表达数据采用非配对t检验或双因素方差分析结合Turkey’s多重检验进行比较。所有计量资料采用mean±SEM 表示,P<0.05 设置为具有统计学差异阈值。
2 结 果
2.1 吗啡敏化小鼠模型的建立及DUSP15 蛋白表达
表达期吗啡组小鼠活动距离及总活动距离显著高于盐水组(P<0.000 1),表明小鼠慢性暴露吗啡7 d,经过7 d 停药可诱导吗啡敏化效应(图1A、1B、1C)。与盐水对照组相比,吗啡组小鼠NAc 中p-ERK 活化水平显著上调(P<0.000 1,图1D、1E),DUSP15 表达显著降低(P<0.001,图1D、1F)。
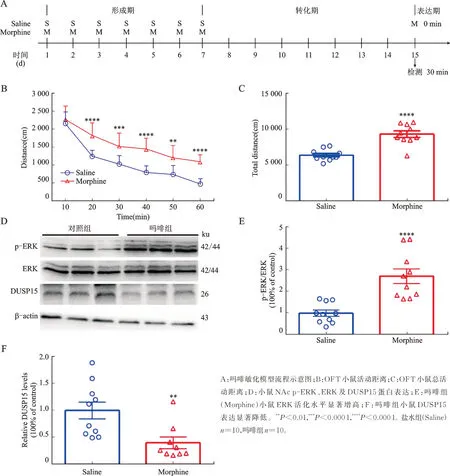
图1 吗啡小鼠敏化表达期OFT/ERK 磷酸化与DUSP15 表达Fig.1 Phosphorylation of OFT/ERK and expression of DUSP15 in morphine sensitized mice
2.2 过表达小鼠NAc DUSP15对吗啡敏化及p-ERK活化水平的影响
病毒注射及吗啡敏化表达检测实验流程如图2A所示,向小鼠 NAc 注射 AAV-DUSP15(图 2B),3 周后病毒显著表达(图2C)。
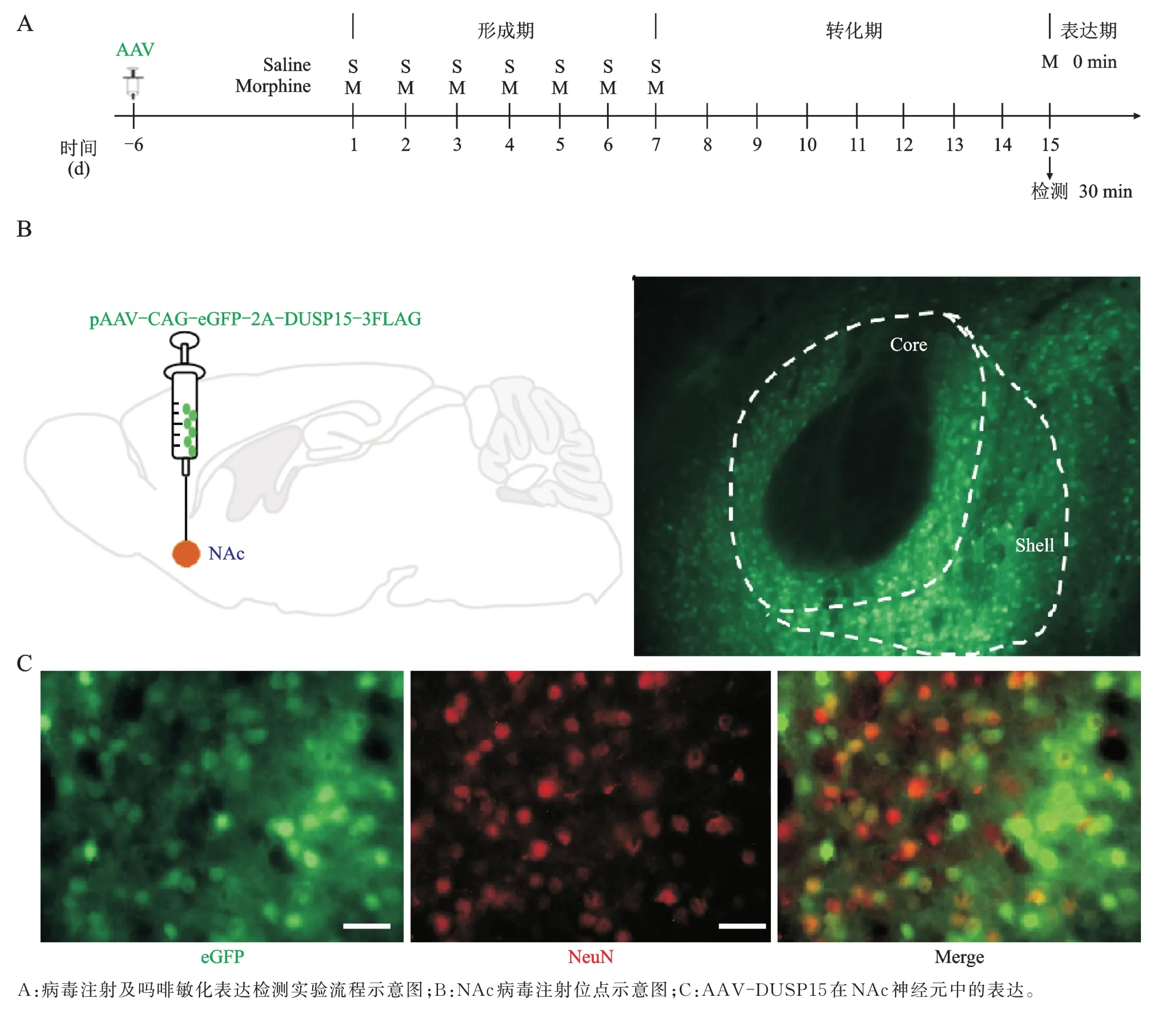
图2 小鼠NAc DUSP15 过表达病毒注射及病毒表达Fig.2 Mouse NAc DUSP15 overexpression virus injection and virus expression
向小鼠腹腔注射吗啡同时向小鼠NAc 注射AAV 对照病毒 pAAV-CAG-eGFP(吗啡-AAV-对照)或DUSP15 过表达病毒(吗啡-AAV-DUSP15),结果发现:与吗啡-AAV-对照组相比,吗啡-AAVDUSP15 组小鼠活动距离显著降低(P<0.05,图3A),总活动距离显著降低(P<0.001,图3B)。与吗啡-AAV-对照组相比,DUSP15 蛋白表达显著增高(P<0.01,图3C),p-ERK活化水平显著下调(P<0.01,图3D)。以上表明,小鼠NAc 过表达DUSP15 可以阻止吗啡敏化形成,且DUSP15 负性调控了p-ERK 的表达。
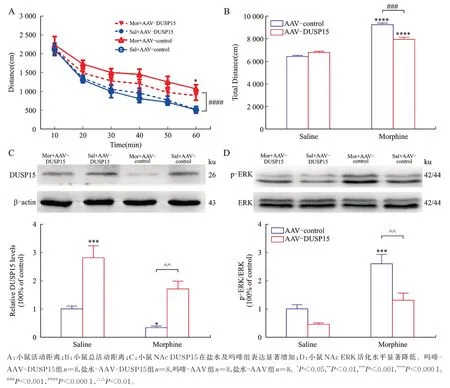
图3 过表达DUSP15 对敏化行为及p-ERK 的调控作用Fig.3 Regulatory effect of overexpressed DUSP15 on sensitization behavior and p-ERK
3 讨 论
本研究发现,小鼠腹腔连续注射10 mg/kg 吗啡,停药1 周可成功诱导小鼠吗啡敏化行为,NAc 中p-ERK 活化水平上调,且DUSP15 表达水平降低。过表达NAc 中DUSP15 可以阻止小鼠吗啡敏化形成,并降低p-ERK 的活化。表明NAc DUSP15 调控了吗啡敏化行为,其机制与负性调控p-ERK 相关。
NAc 整合前额叶皮质,海马及杏仁核的信息,从而调节个体药物渴求动机行为。NAc 包括“愉悦中枢”,是奖赏-强化系统的主要组成部分,在人类和动物的行为奖赏、强化及药物成瘾发生发展过程中起至关重要作用[7]。
由于MAPK 活化的时间和数量在细胞信号转导过程中起重要作用,因此MAPK 的激活和失活同样重要。除了脱磷酸的作用,DUSPs 还可以用来锚定或者运输MAPK 并且控制他们的亚细胞定位[4]。ERK 在大脑中广泛表达,尤其在中脑边缘系统中含量最为丰富,ERK 信号级联在奖赏系统过程中的重要作用在药物成瘾形成和发展中日益受到关注。采用条件性位置偏爱(conditioned place preference, CPP)模型研究发现,NAc 中ERK 介导了吗啡奖赏效应[8]。研究表明,小鼠腹腔连续5 d 注射可卡因,停药9 d 可诱导敏化行为,且与NAc 中p-ERK 表达上调密切相关[9]。按照剂量递增方式(0.1、0.5、1.0 mg/kg,i.p.),小鼠腹腔连续7 d 注射安非他命,停药7 d,0.1 mg/kg 与0.5 mg/kg 可诱导敏化行为,且与 NAc 中 ERK-ΔFosB信号通路上调密切相关[10]。这些发现进一步支持了本研究的结果。最近研究发现,小鼠NAc 中DUSP15 在吗啡CPP 形成及复燃中表达降低,过表达DUSP15 通过降低p-ERK 的表达阻止CPP 的形成及复燃,且促进了 CPP 消退[6]。本研究表明,NAc DUSP15 通过下调p-ERK 阻止吗啡诱导的敏化行为,得出的结论进一步拓展了DUSP15在吗啡奖赏中的作用机制。
大量研究表明,NAc中p-ERK 在毒品成瘾的发生发展中至关重要。ERK 有望成为治疗毒品成瘾的关键靶向分子[11]。因此,阻断ERK 活化可能是治疗毒品成瘾的一种新策略。本研究进一步完善了ERK 在毒品成瘾中的激活和失活机制。这不仅为阿片成瘾的预防和治疗提供新的思路,也为开发新的特异性药物提供新的药物作用靶点。
