酶解鱼溶浆和植物精油对大菱鲆幼鱼生长、肠道消化酶活力及TOR相关基因表达的影响
2022-07-11郝甜甜许聪王际英刘财礼沈玉博李宝山孙永智黄炳山
郝甜甜,许聪,2,王际英*,刘财礼,2,沈玉博,2,李宝山,孙永智,黄炳山
(1.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东省海水渔用饲料工程技术研究中心,山东 烟台 264006;2.上海海洋大学 水产科学国家级实验教学示范中心,农业农村部鱼类营养与环境生态研究中心,水产动物遗传育种中心上海市协同创新中心,上海 201306)
据统计,2020 年中国海水养殖产量达2 135.31 万t,已跃居世界首位[1]。鱼粉作为优质蛋白源是海水鱼配合饲料中的主要蛋白源,约占饲料成本的60%,而饲料成本占总养殖成本的60%~80%,较高的养殖成本是制约海水养殖业进一步发展的瓶颈[2]。近年来,随着鱼粉资源不断缩减且价格持续飙升,植物蛋白替代鱼粉研究逐渐引起关注,但是替代蛋白源的适口性、抗营养因子和氨基酸不平衡等问题却限制了其在水产饲料中的应用,利用植物性原料完全替代海水鱼饲料中的鱼粉仍是一个难题。本实验室前期研究表明,在鲆鲽鱼饲料中,当大豆浓缩蛋白替代鱼粉超过40%[3],酶解豆粕和棉籽粕替代鱼粉超过58.8%[4]时,均会显著降低幼鱼的生长性能和免疫能力。有研究表明,在高植物蛋白饲料中添加外源添加剂是提高植物蛋白源利用率的重要途径之一,且能实现节约鱼粉及充分发挥植物蛋白优势的目的[5-6]。因此,寻求在低鱼粉条件下提高海水鱼生长性能和免疫能力的外源添加剂,已成为近年来海水鱼营养研究的热点。
酶解鱼溶浆(stickwater hydrolysate,SWH)是采用酶解生产工艺,以鱼溶浆作为原料,加入一些酶类,在50~55 ℃酶解3~5 h后得到的产品[7]。罗其刚等[8]研究表明,在草鱼Ctenopharyngodonidellus饲料中添加鱼溶浆能达到节约鱼粉、增强鱼体脂肪能量代谢和促进鱼体生长的效果。周露阳等[7]研究表明,在黄颡鱼Pelteobagrusfulvidraco日粮中添加质量分数为8.5%的酶解鱼溶浆可完全替代28%的鱼粉,且酶解鱼溶浆的促生长效果优于鱼溶浆。植物精油(essential oil)是一类从植物中提取的含有挥发油类的物质,含有多种活性成分,具有杀菌抑菌、抗氧化、抗炎、抗癌和免疫刺激等功能,且在畜禽产品中无残留,是一种绿色、安全、环保的饲料添加剂[9]。王猛强等[10]在凡纳滨对虾Litopenaeusvannamei饲料不同鱼粉水平下添加不同水平的植物精油,结果发现,在降低鱼粉含量情况下,饲料中添加质量分数为0.02%的精油可提高幼虾生长性能和改善其肠道健康。蒋溥等[11]研究发现,在半滑舌鳎Cynoglossussemilaevis饲料中添加1 000 mg/kg的肉桂醛可显著增强鱼体的抗病能力并改善其肠道健康状况。
大菱鲆Scophthalmusmaximus隶属鲽形目Pleuronectiformes鲆科Scophthalmidae瘤棘鲆属Psetta,俗称多宝鱼,是中国鲆鲽鱼类养殖第一大品种,具有极高的经济价值[12]。大菱鲆饲料配方中鱼粉含量较多(高于40%)[13],而关于酶解鱼溶浆和植物精油在大菱鲆低鱼粉饲料中的应用研究尚未见报道。本试验中,以大菱鲆幼鱼为研究对象,以小麦粉、大豆浓缩蛋白等替代基础饲料(含50%鱼粉)中20%鱼粉,单独或联合添加酶解鱼溶浆和植物精油,以考察大菱鲆幼鱼生长性能、消化酶活力、血清生化指标及雷帕霉素靶蛋白(TOR)相关基因表达的变化,以期为酶解鱼溶浆和植物精油在大菱鲆饲料中的合理应用提供科学参考。
1 材料与方法
1.1 材料
试验鱼苗购自山东科合海洋高技术有限公司。养殖试验在山东省海洋资源与环境研究院全封闭水循环系统中进行。正式开始试验前将试验鱼放入蓝色圆柱形塑料养殖桶(直径为70 cm,高为80 cm,水深为50 cm)中暂养1 周。
酶解鱼溶浆购自荣成海圣饲料有限公司,其中脂肪酶、胰蛋白酶、风味酶三者的质量比为2∶2∶1,50 ℃下酶解3 h,获得酶解产物,营养成分见表1。包被精油由广州中牧农科技有限公司提供(肉桂醛含量≥15%)。

表1 酶解鱼溶浆营养成分Tab.1 Nutrient compositions of stickwater hydrolysate
1.2 方法
1.2.1 试验饲料的制作 以鱼粉和酪蛋白为主要蛋白源,鱼油和豆油为主要脂肪源。设计鱼粉含量为50%的饲料为正对照组(D0),鱼粉含量为30%的饲料为负对照组(D1,用大豆浓缩蛋白等蛋白替代鱼粉),在负对照组饲料中补充蛋氨酸和赖氨酸,使之达到与正对照组一致水平。在负对照组基础上添加含量为1%酶解鱼溶浆(D3)、0.02%包被精油(D4)、1%酶解鱼溶浆+0.02%精油(D5),共配制成5组试验饲料(本文中饲料成分含量%均指质量分数)。
将所有饲料原料粉碎后过198 μm孔径筛,按饲料配方混合均匀,加入鱼油及适量水再次混匀,经螺旋挤压机加工成粒径为3 mm的饲料颗粒,60 ℃下烘干后置于-20 ℃冰箱备用。饲料配方和营养成分组成见表2。
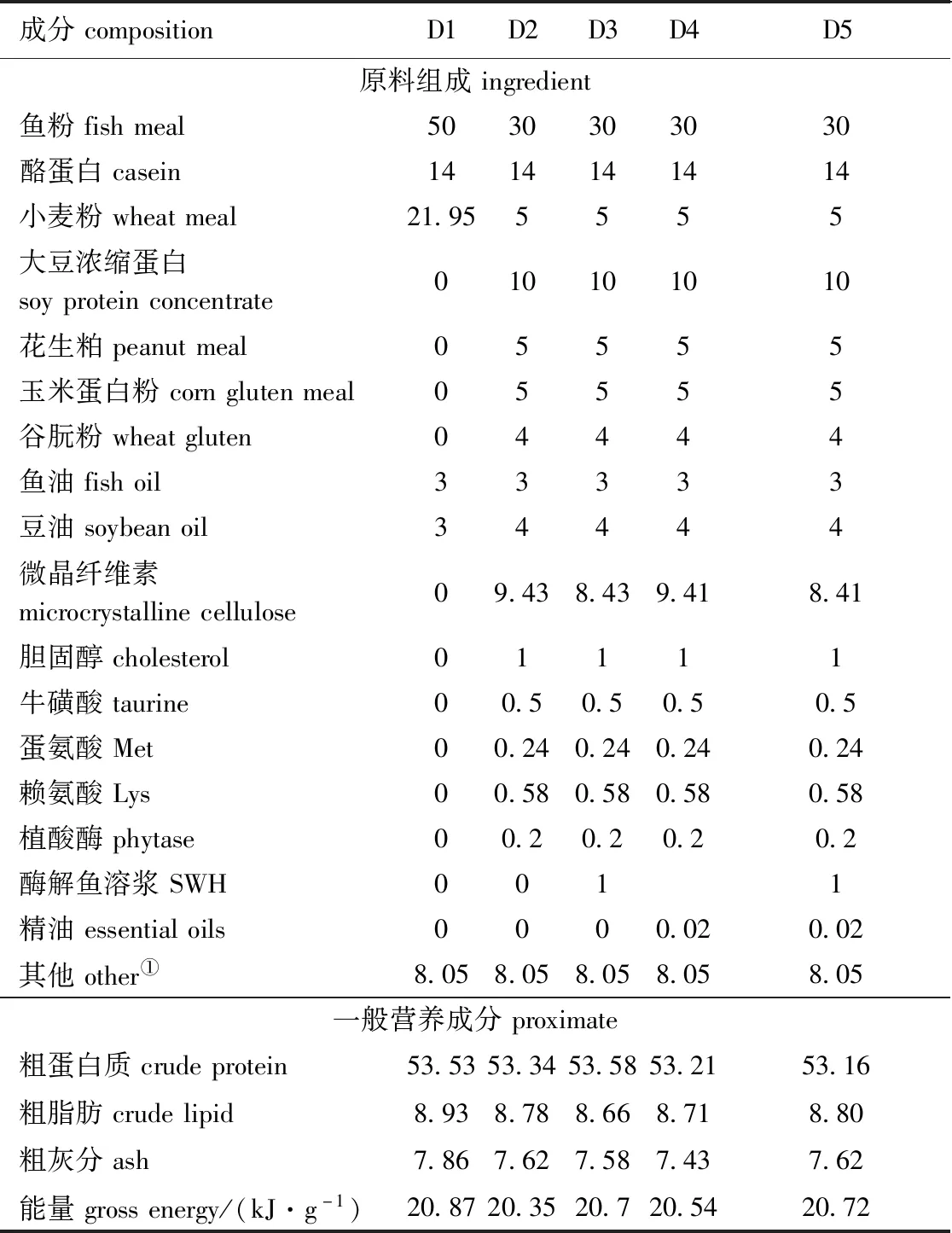
表2 饲料配方和营养成分组成(干质量)Tab.2 Ingredient and proximate nutrient composition of the test diets (dry weight basis)
1.2.2 试验设计及饲养管理 试验鱼暂养结束后,禁食24 h,挑选体格健壮、规格均一的大菱鲆幼鱼(体质量为37.67 g)随机分成5 组,每组设置3个平行,每个平行放30尾鱼,分别投喂5种试验饲料。养殖周期为8周,每天8:30、16:30投喂,投喂量为鱼体质量的1.2%~1.5%,投喂结束后统计残饵量。养殖期间如有死鱼记录数量并称重。整个试验期间,控制水温为(16±1)℃,盐度为27~28,溶解氧质量浓度>6 mg/L,氨氮质量浓度<0.01 mg/L。
1.2.3 样品采集 养殖试验结束,试验鱼禁食24 h后,采用丁香酚麻醉,以桶为单位称其质量,并分别计算成活率、增重率和饲料系数。从每桶随机选择12 尾幼鱼,分别测定其体质量、体长,计算肥满度。从尾静脉取血,血样在4 ℃下静置4 h,以4 000 r/min离心10 min,取血清,-80 ℃下保存待测;随后解剖内脏并分离肠道。另在无菌条件下,随机取3 尾试验鱼采血后取肝尖,将3 尾鱼肝尖合并放入无RNA酶管中,液氮速冻后转移至-80 ℃超低温冰箱中保存。
1.2.4 指标的测定与计算
1)生长指标。计算公式为
增重率=(Wt-W0)/W0×100%,
特定生长率=(lnWt-lnW0)/t×100%,
饲料系数=Wf/(Wt-W0),
肥满度=W/L3×100,
蛋白质效率=(Wt-W0)/(Wf×Cp),
成活率=Nt/N0×100%。
其中:W0为试验开始时鱼体质量(g);Wt为试验结束时鱼体质量(g);Wf为摄食量(g);Cp为饲料蛋白质量分数(%);W、L分别为鱼体质量(g)、体长(cm);Nt、N0分别为试验开始和结束时试验鱼存活数量(ind.);t为养殖时间(d)。
2)血清酶活性。采用南京建成生物工程研究所试剂盒测定血清中溶菌酶(lysozyme,LZM)活性;采用上海酶联生物公司ELISA试剂盒测定补体C3、C4含量。
3)肠道消化酶活性。采用南京建成生物工程研究所试剂盒分别测定肠道胰蛋白酶(trypsin)、淀粉酶(amylase)、脂肪酶(lipase)活性,具体操作严格按照各试剂盒说明书执行。采用考马斯亮蓝法测定酶液中蛋白质浓度。
4)肝脏TOR相关基因表达量。将-80 ℃下冻存的大菱鲆肝脏组织按照Trizol试剂盒(TaKaRa)说明书提取总RNA。参照唐卓懿等[14]设计的TOR、4EBP1、4EBP2基因引物(表3),同时以RPSD(DQ848899.1)为内参基因,由生工生物工程(上海)股份有限公司合成引物。采用荧光定量PCR方法检测,按照SYBR Premix ScriptTMRT PCR 试剂盒说明书将提取的总RNA先反转录为cDNA,再用SYBR GreenⅠ嵌合荧光进行real-time PCR反应。反应程序:95 ℃下预变性30 s;95 ℃下循环变性5 s;56 ℃下退火复性30 s,72 ℃下延伸1 min,共进行40 个循环。基于TOR、4EBP1、4EBP2及RPSD基因的Ct值,采用2-ΔΔCt法计算mRNA的表达量,以正对照组为基值计算相对表达量。

表3 试验中实时荧光定量PCR的引物序列Tab.3 Real-time PCR primers in the experiment
1.2.5 攻毒试验 参照郝甜甜等[15]的方法进行鳗弧菌Vibrioanguillarum培养及鱼体感染试验。生长试验结束后,从每桶随机取10 尾健康大菱鲆腹腔注射鳗弧菌液,注射剂量为7.94×105CFU/g组织,对照组注射等量生理盐水。注射48 h后统计鱼死亡数量,累积死亡率计算公式为
累积死亡率=病死鱼数量/初感染鱼数量×100%。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),若差异显著,则采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 各组大菱鲆幼鱼生长性能的变化
从表4可见:养殖8 周后,各组间大菱鲆幼鱼的成活率和肥满度无显著性差异(P>0.05);低鱼粉饲料中添加酶解鱼溶浆组(D3),以及酶解鱼溶浆和植物精油联合组(D5)幼鱼的增重率和特定生长率均显著高于正、负对照组(D1、D2)(P<0.05),且D3组显著高于D5组(P<0.05),添加植物精油组(D4)幼鱼增重率和特定生长率与正、负对照组无显著性差异(P>0.05);D3组蛋白质效率最高,且显著高于其他组(P<0.05);D3组饲料系数最低,且显著低于负对照组(P<0.05),与正对照组无显著性差异(P>0.05)。

表4 酶解鱼溶浆和植物精油对大菱鲆幼鱼生长性能的影响Tab.4 Effects of stickwater hydrolysate and plant essential oils on growth performance of juvenile turbot Scophthalmus maximus
2.2 各组大菱鲆幼鱼血清免疫指标的变化
从表5可见:幼鱼血清溶菌酶活力在负对照组最低,在D5组最高,其中D3、D4和D5组显著高于负对照组(P<0.05);C3酶活力在D5组最低,且显著低于其他组(P<0.05);各组间幼鱼血清C4酶活力无显著性差异(P>0.05)。

表5 酶解鱼溶浆和植物精油对幼鱼血清免疫指标的影响Tab.5 Effects of stickwater hydrolysate and plant essential oils on immunity of juvenile fish
2.3 各组大菱鲆幼鱼的抗鳗弧菌感染能力
试验鱼养殖8周后,进行鳗弧菌注射感染试验,感染48 h后,统计各组鱼的累积死亡率。从图1可见,D1~D5组鱼的累积死亡率分别为63.33%、80.00%、73.33%、53.33%、53.33%,其中,D4和D5组的累积死亡率显著低于负对照组(P<0.05),但与正对照组无显著性差异(P>0.05)。
2.4 各组大菱鲆幼鱼肠道消化酶活力的变化
从表6可见:D3组幼鱼肠道胰蛋白酶较负对照组、D4和D5组显著升高(P<0.05),但与正对照组无显著差异(P>0.05);各组间幼鱼肠道脂肪酶和淀粉酶活力均无显著性差异(P>0.05)。

表6 酶解鱼溶浆和植物精油对幼鱼肠道消化酶活力的影响Tab.6 Effects of stickwater hydrolysate and plant essential oils on digestive enzyme activity of juvenile fish
2.5 各组幼鱼肝脏TOR相关基因表达的变化
从图2可见:在低鱼粉饲料中添加酶解鱼溶浆和植物精油对大菱鲆幼鱼肝脏TOR、4EBP1和4EBP2 mRNA相对表达量均有显著性影响(P<0.05);TORmRNA相对表达量在D3组达到最高值,且显著高于其他各组(P<0.05);4EBP1和4EBP2 mRNA相对表达量均在D3组达到最低值,且显著低于其他各组(P<0.05)。

标有不同字母者表示同一指标下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。Means with different letters in the same index are significantly different in the different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.图1 酶解鱼溶浆和植物精油对弧菌感染后幼鱼累积死亡率的影响Fig.1 Effects of stickwater hydrolysate and plant essential oils on cumulative mortality of juvenile fish challenged with Vibrio anguillarum
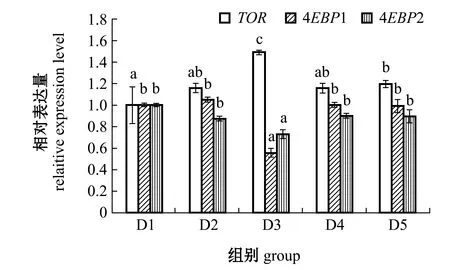
图2 肝脏中TOR、4EBP1和4EBP2 mRNA的表达量Fig.2 Relative expression level of TOR,4EBP1 and 4EBP2 mRNA in liver
3 讨论
3.1 酶解鱼溶浆和植物精油对幼鱼生长性能的影响
酶解鱼溶浆应用于水产饲料中,主要优势是能保持水解物的新鲜度和鱼体中特殊的有效成分[16]。本试验中,负对照组增重率与正对照组相比无显著性差异,这表明植物蛋白部分替代鱼粉对鱼体的生长性能无负面影响。而在低鱼粉饲料中单一添加酶解鱼溶浆则显著提高了大菱鲆幼鱼增重率,较正对照组提高了23.40%,较负对照组提高了20.93%,饲料系数较正、负对照组分别降低了5.68%、12.50%,主要原因是相比于鱼粉和植物蛋白,酶解鱼溶浆含有更多的可消化蛋白、小肽、氨基酸等活性成分,这类物质在低鱼粉饲料中对维持鱼体生理健康及促生长方面具有较大作用[17]。这与对大黄鱼Pseudosciaenacrocea[18]、大西洋鲑Salmosalar[19]等肉食性鱼类的研究结果一致。本试验中,低鱼粉饲料中单一添加植物精油组幼鱼增重率和特定生长率与正、负对照组无显著性差异,这与对罗非鱼Oreochromisniloticus[20]、银鲇Lippiaalba[21]的研究结果不一致。原因可能是:第一,饲料蛋白源的不同导致精油在动物体内的应用效果不同[22];第二,试验对象的不同,淡水鱼与海水鱼在食性及消化生理方面差异较大,导致精油在不同鱼体中的应用效果有一定差异[23]。此外,本试验中,在低鱼粉饲料中单一添加酶解鱼溶浆组幼鱼的增重率和特定生长率显著高于单一添加精油组和二者联合添加组,且联合添加组生长性能显著高于单一添加精油组,这说明酶解鱼溶浆和精油联合添加具有一定协调增效,但具体配伍、二者间的互作关系及其机理还有待进一步研究。
3.2 酶解鱼溶浆和植物精油对幼鱼免疫能力的影响
本试验中,负对照组显著降低了幼鱼血清溶菌酶和C3含量,表明用植物蛋白替代部分鱼粉虽然对幼鱼生长无显著性影响,但已影响了幼鱼的免疫能力,这与对凡纳滨对虾[24]的研究结果一致。Liang等[25]报道,在海鲈Lateolabraxjaponicus饲料中添加水解鱼蛋白能显著提高幼鱼补体活性和溶菌酶活性;唐宏刚[26]研究发现,在大黄鱼饲料中添加水解蛋白后显著提高了幼鱼溶菌酶活性及C3、C4水平,与本试验结果一致,说明在低鱼粉饲料中添加酶解鱼溶浆可显著提高大菱鲆幼鱼非特异性免疫能力,其作用机理可能与酶解产物中的生物活性肽有关[27]。本试验中,与负对照组相比,在低鱼粉饲料中添加植物精油显著提高了幼鱼溶菌酶活性,表明在大菱鲆饲料中补充植物精油可提高鱼体的免疫能力,这与对虹鳟Oncorhynchusmykiss[28]和红鼓鱼Ocimumamericanum[29]的研究结果一致。
3.3 酶解鱼溶浆和植物精油对幼鱼抗鳗弧菌感染能力的影响
Li等[30]研究表明,细菌感染鱼体后会抑制补体替代途径的活化,引起鱼体产生大量活性氧自由基,造成机体损伤;此外,攻毒试验还会造成动物肠道促炎性细胞因子大量分泌,既消耗大量能量,又会引起肠道损伤[31]。本试验结果表明,在大菱鲆幼鱼低鱼粉饲料中添加植物精油或酶解鱼溶浆与植物精油复配,均可提高鱼体抗鳗弧菌感染能力,降低累积死亡率。其作用机理可能如下:第一,植物精油特殊的化学结构易与细菌脂质膜发生接触从而穿透细菌的细胞膜,触发细胞内容物外溢,从而达到抗菌作用[32];第二,植物精油可降低促炎性细胞的分泌,抑制白细胞的募集,减轻炎症反应导致的氧化损伤[33]。
3.4 酶解鱼溶浆和植物精油对幼鱼消化能力的影响
Shi等[34]研究发现,在黄鳝Monopterusalbus配合饲料中添加质量分数为10%的酶解鱼溶浆替代鱼粉,可显著增加与黄鳝肠道消化相关的微生物数量,并显著提高鱼体消化酶活性,这与本试验中添加酶解鱼溶浆显著提高大菱鲆幼鱼肠道胰蛋白酶活性的结果一致。其作用机理可能是酶解鱼溶浆中富含小肽等物质,可促进肠道绒毛的生长并完善胰腺外分泌功能,从而提高肠道胰蛋白酶活性[35]。但本试验结果发现,饲料中添加酶解鱼溶浆并未显著提高鱼体肠道脂肪酶和淀粉酶活性。有研究表明,鱼类脂肪酶和淀粉酶活力与饲料中的脂肪和淀粉含量相关[36],这也可能是造成本试验中鱼体肠道脂肪酶和淀粉酶活性无显著性变化的原因之一。本试验中,与负对照组相比,饲料中添加植物精油显著提高了幼鱼胰蛋白酶活性,其机理可能是幼鱼摄食精油后可刺激胆汁、消化道酶液分泌,提高内源性消化酶活性,从而提高幼鱼对蛋白质的消化吸收能力[37]。有研究表明,动物消化道中微生物数量和代谢与消化酶活性具有一定关系[38]。本试验中,在饲料中添加植物精油并未显著影响幼鱼肠道脂肪酶与淀粉酶活性,可能是饲料中添加精油提高了幼鱼消化道中与蛋白质降解有关的细菌数量,同时又降低了与淀粉酶和脂肪酶降解相关的细菌数量,其具体指标分析与作用机理还有待进一步研究。此外,饲料中添加酶解鱼溶浆和精油复配产生的交互作用,降低了胰蛋白酶活性,这可能是酶解鱼溶浆的添加增强了精油的抗菌活性,影响了肠道菌群变化,从而影响了内源性消化酶的分泌量[39]。
3.5 酶解鱼溶浆和植物精油对幼鱼肝脏TOR相关基因表达的影响
TOR是高度保守的丝氨酸/苏氨酸激酶,TOR信号通路是生物体对营养环境改变做出有效应答的关键,也是调控生长的重要通路[15]。雷帕霉素靶蛋白复合物1(TORC1)是调控TOR信号通路下游真核启动因子4E结合蛋白(4EBPs)的关键蛋白,而4EBPs是一个小分子的转录抑制剂[40]。当TOR信号通路被激活,TORC1可磷酸化4EBPs的一些氨基酸位点,下调4EBPs基因表达水平,从而进一步影响下游通路和促进蛋白的合成[41]。本研究中发现,大菱鲆幼鱼肝脏中TOR、4EBP1和4EBP2 mRNA表达量随饲料的变化而变化,在负对照组幼鱼肝脏中TOR、4EBP1和4EBP2基因表达量与正对照组无显著性差异,这表明饲料中高植物蛋白替代鱼粉对幼鱼肝脏TOR信号通路并未产生显著影响,这与对虹鳟[42]的研究结果一致。本试验中,在植物蛋白替代鱼粉饲料中补充酶解鱼溶浆可显著上调肝脏TOR基因表达水平,下调4EBP1、4EBP2基因表达水平,表明饲料中添加酶解鱼溶浆激活了幼鱼肝脏TOR信号通路,其机理可能是酶解鱼溶浆中的一些活性物质可激活TOR信号通路[43],从而促进蛋白质转录,有利于幼鱼的生长,此结果与本试验中增重率结果也是一致的。目前,有关精油调控鱼类TOR和4EBPs基因表达量的研究尚未见报道。本研究中发现,与对照组相比,饲料中添加精油及精油与酶解鱼溶浆复配对大菱鲆幼鱼肝脏TOR、4EBP1和4EBP2的基因表达量无显著性影响。推测原因是精油作为植物提取物在不同动物体内代谢不同,其代谢产物不能激活TOR信号通路。
4 结论
1)在质量分数为30%的低鱼粉饲料中,添加1%的酶解鱼溶浆投喂大菱鲆幼鱼,可显著提高其生长性能、肠道胰蛋白酶活性和TOR基因表达量。
2)在质量分数为30%的低鱼粉饲料中,添加0.02%的植物精油投喂大菱鲆幼鱼,可提高幼鱼血清溶菌酶活性和抗鳗弧菌感染能力。
3)在质量分数为30%的低鱼粉饲料中,添加1%的酶解鱼溶浆和0.02%的植物精油二者配伍投喂大菱鲆幼鱼,对提高鱼体增重率的效果要低于单一添加1%的酶解鱼溶浆组,其相互作用机理还有待进一步研究。
