乌苏里白鲑肝脏表达抗菌肽Leap-2基因的克隆及细菌感染后的组织表达分析
2022-07-11刘恩慧黄天晴谷伟王炳谦张艳萍李春雨徐革锋
刘恩慧,黄天晴,谷伟,王炳谦,张艳萍,李春雨,徐革锋*
(1.中国水产科学研究院黑龙江水产研究所 农业农村部淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070;2.甘肃省水产研究所,甘肃 兰州 730030;3.新疆天蕴有机农业有限公司,新疆 伊犁 835708)
抗菌肽(antimicrobial peptides,AMP) 是宿主黏膜表面的一类重要防御因子,是机体自身免疫系统的重要组成部分。与传统的抗生素相比,抗菌肽表现出对更多病原体(病毒、真菌和寄生虫等) 的防御作用,具有无污染、无残留特性,且在细菌中不易产生耐药性[1-2]。近年来,随着中国水产业不断走向规模化和集约化,鱼类人工养殖过程中水质污染、病害暴发、品质降低等问题严重制约了行业的健康发展[3],另一方面,水产品中的药物积累也将威胁消费者的健康。抗菌肽作为水产动物自身免疫的关键组成部分,可保护鱼类免受微生物病原体的危害[4-5],将其作为抗生素的替代产品已成为行业研究的热点。
肝脏表达抗菌肽(liver-expressed antimicrobial peptide,Leap) 是一类富含半胱氨酸的抗菌肽,其在肝脏中大量转录表达。2003年,Krause等[6-7]首次从人类的血液中分离出两种亚型,即Leap-1和Leap-2,其分别包含8个和4个保守的半胱氨酸残基。目前,相较于Leap-1,Leap-2的相关研究较少。在水产动物中,Leap-2已经在草鱼Ctenopharyngodonidellus[8]、鲤Cyprinuscarpio[9]、褐鳟Salmotrutta[10]、虹鳟Oncorhynchusmykiss[11]、大黄鱼Larimichthyscrocea[12]和卵形鲳鲹Trachinotusovatus[13]等多个物种中被分离鉴定。抗菌肽Leap-2通过破坏细菌膜结构的完整性从而发挥抗菌活性[14],是免疫系统抵御微生物入侵的重要组成部分[15-16]。
乌苏里白鲑CoregonusussuriensisBerg 是一种具有较高营养价值和经济价值的冷水性鱼类,主要分布于中国黑龙江流域、俄罗斯的西伯利亚和萨哈林等水系[17-19]。近年来,由于过度捕捞和栖息地破坏,乌苏里白鲑的野生资源已严重衰退。1988年,该鱼被列入《中国濒危动物(鱼类)红皮书》名录,定为“易危”级物种[19]。人工繁殖过程中研究人员发现,乌苏里白鲑具有较强的病原抵抗能力,因此,针对该鱼的非特异性免疫反应展开进一步研究,鉴定相关免疫因子的抗菌活性,可为该物种大规模养殖中的疾病防治提供重要参考。本研究中,通过对乌苏里白鲑的肝脏表达抗菌肽Leap-2的克隆,探究了其在乌苏里白鲑不同组织中的表达差异,并检测了在嗜水气单胞菌、杀鲑气单胞菌和金黄色葡萄球菌感染后的Leap-2表达模式,以期为开发乌苏里白鲑抗菌肽奠定基础,并为了解乌苏里白鲑对病原体的免疫应答机制提供理论参考。
1 材料与方法
1.1 材料
试验用乌苏里白鲑幼鱼(体长为15.0 cm±1.5 cm、体质量为30.0 g± 1.2 g) 取自黑龙江水产研究所渤海冷水性鱼类试验站(牡丹江),带水充气运回实验室,饲养在循环控温水族箱(180 cm×60 cm×50 cm)中。试验期间,水温为(18.0±0.2)℃,溶解氧为(7.8~10.0)mg/L,pH为7.2~7.5。日投喂2次,投饵量为鱼体质量的2%,试验前24 h停止投喂。
1.2 方法
1.2.1 乌苏里白鲑Leap-2基因的克隆 基因克隆设计引物,参考虹鳟Oncorhynchusmykiss的Leap-2(GenBank:AY362187.1),采用Primer 5.0 软件设计特异性引物(表1)。使用1尾乌苏里白鲑的肝脏组织cDNA作为克隆模板,通过PCR扩增Leap-2基因。PCR反应程序:94 ℃ 下预变性2 min;94 ℃下循环变性30 s,57 ℃下退火复性30 s,72 ℃下延伸30 s,共进行29个循环;最后再在72 ℃下延伸5 min。将PCR产物克隆到pMD-18T载体中进行测序(苏州泓迅生物公司)。
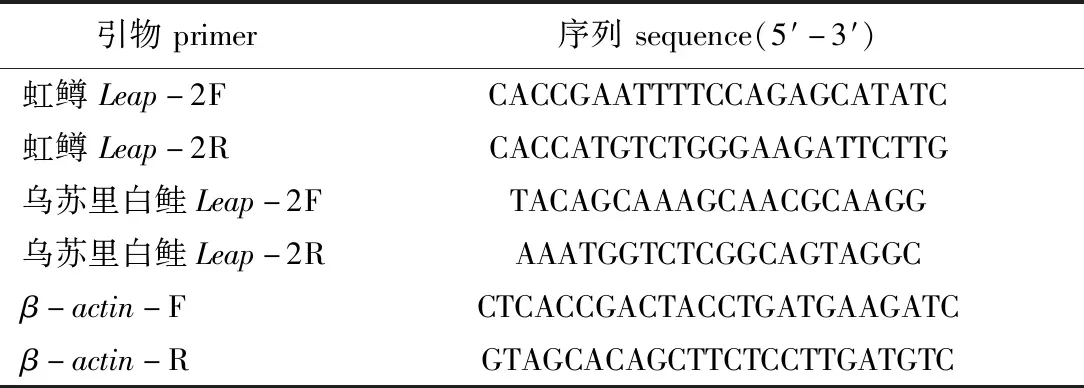
表1 Leap-2基因克隆和表达引物
1.2.2 Leap-2氨基酸序列分析 对克隆得到的乌苏里白鲑Leap-2基因编码的氨基酸序列,通过NCBI BLAST软件进行序列比对(http://www.ncbi.nlm.nih.gov)。采用DNAMAN 6.0软件进行多个氨基酸序列的比对,采用MEGA 6.0软件构建系统发育树[20],bootstrap值设定为1 000。采用在线分析软件SignalP 4.0(http://www.cbs.dtu,dk/services/SignalP/)预测序列信号肽,采用ExpASy(http://web.expasy.org/compute_pi/)预测蛋白的分子量和pI值,采用在线软件MEME(http://meme-suite.org/tools/meme)进行保守结构域分析。
1.2.3 细菌攻毒试验 将攻毒所用的健康鱼分为4组,3个试验组分别注射嗜水气单胞菌Aeromonashydrophila、杀鲑气单胞菌Aeromonassalmonicida和金黄色葡萄球菌Staphylococcusaureus,菌液培养至浓度为1×106CFU/mL时用于试验鱼腹腔的感染注射,每尾鱼注射100 μL,对照组注射等体积的PBS溶液。每个试验设置3个重复,每个重复6尾鱼。在细菌攻毒后的0、2、4、8、12、24、48、72 h分别采集对照组和试验组的性腺、肠、肝脏、心、皮肤、脾、鳃、肾和肌肉组织,无菌取样,用液氮速冻后于-80 ℃超低温冰箱中保存备用。
1.2.4 荧光定量PCR(quantitative real-time PCR,qRT-PCR) 为分析乌苏里白鲑Leap-2的表达,采用FastStart Universal SYBR®Green Master Mix(Rox)进行实时定量PCR。PCR反应条件:95 ℃下预变性10 min;95 ℃下循环变性15 s,60 ℃下退火复性30 s,共进行 40个两步循环。以β-actin作为内参基因。引物是通过Primer Premier 5.0(Premier Biosoft Internation ) 设计,荧光定量PCR所用引物见表1。
1.2.5 Western blot检测 从注射嗜水气单胞菌0、4、12、24、48、72 h 6个时间点的肝脏组织中提取总蛋白,各组蛋白在SDS-PAGE缓冲液中煮沸20 min充分变性后,用质量分数为12%的SDS-PAGE凝胶分离,电泳结束后,将蛋白转移到PVDF膜上,并通过Western印迹分析。以抗Leap-2(Ab199946,Abcam,1∶1 000)和β-微管蛋白(β-tubulin,yt4780,Immunoway,1∶10 000)为一抗,以山羊抗兔抗体IgG(1∶2 000) 为二抗。经Western印迹洗涤液PBST充分漂洗后,采用ECL试剂盒进行显色,再用灰度分析软件Image J对目的条带进行分析,以β-tubulin作为内参,每个样本设置3次重复。
1.3 数据分析
采用2-ΔΔCt法进行基因相对定量。试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 22.0软件进行单因素方差分析,采用Duncan法比较各组织间基因表达量的差异显著性,采用T检验法比较攻毒后基因在各时间段的差异显著性。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 Leap-2基因的克隆及序列分析
采用PCR方法从乌苏里白鲑肝脏中克隆得到Leap-2的ORF区,将其命名为乌苏里白鲑Leap-2 (GenBank:MZ 170050)。乌苏里白鲑Leap-2的ORF区片段长度为276 bp,可编码91个氨基酸,预测的蛋白相对分子质量为10 190,等电点pI为9.96。同其他物种相似,乌苏里白鲑Leap-2氨基酸具有保守的氨基酸结构,N-端的26个氨基酸残基为信号肽部分,随后的24个氨基酸残基为前体肽部分,C-端的41个氨基酸为成熟肽区域,其中包括4个高度保守的半胱氨酸残基(图1)。
利用MEGA软件基于NJ算法构建乌苏里白鲑Leap-2系统进化树,结果显示,乌苏里白鲑与虹鳟、银鲑Oncorhynchuskisutch、红大麻哈鱼O.nerka的亲缘关系较近(图2(a))。多序列比对显示,乌苏里白鲑的Leap-2氨基酸序列同银鲑的一致性最高(96.7%),与虹鳟和大西洋鲑Salmosalar的一致性分别为95.6%、94.51%。利用在线软件MEME对10个物种的蛋白保守结构域进行分析,结果显示,乌苏里白鲑的Leap-2氨基酸序列与银鲑、虹鳟、红大马哈鱼、褐鳟和大西洋鲑的氨基酸序列结构一致(图2(b))。
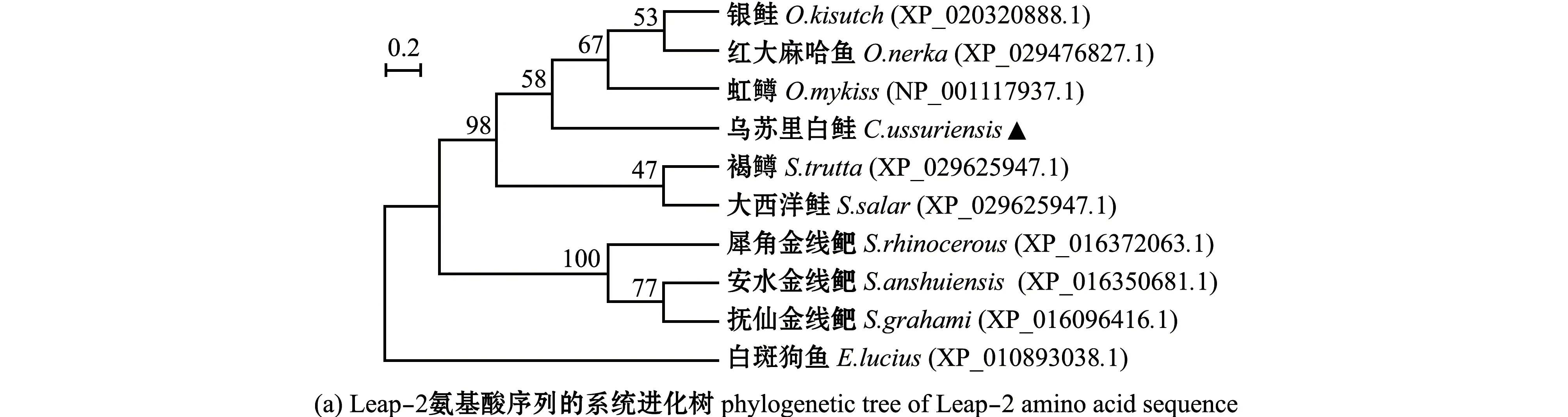
图2 Leap-2氨基酸序列结构分析Fig.2 Structure analysis of Leap-2 amino acid sequence
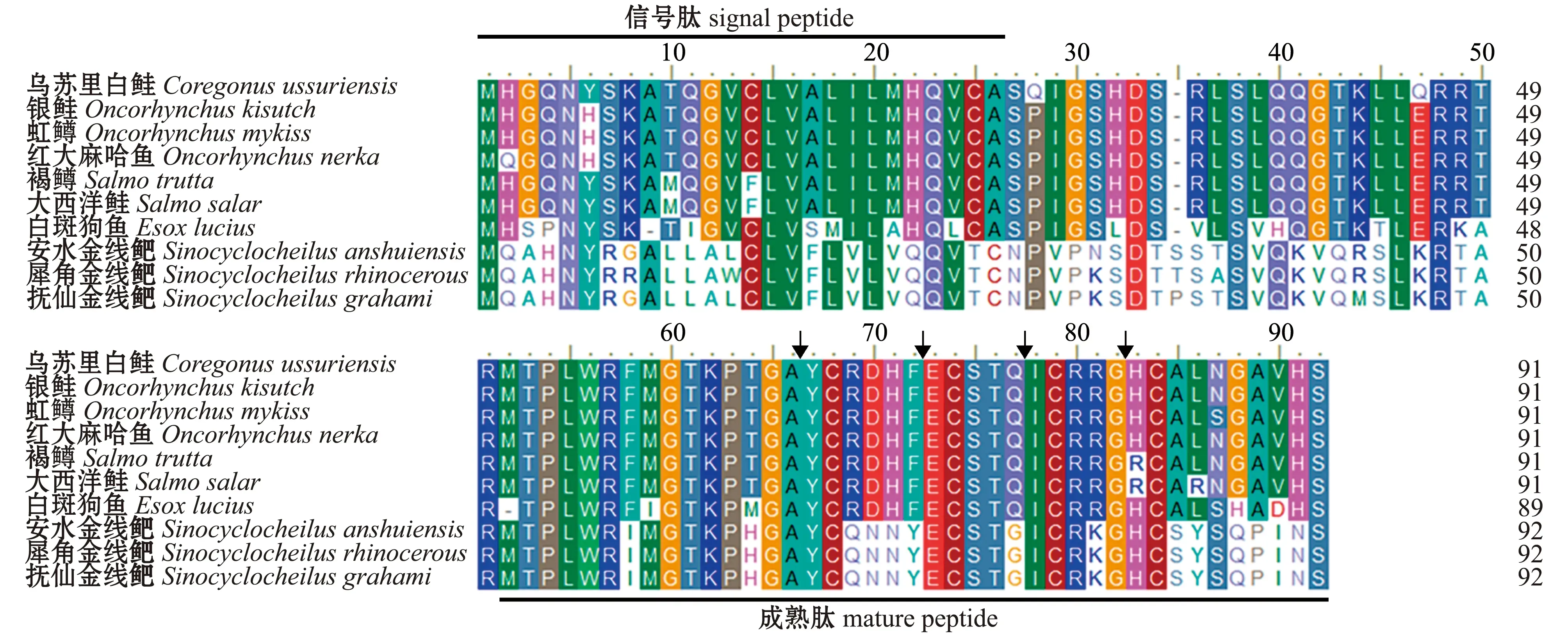
箭头指向4个保守的半胱氨酸残基。The arrow shows the four conserved cysteine residues.图1 乌苏里白鲑与其他物种Leap-2氨基酸的多序列比对Fig.1 Multiple alignment of amion acid sequence of Leap-2 between Ussuri cisco Coregonus ussuriensis and other species
2.2 Leap-2基因在不同组织中的表达分析
荧光定量PCR结果显示,Leap-2基因在乌苏里白鲑的心、肠、肝脏、肾、肌肉、脾、皮肤、鳃、性腺9个组织中均有表达。以心脏组织为参照,计算乌苏里白鲑Leap-2在其他各组织的相对表达量。其中,在肝脏中的相对表达量显著高于其他组织(P<0.05),其次是肠和脾,在肌肉中表达量最低,肝脏中表达量是肌肉中的106.12倍(图3)。
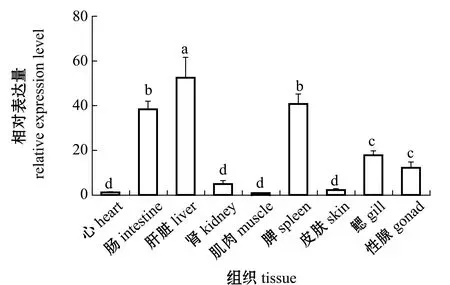
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。Note:The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.图3 Leap-2基因在乌苏里白鲑不同组中的相对表达量Fig.3 Relative expression levels of the Leap-2 in different tissues of Ussuri cisco Coregonus ussuriensis
2.3 Leap-2基因在细菌感染后的组织表达变化
本研究中,选用革兰氏阴性菌(嗜水气单胞菌、杀鲑气单胞菌)和革兰氏阳性菌(金黄色葡萄球菌)进行细菌攻毒试验。从图4可见:与对照组相比,注射嗜水气单胞菌后4 h时,肝脏和脾中的Leap-2基因表达量极显著上调(P<0.01),分别为对照组的3.91、9.54倍,8 h时,皮肤、肾和肠中的表达量极显著提升(P<0.01),肝脏、鳃、脾、皮肤、肾、肠组织中的最高表达量分别为对照组的6.88、14.60、9.54、53.81、8.61、7.54倍;经杀鲑气单胞菌感染后,Leap-2基因在6种组织中的表达量均表现出不同程度的上调,注射后24 h时肝脏中的表达量是对照组的16.48倍,4 h时脾中的表达量是对照组的13.76倍,随后表达量呈下降趋势,在48 h时恢复至对照组水平;与对照组相比,金黄色葡萄球菌的感染同样诱导了Leap-2基因在6种组织中的表达上调,注射后2 h时,鳃和脾中的表达量显著上调(P<0.05),之后脾中的表达量呈持续上调,48 h时为对照组的19.20倍。
2.4 嗜水气单胞菌感染后肝脏中Leap-2蛋白表达
为了进一步验证Leap-2蛋白在乌苏里白鲑应对病原物侵染时的免疫应答反应,本研究中提取了嗜水气单胞菌注射后0、4、12、24、48、72 h乌苏里白鲑肝脏中的Leap-2蛋白,以β-tubulin为内参,利用Western blot检测Leap-2蛋白表达量的变化。结果显示,在4、12、24 h时蛋白相对表达量明显高于对照组,而48 h后蛋白表达量下调,该结果证实了细菌感染能够诱导Leap-2蛋白在乌苏里白鲑体内的表达上调(图5)。
3 讨论
3.1 Leap-2氨基酸序列分析
本研究中,分析了乌苏里白鲑肝脏表达抗菌肽Leap-2氨基酸序列,同源性比对发现,其Leap-2与银鲑的序列相似性较高,一致性可达96.7%。此外,同虹鳟、褐鳟、大麻哈鱼的一致性均能达到90%以上,这说明Leap-2在鲑鳟鱼类的进化中保持较高的保守性。王珊珊等[21]对人的Leap-2进行生物信息学分析发现,在不同物种中,Leap-2的信号肽和前体肽差异较大,但成熟肽相似度较高,推测成熟肽区域是蛋白质发挥作用的关键。此外,氨基酸结构分析显示,乌苏里白鲑Leap-2在成熟肽区域具有4个保守的半胱氨酸,这与文献[22]报道的Leap-2的典型结构特点一致。研究表明,成熟肽区域的4个半胱氨酸残基可能形成两个二硫键,用于支撑β-发夹和螺旋结构,对核心结构的完整性和稳定性具有重要作用[23]。根据Li等[13]对Leap-2氨基酸序列结构的分析,本研究中乌苏里白鲑的Leap-2成熟肽4个半胱氨酸在C67与C78、C73与C83可能形成二硫键,这种二硫键形成方式与草鱼和鲤中的预测结构一致[8-9]。推测乌苏里白鲑的Leap-2可能与其他鱼类具有相似的功能。
目前,在乌苏里白鲑中仅发现了一种Leap-2,而在其他鱼类中报道了该蛋白的多种类型。如虹鳟中分离出了Leap-2A、Leap-2B和Leap-2C 3种亚型[11];鲤中鉴定得到的Leap-2A和Leap-2B 2种亚型[9],西伯利亚鲟中鉴定出了Leap-2AB和Leap-2C 2种亚型,且Leap-2AB型表现出更强的抗菌活性[16]。结合NCBI序列比对结果,乌苏里白鲑Leap-2与虹鳟的Leap-2B亚型(NP.001117937.1)同源性为95.6%,由此推测,本研究中所克隆的乌苏里白鲑的Leap-2为B型。
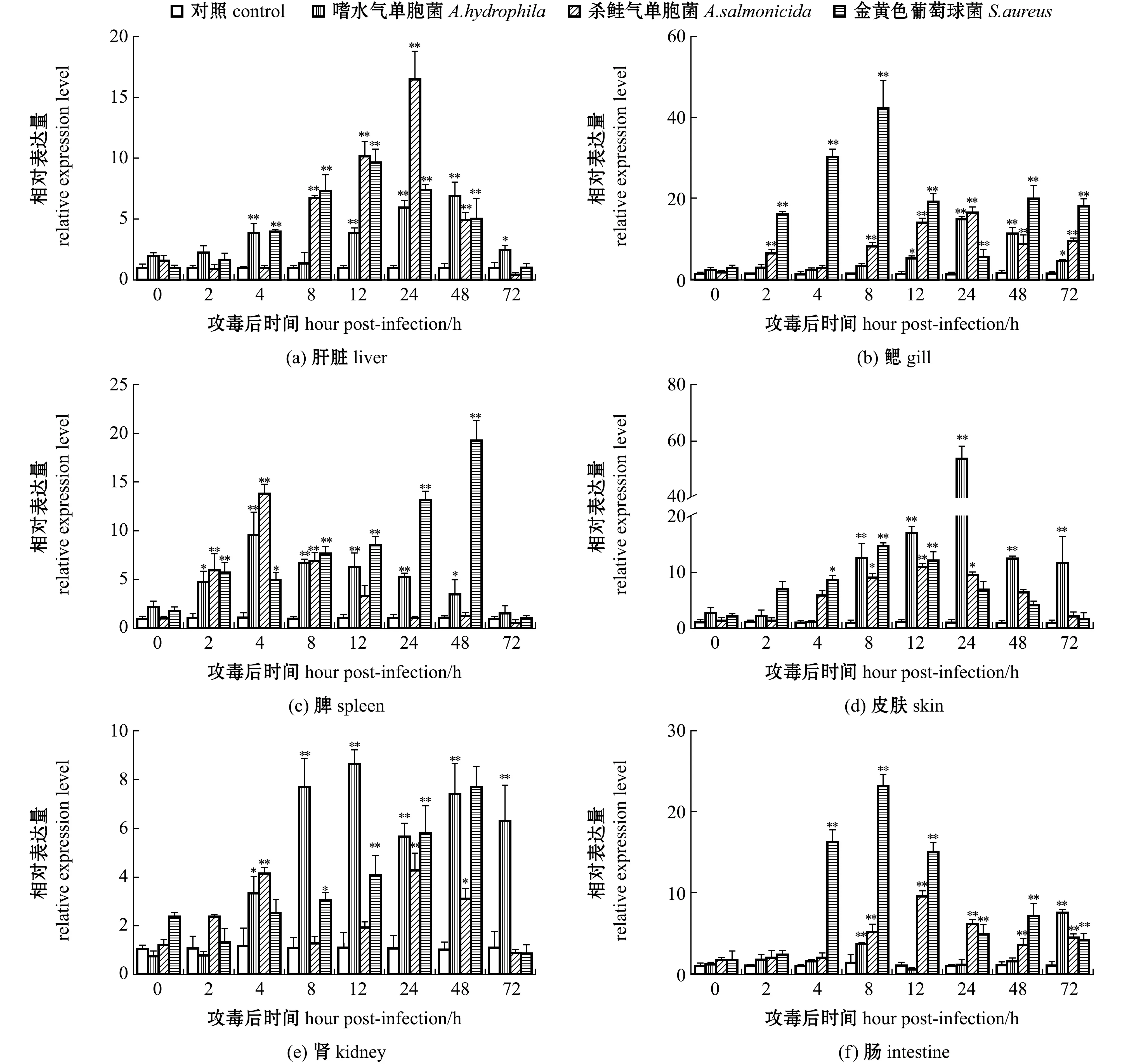
*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)。 *means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01).图4 细菌攻毒后乌苏里白鲑Leap-2基因的组织表达变化Fig.4 Changes in tissue expression levels of Leap-2 gene in Ussuri cisco Coregonus ussuriensis with bacterial infection
3.2 Leap-2的组织表达模式及功能分析
前期研究发现,脊椎动物中的Leap-2基因表达模式有明显差异。在哺乳动物中,人体内Leap-2基因主要在肝脏中被合成,分泌到血液中,且在尿液中也发现了Leap-2基因的代谢物[7];猪体内Leap-2基因在肝脏、肠组织和肾脏中表达较高[24]。在鱼类中,卵形鲳鲹Trachinotusovatus体内Leap-2基因在肝脏、脾和头肾中的表达量相对较高[13];鲤体内Leap-2基因在肝脏、头肾和脾中大量表达[9];草鱼体内Leap-2基因在除血液外的其他组织中广泛表达,且在肝脏中的表达量最高[8];而虹鳟体内Leap-2基因仅在肝脏中显著高表达[11]。本研究中,Leap-2基因在乌苏里白鲑9个组织中均有表达,并具有组织表达丰度差异性。其中,肝脏中表达量最丰富,其次为肠和肾,在肌肉中表达量最低,这表明在非应激条件下,Leap-2基因在乌苏里白鲑组织中有差异表达。综上所述,不同物种中的Leap-2基因表达模式存在差异,但在免疫组织中均有较高表达,推测其在多个物种的免疫应答调控过程中发挥着关键作用。
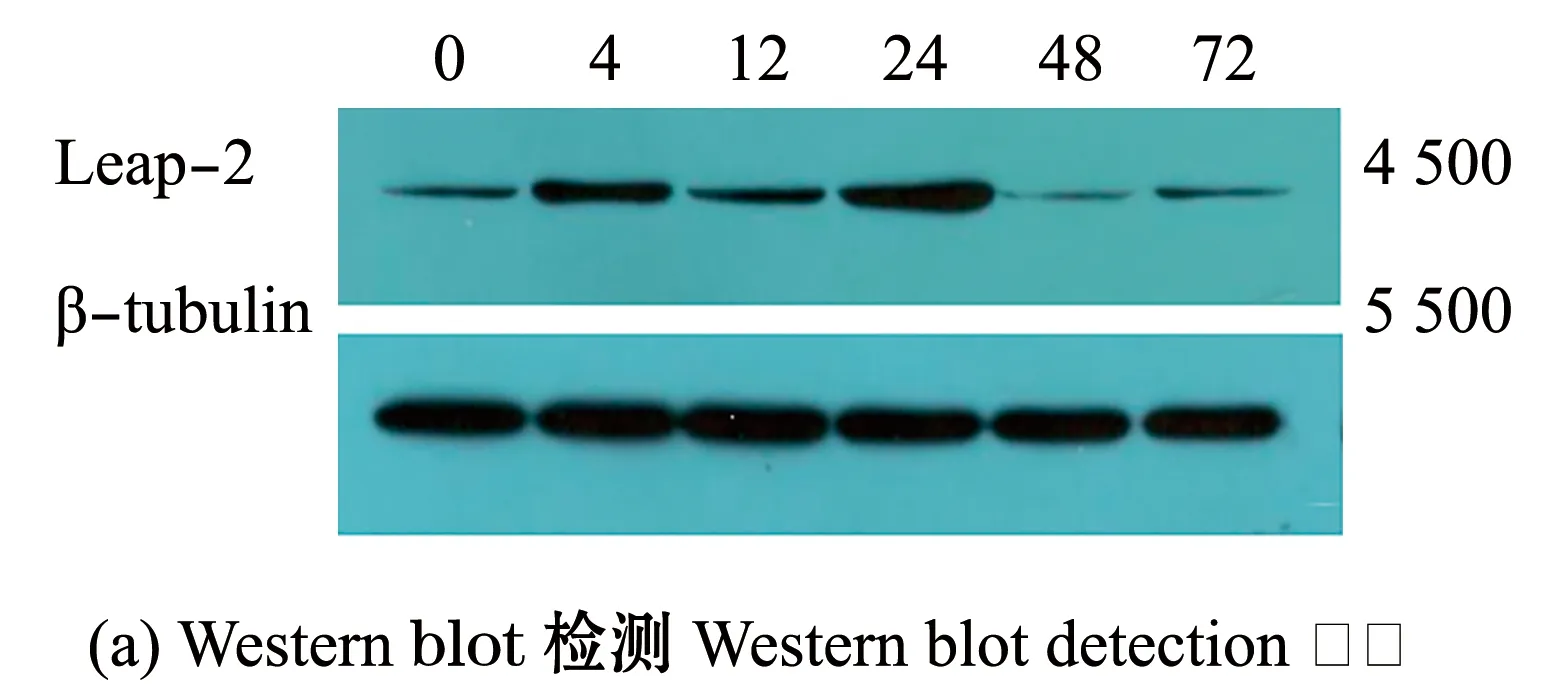
*表示与0 h有显著性差异(P<0.05);**表示与0 h有极显著性差异(P<0.01)。Note:*means significant difference compared with infection in 0 h (P<0.05);**means very significant difference compared with infection in 0 h(P<0.01).图5 嗜水气单胞菌攻毒后乌苏里白鲑肝脏中Leap-2蛋白的表达Fig.5 Leap-2 protein expression in liver of Ussuri cisco Coregonus ussuriensis after infection of Aeromonas hydrophila
3.3 细菌感染后Leap-2基因表达模式的变化
抗菌肽作为生物免疫系统分泌的一类具有抗菌活性的免疫活性物质,具有广谱抗菌活性[25]。一般认为,革兰氏阴性菌表面的脂多糖和革兰氏阳性菌表面的磷壁酸带负电荷,而带正电荷的抗菌肽可以结合到带负电荷的细菌细胞膜表面,从而破坏细菌细胞的完整结构,进而起到抑菌的作用[26-27]。为了探究乌苏里白鲑的Leap-2基因在不同病原菌侵染下的表达模式,本研究中选择了革兰氏阴性菌(嗜水气单胞菌和杀鲑气单胞菌)及革兰氏阳性菌(金黄色葡萄球菌)对乌苏里白鲑进行免疫刺激。嗜水气单胞菌是淡水、污水、淤泥及土壤中常见的细菌,也是引起淡水养殖生物烂鳃病和赤皮病的主要病原细菌[28],在抗菌肽相关研究中,该菌作为外源刺激菌而被广泛应用[29-30]。草鱼经嗜水气单胞菌感染后,在肝脏、脾、肌肉、皮肤、肾中Leap-2基因表达显著上调[8]。而嗜水气单胞菌感染团头鲂后,Leap-2基因在肝脏、脾、鳃、脑中的表达上调[31]。本研究中,嗜水气单胞菌感染后,相对于对照组,Leap-2基因在肝脏、鳃、脾、皮肤、肾中的表达量均显著提升。为进一步验证该抗菌肽的免疫应答功能,本研究中利用Western印迹检测了嗜水气单胞菌感染后Leap-2在蛋白水平上的表达模式,研究结果证实了乌苏里白鲑应对病原物入侵时,Leap-2在蛋白水平的表达上调,推测其在免疫反应中具有调控作用。
杀鲑气单胞菌是鲑鳟鱼类常见的致病菌之一[32]。研究发现,抗菌肽Leap-2对杀鲑气单胞菌具有抑菌活性,在虹鳟中,杀鲑气单胞菌攻毒后的2 d,肠和皮肤中的Leap-2基因表达上调[11]。本研究中,杀鲑气单胞菌的感染诱导了Leap-2基因在乌苏里白鲑中的显著高表达,暗示乌苏里白鲑Leap-2基因可能参与该致病菌引起的免疫调节反应。本研究中,利用金黄色葡萄球菌对乌苏里白鲑进行感染,结果发现,乌苏里白鲑Leap-2基因的表达在所调查的6种免疫器官中均得到不同程度的表达上调。前期研究表明,西伯利亚鲟的Leap-2基因对金黄色葡萄球菌有显著的抗菌活性[16]。然而唇鱼骨Hemibarbuslabeo的Leap-2基因对金黄色葡萄球菌则无明显的抑制作用[33]。这些差异表达模式暗示Leap-2基因的诱导可能存在组织特异性和物种特异性。本研究中,在金黄色葡萄球菌攻毒后的2 h,鳃和脾中的Leap-2基因表达水平就表现出显著升高,这可能是由于鳃和脾是鱼类最主要的免疫器官所致。Leap-2基因的快速诱导表明,抗菌肽Leap-2可能在乌苏里白鲑抵御多种细菌的早期防御中发挥一定的作用,但关于该肽的抗菌活性的确定,仍需要通过多肽的合成试验进一步证明。
4 结论
1)本研究中克隆获得了乌苏里白鲑Leap-2基因,结合系统进化分析,推断该分子为硬骨鱼类Leap-2B型。
2)在乌苏里白鲑的各个组织中均检测到Leap-2基因,其中,肝脏中Leap-2基因的表达量最高。
3)经嗜水气单胞菌、杀鲑气单胞菌和金黄色葡萄球菌感染后,Leap-2基因在乌苏里白鲑各组织中的表达量均有上调,这表明抗菌肽Leap-2参与乌苏里白鲑应对外源干扰的免疫应答过程。
