刺参Wnt9基因克隆、组织分布及在胚胎发育中的表达分析
2022-07-11马得友于莲莲林威港汪成粱丁君常亚青
马得友,于莲莲,林威港,汪成粱,丁君,常亚青
(大连海洋大学 水产与生命学院,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
胚胎期体轴的正确建立是多细胞动物器官发生与个体形态形成的关键基础[1-4]。Wnt(wingless-type MMTV integration site family)是一类重要的分泌型糖蛋白信号分子[5-7],其与膜上相应受体结合后,激活细胞内的多种信号通路,在动物胚胎发育、细胞分化和器官发育等多种生命过程中发挥重要作用[8],如调控胚胎体轴极性、胚胎期细胞的增殖分化与迁移及组织器官发育等[9-11]。Wnt基因与多样性胚轴在生物系统演化过程中同时出现,表明Wnt是最早在体轴形成与发育过程中扮演重要角色的基因家族之一[12]。
关于Wnt信号配体蛋白在后口动物胚胎发育与体轴建立的研究,较多的是围绕Wnt3、Wnt8、Wnt11等少数基因展开[13-15]。Wnt8是调控紫海胆Strongylocentrotuspurpuratus原肠胚内中胚层细胞增殖与分化的重要基因[15]。Wnt3和Wnt11则在佛罗里达文昌鱼Branchiostomafloridae中原肠晚期体轴后端的三胚层中表达,与此时背腹轴的形成有关[13]。而Wnt9作为Wnt家族基因成员之一,在两侧对称动物祖先中出现,并在紫海胆、爪蟾Xenopustropicalis、斑马鱼Daniororio等后口动物模式物种中保留下来,暗示着Wnt9基因可能对动物对称性发育的进化具有重要意义[12]。研究人员关注到Wnt9在海参Holothuriaglaberrima肠道再生过程中显著上调表达[16-17],在凡纳滨对虾Litopenaeusvannamei中呈组成型表达[18],体现出该基因在功能上的多样性。然而有关Wnt9参与水生无脊椎动物胚胎发育过程的研究却鲜有报道。
刺参Apostichopusjaponicus既是中国主要海水养殖种类,也是探究后口动物进化与起源的理想材料[19-20]。作为棘皮动物的代表种类[21],刺参幼体变态时,由两侧对称的大耳幼体转变为五辐射对称的稚参,形成典型的头尾轴。研究人员已清晰地描述了刺参胚胎发育过程及变态期幼体形态的巨大变化,然而有关Wnt基因参与海参类早期发育过程的研究严重不足,目前仅有Wnt9基因参与海参肠道再生过程的文献报道[17]。本研究中,通过RACE技术克隆刺参Wnt9基因的cDNA全长,定量分析其在刺参主要组织和早期发育阶段的表达情况,利用整体原位杂交技术进一步检测该基因在幼虫变态过程中的分布特征,从而在转录水平初步查明Wnt9基因在刺参变态发育过程中的作用,以期为深入阐释棘皮动物变态期的形态重塑及对称性转变机制提供数据支撑。
1 材料与方法
1.1 材料
试验用刺参幼体取自大连市鑫玉龙海洋生物种业科技股份有限公司育苗室,2龄成体刺参(体质量约100 g)采自大连市蚂蚁岛海域。
1.2 方法
1.2.1 样品的采集 幼体刺参:根据刺参幼体早期发育标准,收集受精卵、8细胞、16细胞、64细胞、256细胞、囊胚、原肠胚、小耳幼体、大耳幼体、樽形幼体和稚参共11个阶段的活体样品,保存在液氮中运至农业农村部北方海水增养殖重点实验室,然后提取其总RNA,随即反转成cDNA存放于-20 ℃冰箱,用于刺参Wnt9基因在胚胎和变态发育过程中的表达分析。
成体刺参:在冰上解剖活体取其体壁、肠、呼吸树、肌肉、性腺、管足和体腔细胞,经液氮速冻后于-80 ℃超低温冰箱中保存。在液氮中研磨后,提取各组织总RNA,反转录成cDNA,用于Wnt9基因cDNA全长的RACE克隆和组织表达。
1.2.2 总RNA提取及cDNA合成 使用TransZol Up Plus RNA Kit(北京全式金有限公司)提取刺参肠、呼吸树、体壁等主要组织及早期发育各阶段样品的总RNA,通过SimpliNano微量核酸分析仪检测RNA的浓度、纯度,利用琼脂糖凝胶电泳检测RNA的完整性。将质量合格的RNA保存于-80 ℃超低温冰箱,用于后续cDNA的合成。
以肠总RNA为模板,使用PrimerScriptTMRT Reagent反转录试剂盒(TaKaRa)合成cDNA第一链,用于扩增Wnt9基因中间保守区域。反应体系(20 μL):Oligo dT Primer 1 μL,Random 6 mers 1 μL,5×Primer ScriptTMBuffer 4 μL,Primer ScriptTMRT Enzyme MixⅠ 1 μL,total RNA 2 μL,RNase-free ddH2O 11 μL。通过SMARTer®RACE cDNA Amplification Kit(Clontech)合成5′RACE及3′RACE cDNA第一链,用于后续Wnt9 cDNA全长的克隆。
1.2.3Wnt9基因全长cDNA的RACE克隆 基于农业农村部北方海水增养殖重点实验室刺参幼体转录组中注释为Wnt9的基因序列,利用Primer Premier 5.0软件设计特异扩增引物(表1)。以肠cDNA为模板进行保守片段扩增。PCR反应体系(10 μL):cDNA 0.5 μL,Buffer 1 μL,Taq 0.2 μL,dNTP 0.8 μL,Wnt9-F1、R1各0.4 μL,ddH2O 6.7 μL。PCR扩增条件:94 ℃下预变性3 min;94 ℃下变性30 s,59 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸5 min。得到的PCR产物经琼脂糖凝胶电泳检测后,用TIANgel Midi Purification Kit(Tiangen)琼脂糖凝胶DNA回收试剂盒纯化。将回收的产物与pMD18-T载体连接后转入Trans 5α感受态细胞(北京全式金有限公司)中,摇床振荡1 h后将其均匀涂布于含有Amp抗性的LB培养基平板上,在37 ℃恒温培养箱中倒置过夜培养,次日挑取单菌落于盛有液体LB培养基的离心管中,摇床振荡,进行菌落PCR扩增,筛选有插入片段的阳性克隆送生工生物工程(上海)股份有限公司进行测序。
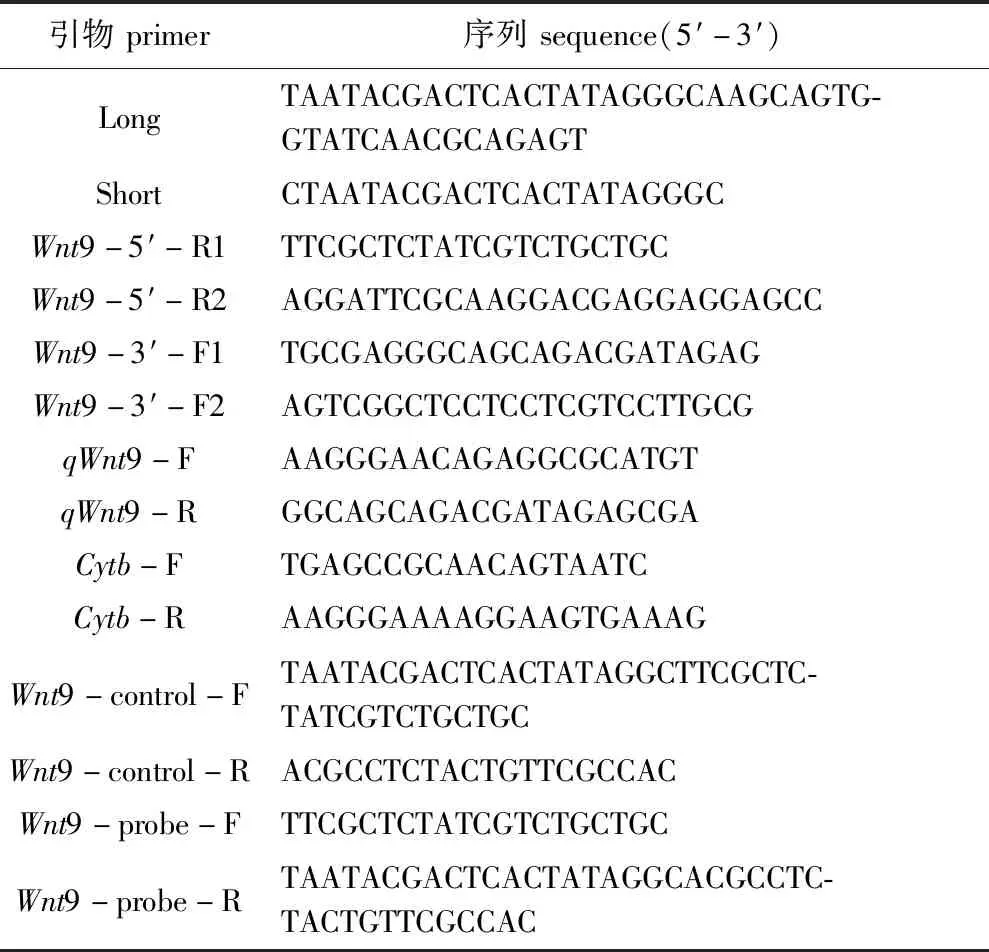
表1 试验用引物Tab.1 Primer sequences used in this study
通过得到的Wnt9中间片段设计RACE反应特异引物(表1),根据SMARTer®RACE cDNA Amplification Kit操作说明书进行5′RACE和3′RACE扩增。5′RACE的第一次梯度PCR反应体系(10 μL):Long Taq 0.2 μL,Buffer 1 μL,dNTP 0.8 μL,Long引物0.4 μL,Wnt9-5′-R1 0.4 μL,模板0.5 μL,ddH2O 6.7 μL。PCR反应条件:94 ℃下预变性3 min;94 ℃下变性30 s,67 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸5 min。以5倍稀释后的第一次PCR产物为模板,以Wnt9-5′-R2、Short为引物,进行第二次5′RACE的PCR扩增。3′RACE的PCR体系及反应条件与5′RACE相似。RACE产物测序操作与保守片段克隆试验中的测序步骤相同。
1.2.4 序列结构及系统进化分析 利用NCBI中的ORF-Finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行Wnt9基因的开放阅读框分析;使用DNAMAN 8.0软件进行氨基酸序列推导;使用Expasy Protparam工具和SMART(http://smart.embl-heidelberg.de/)预测Wnt9蛋白的基本理化性质和结构域;采用SignalP 5.0(https://services.healthtech.dtu.dk/)预测信号肽及糖基化位点;通过SOPMA在线软件和SWISS-MODEL(http://www.swissmodel.expasy.org/)分析Wnt9蛋白的二级结构和三级结构;利用ClustalW(http://www.ebi.ac.uk/Tools/msa/clustalW2/)进行氨基酸序列多重比对;利用MEGA 7.0构建基于邻近法(Neighbor-joining)的系统进化树。
1.2.5 实时荧光定量PCR 根据克隆出的Wnt9基因cDNA全长序列,使用Primer Premier 5.0软件设计荧光定量PCR引物(表1)。按照TransStart Top Green qPCR Super Mix Kit(北京全式金有限公司)的操作说明书,以Cytb为内参基因,利用实时荧光定量PCR仪(LightCycler®96,Roche)进行Wnt9 PCR扩增。PCR反应体系(20 μL):Super Mix 10 μL,cDNA 2 μL,qWnt9-F、R各0.4 μL,ddH2O 7.2 μL。反应程序:94 ℃下预变性30 s;94 ℃下变性5 s,60 ℃下退火30 s,共进行45个循环。每个样品设置3个生物学平行并重复3次技术测定。反应结束后,首先进行溶解曲线分析,确认引物的特异性,采用2-△△Ct法计算基因的表达量,分别以管足和受精卵时期的基因表达量为基值,计算其他组织和发育时期的基因相对表达量。
1.2.6 RNA探针合成 在Wnt9基因cDNA全长序列中设计引物(表1),经PCR扩增后将特异目的片段进行切胶回收并纯化,置于-20 ℃中保存备用。参照文献[22]中的方法,使用DIG RNA Labeling Mix Kit(Roche)制备RNA探针。具体操作如下:1)在无酶微量离心管中配制20 μL PCR反应体系,包含DNA纯化产物 10 μL、DIG RNA Labeling Mix 2 μL、Transcription Buffer 2 μL、T7酶2 μL和ddH2O 4 μL,离心混匀后于37 ℃下反应2 h;2)反应完成后加入2 μL DNA酶,37 ℃下反应15 min,以消化剩余模板,随后加入2 μL 0.2 mol/L EDTA(pH 8.0)终止消化;3)加入-20 ℃预冷的4 mol/L LiCl 2.5 μL、无水乙醇75 μL,-20 ℃沉淀过夜;4) 次日,4 ℃下以13 000g离心15 min,再用-20 ℃预冷的无水乙醇(体积分数为70%)洗涤2次,随后以13 000g离心5 min,去掉上清液,于超净工作台干燥,最后加入25 μL ddH2O溶解RNA,并用微量分光光度计及琼脂糖凝胶电泳检测RNA探针的浓度及质量,最后将探针分装,于-80 ℃超低温冰箱中保存备用。
1.2.7 整体原位杂交 参考斑马鱼胚胎整体原位杂交技术[23],并针对刺参幼体特点进行优化。具体操作如下(本节中%均指体积分数):
1)样品处理。以变态前的晚期大耳幼体、变态中的樽形幼体及变态后的稚参为材料,取3个阶段已被逐步麻醉的幼虫,加入4%的多聚甲醛(PFA),并于-20 ℃冰箱中固定及保存;使用前,置于无水甲醇中脱水至少2 h。
2)复水。复水步骤:60%甲醇+40%PBST,5 min;30%甲醇+70%PBST,5 min;100%PBST,5 min,2次。
3)蛋白酶K处理。用质量浓度5 μg/mL的蛋白酶K在室温下分别处理大耳幼体1 min、樽形幼体15 min、稚参20 min;反应结束后,用PBST漂洗2次,每次5 min。
4)再固定。用4% PFA室温固定样品20 min,去除固定液后放在摇床上,用PBST慢速漂洗2次,每次5 min。
5)预杂交。在无探针的预杂交液Hybe(-)(500 mL甲酰胺,250 mL 20×SSC,9.2 mL 1 mol/L柠檬酸,1 mL Tween-20,用双蒸水定容至1 L)中,对幼体进行45 ℃水浴摇振(75~80 r/min) 1 h。
6)杂交。将正义探针(引物Wnt9-control)及反义探针(引物Wnt9-probe)分别加至杂交缓冲液Hybe+(向Hybe(-)溶液中加入tRNA和肝素配制而成)中,使探针终质量浓度为1 ng/μL;将200 μL杂交液加入样品管中,在杂交仪中45 ℃水浴摇振(75~80 r/min)过夜。
7)洗脱。依次按照100% Hybe(-)10 min→75%Hybe(-)+25% 2×SSC 10 min→50%Hybe(-)+50% 2×SSC 10 min→25%Hybe(-)+75% 2×SSC 10 min→100% 2×SSC 10 min→100% 0.2×SSC 4×15 min进行梯度洗脱,移除多余的探针。
8)抗体孵育。用PBST-SB溶液(1×PBST、2%山羊血清、2 mg/mL BSA按照体积比为1∶1∶1配制)将幼体封闭2 h,移去封闭液后,抗体(用PBST-SB按1∶5 000稀释的地高辛抗体)于4 ℃下过夜孵育。
9)显色及镜检。移去抗体后,室温下用PBST快速洗5次,每次5 min,再用BCL Buffer(1 mol/L pH为9.5的Tris-HCl 20 mL,5 mol/L NaCl 4 mL,0.5 mol/L MgCl210 mL,20% Tween-20 1 mL,用双蒸水定容至50 mL) 洗涤3次,每次5 min。随即加入BCL Buffer与BM Purple(Roche)按照1∶1配成的显色液,避光显色4 h;显色完成后,用4%多聚甲醛固定幼虫至少20 min,再用1×PBST洗涤3次,每次5 min;最后吸干PBST,与70%甘油混合后,置于载玻片上,用显微镜下(Leica)对正义探针处理组(阴性对照)、反义探针处理组(阳性信号组)观察并拍照。
1.3 数据处理
采用平均值±标准差(mean±S.D.)表示基因mRNA相对表达量,通过SPSS 23.0软件对数据进行单因素方差分析(one-way ANOVA),使用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 Wnt9基因克隆及全长cDNA序列分析
从图1可见,克隆得到刺参Wnt9 cDNA序列全长为1 603 bp,包括97 bp的5′UTR、1 104 bp的ORF和404 bp的3′UTR,可编码367个氨基酸,预测蛋白相对分子质量为41 400。预测刺参Wnt9氨基酸序列包含1个跨膜区(7~26 aa)、1个Wnt1保守结构域(59~366 aa),以及2个位于N-101和N-316处的糖基化位点。在预测出的Wnt9蛋白二级结构中,α-螺旋占35.15%,β-转角占3.27%,无规则卷曲占49.32%,延伸链占12.26%。

黑体表示起始密码子(ATG)及终止密码子(TAA);下划线表示跨膜区;阴影区表示Wnt1结构域;阴影区下划线表示N-糖基化位点。Black stands for the start(ATG) and stop codon(TAA);transmembrane domain is underlined;the Wnt1 domain are shaded in light gray;the N-glycosylation sites are underlined in shadow area.图1 刺参Wnt9基因的全长cDNA序列和推导的氨基酸序列Fig.1 Full-length cDNA sequence and deduced amino acid sequence of Wnt9 gene in sea cucumber Apostichopus japonicus
2.2 多重序列比对和系统进化分析
用于多重序列比对的11个物种及其Wnt9氨基酸序列在NCBI中的登录号见表2。氨基酸序列比对结果显示,刺参与海参(GenBank:GQ243223.1)Wnt9氨基酸序列的一致性最高(66.12%),与紫海胆Wnt9a氨基酸序列一致性较高(41.17%)。刺参Wnt9蛋白具有Wnt家族特有的保守片段 CKCHGVS及25个形成内部二硫键的半胱氨酸(图2)。

表2 用于氨基酸序列同源比对和系统进化分析的Wnt9信息Tab.2 Information on Wnt9 for comparative identify of amino acid sequences and phylogenetic analysis

阴影区域表示同源性氨基酸,黑色表示同源性为100%,粉红色表示同源性为>75%,浅蓝色表示同源性>50%;红色虚线方框表示Wnt保守片段CKCHGVS,下划线表示Wnt1结构域。Shaded area means homology of amino acids:completely conserved positions are shaded in black,position with >75% similarity is shaded in pink,and position with >50% similarity is shaded in light blue;Wnt conserved amino acid residues CKCHGVS are framed in red dotted box,and the Wnt1 domain is underlined.图2 刺参与其他物种Wnt9氨基酸的多重序列比对Fig.2 Multiple alignment of amino acid sequence of Wnt9 between sea cucumber Apostichopus japonicus and other species
从图3可见,在比对的物种中,棘皮动物聚为一大支,刺参与海参聚为一支,紫海胆和长棘海星Acanthasterplanci聚为一支,这说明海参纲物种Wnt9氨基酸序列的亲缘关系最近,符合物种进化趋势和亲缘关系。
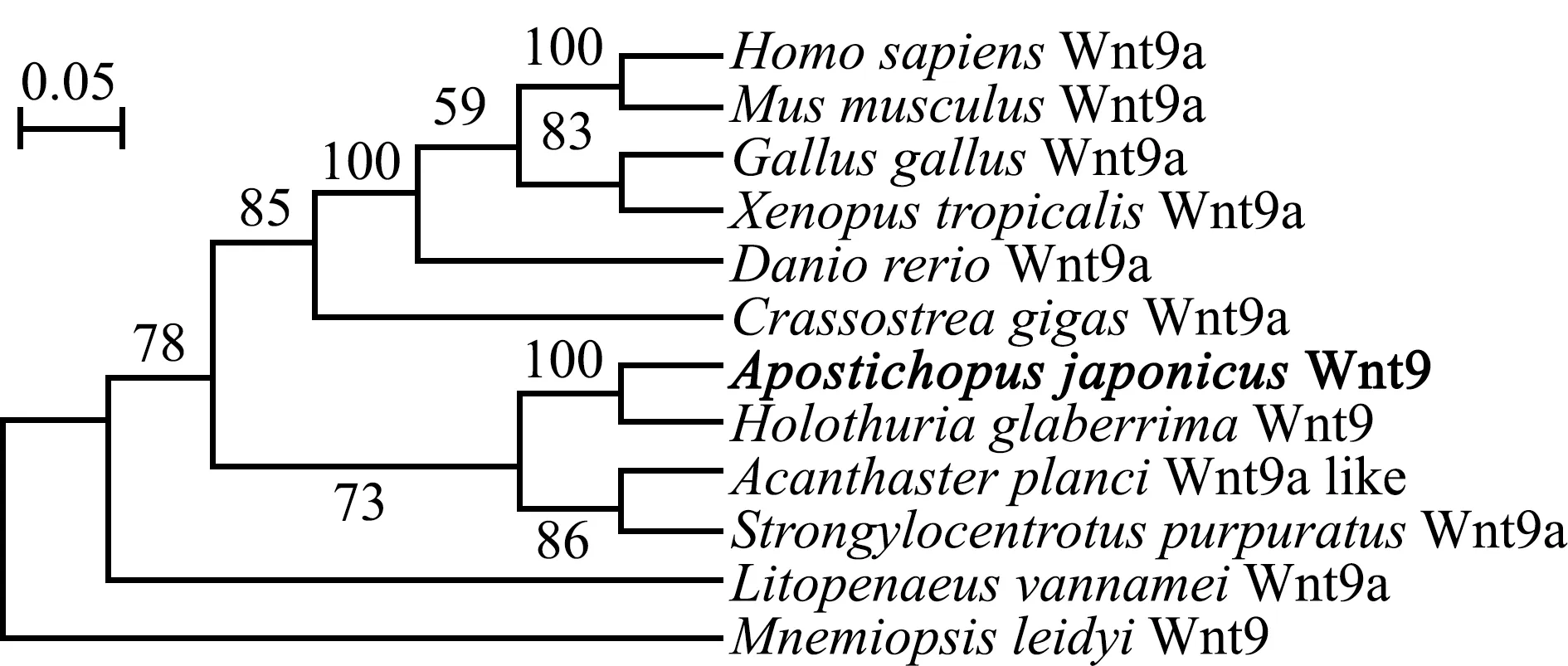
图3 不同物种 Wnt9氨基酸序列的系统进化树Fig.3 Phylogenetic tree of amino acid sequences of Wnt9 in different species
2.3 Wnt9基因在刺参不同组织中的表达分析
从图4可见,Wnt9 mRNA在健康刺参7个组织中均有表达;在性腺中表达量最低(P<0.05),在体壁中表达量最高(P<0.05),肌肉、肠、呼吸树和体腔细胞中的表达量显著高于性腺 (P<0.05)。
2.4 Wnt9基因在刺参早期发育过程中的表达分析
从图5可见:Wnt9基因在刺参整个早期发育过程中均有表达,但表达幅度有差异;Wnt9在整个卵裂期和大耳幼体阶段呈现持家基因的表达特征,整体上表达量都较低,且无显著性差异(P>0.05);从樽形幼体开始,该基因的表达量显著高于大耳幼体(P<0.05),到稚参期达到最高(P<0.05),此时期的表达量为受精卵时期的60倍。
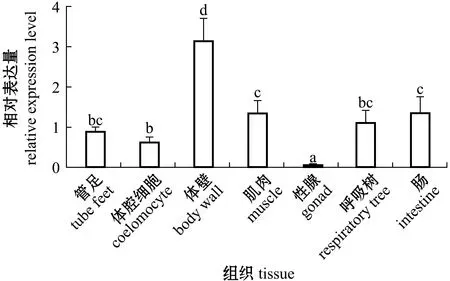
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。Note:The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.图4 Wnt9 mRNA在刺参成体组织中的表达比较Fig.4 Expression level of Wnt9 mRNA in various tissues of sea cucumber Apostichopus japonicus

图5 Wnt9 mRNA在刺参发育阶段的表达比较Fig.5 Expression levels of Wnt9 mRNA during development stages of sea cucumber Apostichopus japonicus
2.5 刺参Wnt9基因在变态阶段的表达定位
运用整体原位杂交技术在刺参晚期大耳幼体、樽形幼体和稚参3个阶段检测Wnt9基因的表达定位情况。从图6可见:与阴性对照组相比,在Wnt9反义探针处理试验组中,从耳状幼体至樽形、稚参,阳性信号逐渐增强;晚期大耳幼体时期即有阳性信号出现,但无明显集中;樽形时期阳性信号增强,集中在五对球状体;稚参时期阳性信号强,且主要集中在管足和水体腔周围。
3 讨论
3.1 刺参Wnt9的序列特征与进化分析
近年来,对一些非模式动物如海蜇(Wnt5)、长牡蛎(Wnt6)和黄颡鱼(Wnt2、Wnt3a、Wnt8a)的研究显示,Wnt家族成员间的结构保守[24-26]。本研究中,采用RACE技术克隆得到了刺参Wnt9基因的cDNA全长序列,对其氨基酸序列分析发现,刺参Wnt9具有与其他物种Wnt9相同的结构特征,包括Wnt1保守结构域、Wnt家族特有保守片段及参与二硫键形成的半胱氨酸保守序列[24,26-29]。多重序列比对表明,刺参Wnt9氨基酸序列与来自棘皮动物Wnt9a和软体动物Wnt9a的相似程度较高。进化树分析进一步揭示了刺参Wnt9氨基酸与同门近缘物种紫海胆、长棘海星的亲缘关系最近。

A~C—用正义探针处理的胚胎(阴性对照);A′~C′—用反义探针处理的胚胎;B′、C′—左上角小图为箭头指示的HS、TF区域阳性信号的放大;HS—球状体;TF—管足;WV—水体腔。A-C—embryos treated with sense probes(negative control);A′-C′—embryos treated with anti-sense probes;photos B′ and C′ in upper left are enlarged views of the positive signals in HS and TF areas indicated by arrowheads;HS—hyaline sphere;TF—tube feet;WV—water-vascular canal.图6 刺参变态过程中Wnt9基因表达的整体原位杂交分析Fig.6 Whole mount in situ hybridization analyses of Wnt9 gene expression during metamorphosis of sea cucumber Apostichopus japonicus
3.2 刺参Wnt9基因的组织表达模式
Wnt9基因在哺乳类[30]、鱼类[28]和甲壳类[18]等生物不同组织中均有表达,这表明其可能在多种生命过程中发挥作用。人体中Wnt9b的突变与子宫纵膈发生相关[31]。凡纳滨对虾Wnt9a在胃、后盲囊、肝胰腺中高表达,还参与了血细胞抗病毒和细菌的固有免疫应答[18]。黄颡鱼Wnt9b在肌肉中的表达显著高于其他组织,还可能介导铜影响卵巢发育和激素合成的变化[25]。本研究中,克隆出的Wnt9基因与其他物种的同源基因一样,在刺参体壁、肌肉、肠、呼吸树、管足、体腔细胞和性腺等全部组织中均有表达,这说明Wnt9具有作为持家基因行使功能的特征。Wnt9在刺参体壁中表达水平显著高于其他组织,在肠中的表达也较高,可能是因为体壁组织为刺参保护性屏障,形成抵御不利环境的第一道防线[32],而肠是刺参主要免疫组织,由此推测,Wnt9基因可能对刺参免疫应答具有重要调控作用。此外,肌肉中Wnt9的高表达,意味着Wnt9是一个多功能基因,与其他Wnt亚家族基因一样[33-34],参与刺参的免疫防御及生长发育过程。
3.3 Wnt9基因在刺参早期发育过程的表达特征和空间定位
Wnt信号通路是在进化上高度保守的信号途径,是所有后生动物极化发育的基础[33],在胚胎发育、细胞分化、增殖和凋亡等生理过程中均发挥重要作用[8]。在紫海胆早期发育阶段,Wnt8基因是控制原肠胚内中胚层分化的关键基因,作为主要因子决定前后体轴的形成[15]。Wnt9在海参中通过控制细胞增殖与分化作用于肠道的再生[17]。本研究中,检测到刺参Wnt9基因从受精卵到大耳幼体呈现低水平的持续表达,这表明该基因在刺参变态前的胚胎发育中起着一定的作用,可能与胚胎左右轴的产生有关。樽形幼体是刺参变态的过渡形态,Wnt9在此阶段的表达量是变态前大耳幼体中的5倍;当幼虫完成变态转变为稚参时,骨片和管足开始出现,此时Wnt9的表达迅速升高,为樽形幼体中的12倍。整体原位杂交分析进一步发现,Wnt9在大耳幼体中阳性信号微弱,而在樽形幼体、稚参中的阳性信号显著增强。据此推断,Wnt9可能通过促进细胞的增殖与分化参与了稚参体壁发育、头尾轴形成及形态的转变。
4 结论
1)刺参Wnt9蛋白具有Wnt家族的典型特征,包含2个N-糖基化位点和多个保守半胱氨酸残基。
2)在健康刺参各个组织中均能检测到Wnt9 mRNA的表达,其中,在体壁、肠等固有免疫组织中的表达量较高。这表明,Wnt9基因能够参与到刺参成体的免疫防御中。
3)在刺参整个胚胎发育时期均检测到Wnt9基因的持续表达,且Wnt9表达量在樽形幼体中开始明显升高,在稚参中达到峰值。这表明,Wnt9基因对刺参变态后期的生长发育具有重要作用。
