江苏大豆上分离的豇豆轻斑驳病毒基因组序列克隆及特征分析
2022-07-11吴淑华涂丽琴高丹娜崔晓艳季英华郭青云
吉 颖,孙 枫,吴淑华,李 硕,涂丽琴,高丹娜,崔晓艳,陈 新,季英华,郭青云
(1.青海大学 农林科学院,青海省农业有害生物综合治理重点实验室,农业部西宁作物有害生物科学观测实验站,青海 西宁 810016;2.江苏省农业科学院 植物保护研究所,江苏 南京 210014;3.江苏省农业科学院 经济作物研究所,江苏 南京 210014)
豇豆轻斑驳病毒(Cowpeamildmottlevirus,CpMMV)是一种重要的植物RNA病毒,隶属于乙型线状病毒科(Betaflexiviridae)香石竹潜隐病毒属(Carlavirus)[1],病毒粒子为弯曲丝状颗粒,大小约为650 nm×15 nm,基因组为单链正义RNA,全长8 194 bp,包含5′帽子和3′Poly(A)尾,共编码6个蛋白:参与病毒基因组复制的依赖RNA的RNA聚合酶(RNA dependent RNA polymerase,RdRp),参与病毒运动的三重基因块1(Triple gene block 1,TGB1)、三重基因块2(Triple gene block 2,TGB2)和三重基因块3(Triple gene block 3,TGB3),外壳蛋白(Coatprotein,CP),核酸结合蛋白(Nucleic acid binding protein,NBP)[2]。
CpMMV主要由烟粉虱以非持续方式传播[3],也能通过种子传播[4],危害大豆、豇豆、菜豆等多种豆科作物。CpMMV最早于1973年在加纳首次报道[5],随后在非洲[6-10]、美洲[11-15]和亚洲[16-20]等多个热带和亚热带地区都出现该病危害。在我国,CpMMV最早于2013年在台湾地区出现危害报道[19],之后在海南[20]和安徽[21]也出现危害报道,呈逐渐蔓延和加重的趋势。目前,虽然CpMMV发生危害的报道较多,但明确全基因组序列信息的分离物还较少,我国目前仅海南[20]和安徽[21]2个分离物有基因组信息报道。
2019年在对江苏省大豆病毒病进行调查时发现,当地大豆上也出现了CpMMV的危害,为深入了解该分离物的特征及其分类地位,本研究利用分段法克隆其全基因组序列,解析基因组结构特征,旨在明确分类地位,为后续进一步研究CpMMV的进化特征及致病机制奠定基础。
1 材料和方法
1.1 试验样品
供试样品为2019年采自徐州的大豆病样,病样叶片出现明显黄化、花叶等症状。
1.2 总RNA提取
病样总RNA的提取参照吴淑华等[22]的方法进行。取采集的大豆叶片放入液氮中处理后,转移至全自动样品研磨仪中研磨充分,加1 mL RNAiso Plus溶液,摇匀后静置5 min;加400 μL RNA提取液,涡旋振荡充分,室温放置5 min后,4 ℃ 12 000 r/min离心 10 min;取上清液转移至无菌离心管中,加入等量的冰异丙醇,轻轻混匀,-20 ℃放置30 min;4 ℃ 12 000 r/min离心10 min,后弃上清,用1 000 μL 75% 酒精清洗沉淀 2 次后,4 ℃ 8 000 r/min,离心5 min,弃上清,待酒精挥发,加入30 μL的0.1% DEPC 水中,测定 RNA的浓度和质量后,-80 ℃保存备用。
1.3 cDNA合成
利用TaKaRa反转录试剂盒进行反转录,反应体系:Random 6 mers(10 μmol/L)1.0 μL,RNA 2.0 μL,ddH2O 5.0 μL,dNTP Mix(10 μmol/L)1.0 μL,Oligo dT Primer(50 μmol/L)1.0 μL;65 ℃反应5 min,取出反应液加入ddH2O 5.0 μL,RNase Inhibitor(40 U/μL)0.5 μL,5 × PrimeScript Buffer 4.0 μL,PrimeScriptRTase(200 U/μL)0.5 μL,于30 ℃ 10 min,42 ℃ 1 h,70 ℃ 15 min后结束,获取的cDNA放于-20 ℃冰箱保存。
1.4 CpMMV基因组克隆
利用已公开的CpMMV基因组序列,合成4对特异性引物(表1),以上述的cDNA为模板进行PCR扩增,扩增体系:2 × PrimeSTARMax Premix 10 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA 1.0 μL,ddH2O 8 μL,总体积20 μL;PCR程序:95 ℃预变性3 min;98 ℃10 s,53 ℃ 15 s,72 ℃2 min,30个循环;72 ℃延伸5 min,4 ℃保存。取5 μL PCR产物经琼脂糖凝胶电泳检测后,使用回收试剂盒进行回收。将回收产物与pEAZY-Blunt Zero载体连接,热激法转化Trans1-T1感受态细胞,涂布均匀于氨苄(Amp+)培养基进行生长,PCR验证单克隆菌落,验证正确后将其送至通用生物系统(安徽)有限公司测序。

表1 引物信息Tab.1 Primers information
1.5 序列分析
测序完成后,依据片段的引物去掉两端残留的序列,拼接获得基因组序列,将本研究的CpMMV基因组序列与已公布的CpMMV不同分离物及同属其他病毒的基因组序列进行分析,序列同源性分析、多重比对利用ClustalX、BioEdit等软件及NCBI网站上的Blast完成,聚类分析及进化树构建采用MEGA 6.0软件的邻接法完成[23]。
2 结果与分析
2.1 CpMMV基因组克隆策略
鉴于CpMMV基因组序列全长超过8 kb,因此拟采用分段克隆法:通过图1中引物(4对),将CpMMV全长分为4段进行扩增和克隆。相邻片段之间保留重叠部分序列,以保证序列能准确拼接。
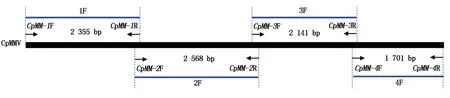
图1 CpMMV基因组克隆策略Fig.1 The cloning strategy for CpMMV
2.2 CpMMV基因组克隆
基于制定的分段法克隆基因组序列策略,针对CpMMV基因组全长设计引物(表1)。以上述的cDNA为模板进行扩增,结果显示,4对引物都扩到相对应的特异性条带(图2)。将目的条带进行回收,回收产物与pEAZY-Blunt Zero载体于25 ℃反应40 min连接,热激法转化Trans1-T1感受态细胞后经单菌落PCR筛选阳性克隆,阳性克隆鉴定后送至公司进行测序,最后经序列拼接获得CpMMV江苏分离物的全基因组序列。
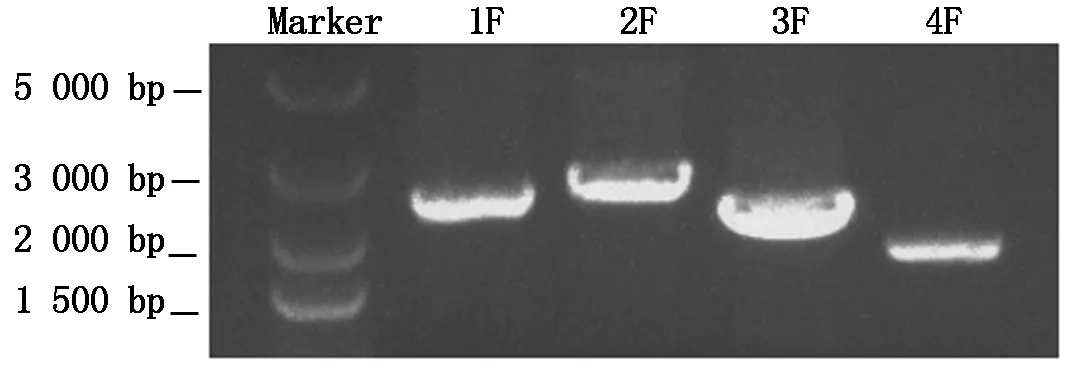
图2 CpMMV基因组分段RT-PCR扩增Fig.2 RT-PCR amplification of CpMMV genome
2.3 CpMMV江苏大豆分离物基因组结构特征
CpMMV基因组序列经信息分析后,结果显示,其基因组全长为8 194 bp,共编码6个蛋白(图3),其中73~5 652 bp编码由1 859个氨基酸组成分子质量约为211.3 ku的复制酶蛋白(全长5 580 bp),5 681~6 376 bp编码由231个氨基酸组成分子质量约为25.6 ku的TGB1蛋白(696 bp),6 376~6 696 bp编码由106个氨基酸组成分子质量约为11.6 ku的TGB2蛋白(321 bp),6 674~6 880 bp编码由68个氨基酸组成分子质量约为7.7 ku的TGB3蛋白(207 bp),6 896~7 762 bp编码由288个氨基酸组成分子质量约为32 ku的外壳蛋白(867 bp),7 765~8 076 bp编码由103个氨基酸组成分子质量约为11.8 ku的NBP蛋白(312 bp);同时序列分析结果显示,CpMMV江苏分离物基因组两端各有一个非编码区:5′端非编码区长度为72 nt,3′端非编码区长度为117 nt(图3)。
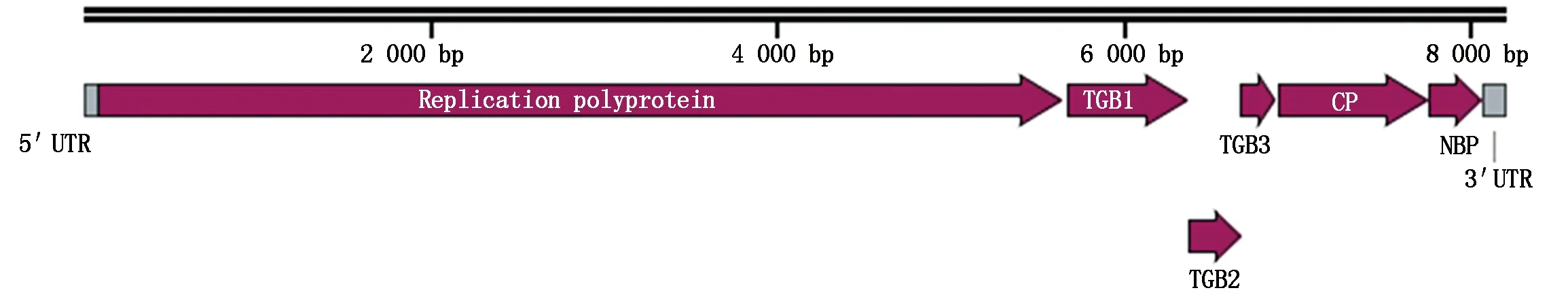
图3 江苏侵染大豆的CpMMV基因组结构Fig.3 Genome organization of CpMMV infecting soybean in Jiangsu Province
对CpMMV江苏分离物编码蛋白与其他分离物之间的同源性进行分析发现,其与中国的2个分离物(MN908944、KY420906)同源性相对较高,而与其他分离物同源性相对较低;在6个编码蛋白中,CP与其他分离物之间的同源性最高(96.5%~100.0%),暗示了CP蛋白可能相对保守,TGB2(84.0%~99.1%)和NBP(87.4%~98.1%)次之,RdRp(81.1%~98.2%)、TGB1(81.0%~97.0%)和TGB3(80.9%~95.6%)同源性相对较低,暗示了其在不同分离物之间可能表现较好的多样性(表2)。

表2 CpMMV江苏分离物编码蛋白与其他分离物之间的同源性Tab.2 Amino acid sequence identities of CpMMV-Jiangsu with other CpMMV isolates %
2.4 CpMMV江苏大豆分离物聚类分析
对获得的CpMMV江苏大豆分离物基因组序列进行比对分析,结果发现,其与我国之前报道的分离物同源性相对较高:与安徽分离物(MN908944)的同源性最高(98.2%),与海南分离物(KY420906)同源性次之(96.0%),而与其他国外分离物之间的同源性相对较低(低于82.7%)(表3);系统进化分析结果也显示,其他CpMMV分离物和本研究的CpMMV分离物都聚类到一个大分支上,其中安徽分离物、海南分离物共同聚类在一个小分支上,相对近缘,而与美国、巴西、印度、墨西哥、肯尼亚等其他国外分离物聚类到不同的分支,相对远缘(图4)。
表3 序列分析涉及CpMMV与其他相关香石竹潜隐病毒属成员的序列信息Tab.3 Sequence information of CpMMV and other member of Carlavirus used in the phylogenetic analysis
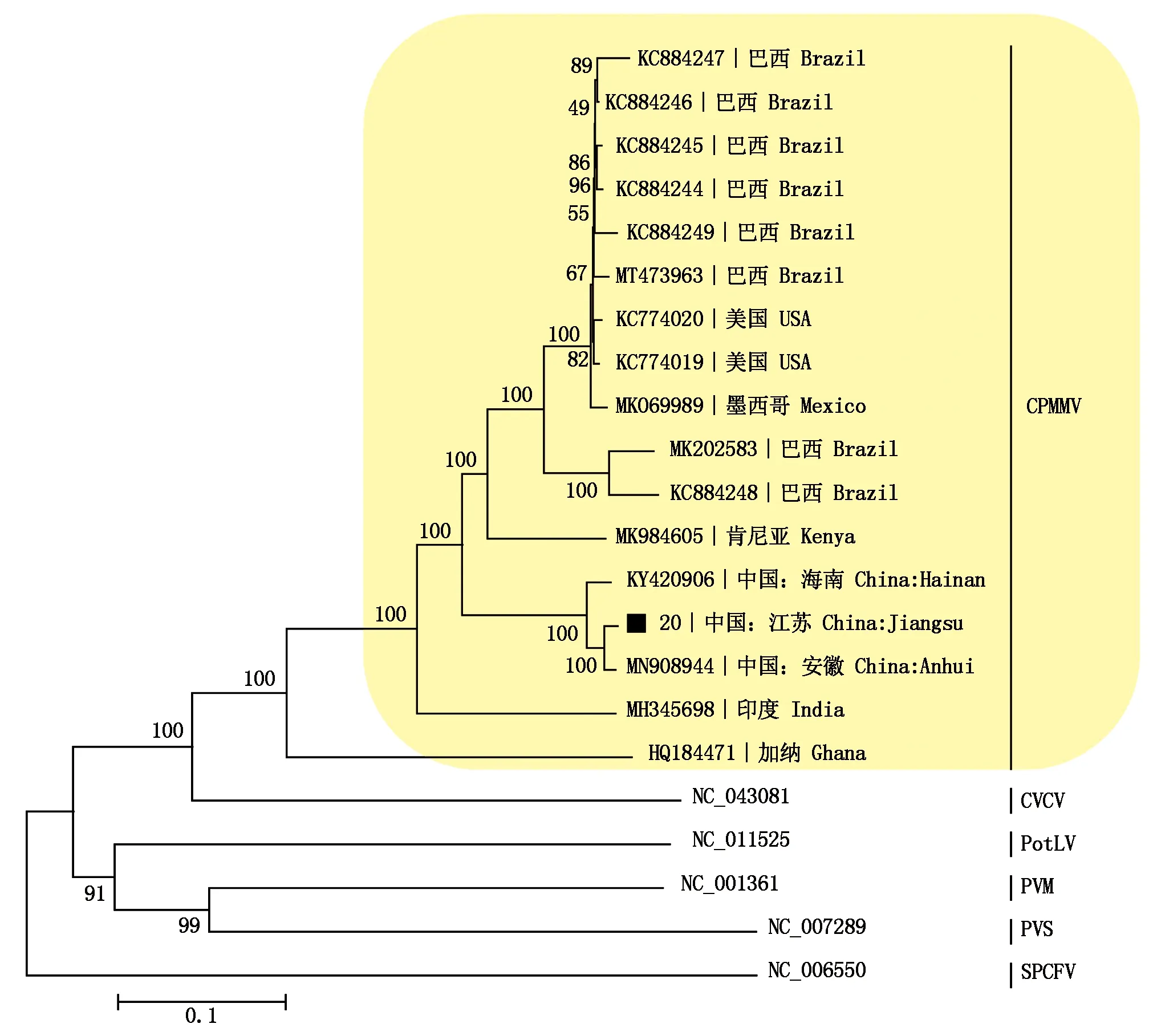
■.本试验测定的CpMMV分离物。■.Isolate of CpMMV sequenced in this study.
3 讨论
豇豆轻斑驳病毒是我国近年来新发生的一种植物病毒,主要侵染豆科等多种作物,导致作物出现叶片轻斑驳褪绿等症状,严重时会产生畸形、甚至坏死症状[24],造成豆科等作物减产10%~15%,而其他病毒与CpMMV共侵染会带来更严重的危害损失[1,11]。因此,应加强CpMMV在生产上的监测,预防其对我国作物安全生产造成进一步危害。
虽然世界各地已有多个CpMMV基因组相关报道[2,13],但目前在我国仅有海南[20]和安徽[21]2个分离物有基因组报道。本研究采用分段法克隆并获得了江苏CpMMV大豆分离物的基因组序列,明确了其基因组结构特征,同时通过聚类分析发现,其与我国其他2个分离物相对近缘,其中与安徽分离物同源性最高,这是江苏省第1个CpMMV基因组序列相关报道。这些结果将有助于丰富CpMMV分子变异和群体遗传学研究,为后续深入解析该病毒的流行及演化规律提供支持,同时对进一步研究其成灾病理和有针对性地制定防控策略也有重要意义。
CpMMV虽然早在1973年就有发生危害报道[5],但在我国,直到2009年(台湾地区:菜豆、豇豆)才首次出现危害[19],随后该病在江西(2013—2014年,四季豆)、海南(2016年,豇豆)[20]、安徽(2019年,大豆)[21]相继出现危害,从该病毒在我国的发生危害时间,结合部分地区基因组分析结果(目前,我国有基因组报道仅有海南分离物和安徽分离物),可以推测我国发生的CpMMV极有可能是从国外传入,最早在台湾地区发生,之后扩散到江西、海南,近年来陆续向北扩散到安徽、江苏等地。鉴于CpMMV是一种重要的粉虱传病毒,在多个国家和地区都有发生危害报道,同时CpMMV在豇豆、大豆、花生等[5]多种作物上有种子携带病毒报道,存在种传风险[4],因此,随着传播介体的大发生、各地种苗调运的频繁以及耕作模式的更迭,此类病毒的不断扩展蔓延将会对豆类等作物的安全生产带来新的威胁,而目前对该病毒的成灾机理、品种抗性、防控技术等研究还较少,因此,生产上要密切关注此类病害的发生动态,加强对产地种苗的检测,做好应急防控技术研究和储备,及早发现,尽早防控,减少损失。
