甘蓝型油菜BnaFIL基因启动子的克隆与表达分析
2022-07-11熊兴华
陈 静,胡 蓉,刘 勇,秦 艺,熊兴华
(湖南农业大学,作物基因工程湖南省重点实验室,湖南 长沙 410125)
甘蓝型油菜(Brassicanapus,AACC,2n=38)作为全球重要的油料作物之一,在我国广泛种植。在我国,油菜作为油料作物在生产中占有十分重要的位置,是我国第一大油料作物[1]。我国油菜产量大约占全世界总产值的1/3,油菜的种植面积和油菜产量都位居世界第一[2-3]。油菜种植面积占油料作物播种面积的1/2左右,油菜的产量占所有油料作物产量的2/5左右,但依旧不能满足国民对食用油的巨大需求。为缓解国内食用油的需求,60%左右的食用油需从国外进口油脂或油料。我国南方实行稻稻油三熟制,以提高植物油的产量、保证植物油的安全[4]。在我国油菜的主产区多以种植半冬性油菜为主,其生育期较长,与双季稻的生育期存在冲突,因此,选育出开花早的早熟品种油菜能够使油菜生育期缩短,对实行稻稻油三熟制起到至关重要的作用[5]。
适时开花以及花的形态发育不仅对甘蓝型油菜的产量与品质有重要影响,同时也决定了其对生态区域的适应性,因此,植株开花的早晚以及花的形态发育是甘蓝型油菜育种的重要目标性状[6-7]。油菜提前开花表明生育期会缩短,所以对甘蓝型油菜开花基因的调控机制进行研究有助于油菜早熟品种的选育,为油菜开花期、成熟期的遗传改良提供理论与实践依据。
FIL(FILAMENTOUS FLOWER)基因属于YABBY转录调节因子家族中的一个子家族成员[8],对其分生组织中心区域的非自主性影响是通过抑制分生组织的活性来调节的。在植物发育过程中,叶和花等侧生器官是由分生组织中的奠基细胞(Founder cells)分化发育而成。细胞确定分化成各器官的命运之后,侧生器官原基的发育一直受到分生组织中至今未知的信号调控。例如,用解剖方法或者激光切除方法将叶原基从分生组织中分离,将会得到辐射状对称的远轴化的叶片,表明这种控制叶片近轴化发育的信号来自分生组织[9]。相反地,分生组织的活性受侧生器官中的一个信号因子调控。有研究表明,拟南芥和金鱼草中的YABBY基因参与这种信号的调控[10-11]。
在拟南芥中,拟南芥fil单突变体会导致花器官成细丝状,以及花器官形态存在缺陷。Lugassi等[12]在拟南芥中研究发现,FIL基因中存在一个fil-9突变体,该突变体导致花器官的数量和大小出现了高度变异,部分出现同源化以及花序组织出现缺陷。Douglas等[13]对fil-10抑制系的遗传学和细胞学分析表明,FIL在促进生长方面的作用与它之前所描述的对分生组织特性和侧枝器官极性的影响无关,转录谱分析表明,FIL下调了大量转录因子,而这些转录因子又从属于花序结构的调控部分。Chung等[14]探究生长素反应因子与多效基因之间的互作关系时,发现与野生型拟南芥相比较,其他几个突变体ettarf4、fil-8、filettarf4、filettarf4old和filettarf4NPA均出现了花序异常的现象,fil的突变体花序均呈现出丝状结构,无法完成正常的授粉过程,以至于会影响到植株后期的正常发育。Bonaccorso等[15]将拟南芥中的4个YABBY家族基因在酵母中表达,发现只有FIL激活了报告基因。类似的分析表明,该基因是一种激活因子。同时有相关研究表明,FIL基因能够对开花时间进行调控,同时也可以维持和调控花序分生组织、花分生组织和花器官原生质体的发育[16]。Tanaka等[17]发现,在拟南芥与水稻之间FIL/TOB基因的分支YABBY基因的功能可能被保守,以维持植株分生组织的正常功能。
目前,对FIL基因的研究主要集中在拟南芥和其他植物,甘蓝型油菜BnaFIL基因的研究和报道还比较少,FIL基因在油菜中的具体作用还不够明确。本研究通过克隆BnaFIL基因的启动子并构建表达载体,将构建好的表达载体转入拟南芥中并对转基因植株进行分析,以期为进一步研究甘蓝型油菜BnaFIL基因功能提供依据。
1 材料和方法
1.1 试验材料
本研究所用的12份甘蓝型油菜包括6份早花材料、6份晚花材料,均由国家油料改良中心湖南分中心提供。野生型拟南芥(Arabidopsisthaliana)、大肠杆菌(Escherichiacoli)DH5α菌株、农杆菌(Agrobacteriumtumefaciens)GV3101菌株及植物表达载体pBI121均由湖南农业大学作物基因工程湖南省重点实验室提供。
限制性内切酶ScaⅠ、BamHⅠ、DL2000 DNA Marker、Trans 5k DNA Marker、抗生素、dNTP、高保真聚合酶等购自北京全式金;pUCm-T克隆载体、T4DNA连接酶、DNA质粒提取试剂盒、胶回收试剂盒、利福平抗生素、卡那霉素、GUS染色剂、琼脂糖等购自生工生物工程(上海)股份有限公司;引物合成和测序由湖南擎科生物技术有限公司完成。
1.2 甘蓝型油菜BnaFIL基因启动子克隆及分析
在TAIR数据库中查找到拟南芥AtFIL基因的ID(AT2G45190),用拟南芥AtFIL基因的ID在Brassica Database数据库中Blast,得到甘蓝型油菜中BnaFIL基因上游的大约1 300 bp序列信息,用Primer 5.0设计引物,分别命名为BnaFIL-P-F和BnaFIL-P-R(表1)。
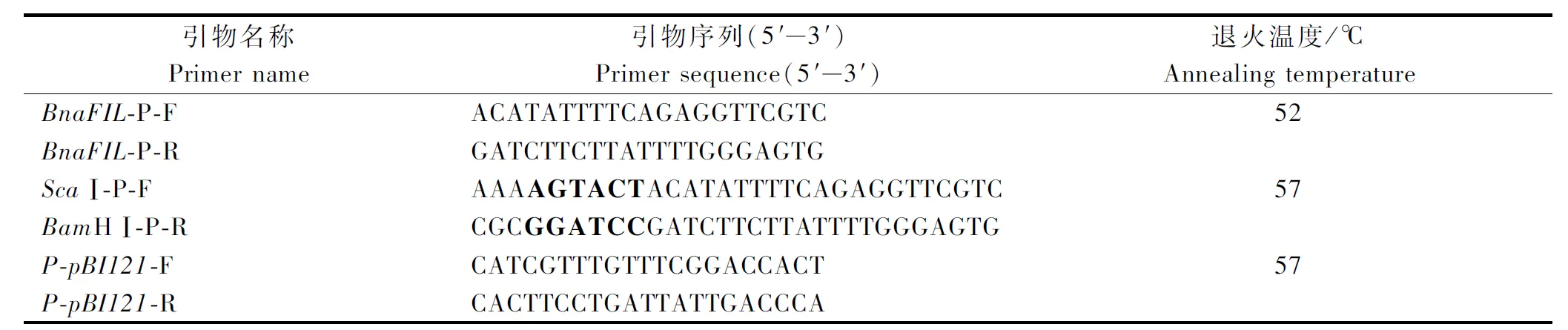
表1 引物序列Tab.1 The primer sequences
以甘蓝型油菜叶片中提取的DNA为模板,用BnaFIL-P-F和BnaFIL-P-R特异性引物进行PCR扩增。PCR反应体系(50 μL):DNA模板1 μL(1 054.2 ng/μL),2.5 mmol/L dNTP 4 μL,上游引物1 μL(10 μmol/L),下游引物1 μL(10 μmol/L),10×TransTaq HiFi Buffer 5 μL,TransTaq HiFi DNA Polymerase 1 μL,ddH2O 37 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸1.5 min,共35个循环;72 ℃再延伸10 min。PCR扩增结束后,经1%琼脂糖凝胶电泳对产物进行检测,采用胶回收试剂盒对pBnaFIL片段进行回收,回收后的目的片段利用T4DNA连接酶连接到pUCm-T克隆载体,热激法转化大肠杆菌DH5α感受态。经菌落PCR鉴定后送擎科生物技术有限公司测序。测序结果利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare)在线分析软件对序列进行顺式作用元件预测。
1.3 表达载体构建
将带pBnaFIL片段的菌种进行扩繁并提取质粒,以该质粒为模板,在原有的启动子扩增引物上加入限制性内切酶ScaⅠ、BamHⅠ的酶切位点(表1中加粗字母)以及相应的保护碱基对启动子进行PCR扩增,引物序列见表1。PCR反应体系(50 μL):DNA模板1 μL(1 054.2 ng/μL),2.5 mmol/L dNTP 4 μL,上游引物1 μL(10 μmol/L),下游引物1 μL,10×TransTaq HiFi Buffer 5 μL,TransTaq HiFi DNA Polymerase 1 μL,ddH2O 37 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸1.5 min,共35个循环;72 ℃再延伸10 min。PCR扩增结束后,经1%琼脂糖凝胶电泳对产物进行检测,采用胶回收试剂盒对目的片段进行回收,回收后的目的片段利用T4DNA连接酶连接到pUCm-T克隆载体,热激法转化大肠杆菌DH5α感受态。经菌落PCR鉴定后提取质粒,同时对pBI121载体质粒进行提取。
分别用内切酶FlyCutScaⅠ和FlyCutBamH Ⅰ对目的片段质粒和pBI121载体进行双酶切,酶切体系(50 μL):质粒10 μL(986.71 mg/μL),FlyCutScaⅠ1 μL,FlyCutBamHⅠ1 μL,10×FlyCut Buffer 5 μL,ddH2O 33 μL。37 ℃孵育3 h,终止反应时80 ℃加热20 min。回收酶切后的目的片段,用pBnaFIL启动子替换pBI121载体上的CaMV35S启动子,采用T4DNA连接酶构建pBnaFIL-GUS表达载体。将重组质粒通过热激法转入大肠杆菌中,在含有卡那霉素(50 mg/mL)的LB培养基上过夜培养,挑取单菌落进行菌落PCR鉴定,提取阳性菌株的质粒进行双酶切鉴定。
采用冻融法将pBnaFIL-GUS表达载体转入农杆菌GV3101感受态,将其涂布在含有卡那霉素(50 mg/mL)和利福平(25 mg/mL)的YEB培养基上28 ℃培养2~3 d。挑取单菌落进行PCR鉴定,鉴定引物如表1所示,阳性菌落保存于-80 ℃。
1.4 启动子表达分析
1.4.1 野生型拟南芥的种植 拟南芥种子消毒:取适量野生型拟南芥种子(不超过50 μL)放入1.5 mL/2.0 mL离心管中,加入75%的酒精1 mL涡旋1 min,用灭菌水清洗1次,加入10%的次氯酸钠1 mL,期间不断振荡消毒10 min,最后用灭菌水清洗6~7次。在洗好的种子中加入0.1%琼脂糖水1 mL混匀,将混匀的种子均匀铺洒在1/2 MS培养基上,密封后置于4 ℃冰箱春化2~3 d。
拟南芥的培养:将春化后的种子放置于植物生长培养箱,温度设置在22~24 ℃,光周期设置在16~18 h,光照强度2 000 lx,以保证拟南芥正常生长。培养7 d左右将野生型拟南芥幼苗移栽至人工土生长,每天观察其生长状态,7 d浇一次水,每次都将土完全浇透。移栽后1个月植株开始抽薹,将抽薹出的第1个花序从基部剪去,以便长出更多分枝。待分枝花序长至茂盛就可以进行花序浸染。
1.4.2 农杆菌菌液准备 将含有重组质粒的土壤农杆菌菌株接种到含有卡那霉素(50 mg/mL)和利福平抗生素(25 mg/mL)的YEB培养基上,28 ℃暗培养2 d。挑取单菌落于5 mL含有卡那霉素(50 mg/mL)和利福平抗生素(25 mg/mL)的YEB液体培养基中,28 ℃暗环境振荡48 h。按照1∶50的比例吸取1 mL的菌液至50 mL含有卡那霉素和利福平抗生素的YEB液体培养基中,28 ℃振荡培养至菌液 OD600=1.8~2.0时,6 000 r/min离心10 min收集菌体。在菌体中加入100 mL浸染缓冲液,振荡混匀使菌体充分悬浮在缓冲液中。
1.4.3 拟南芥花序浸染 将培养好的野生型拟南芥剪去花序上已结的角果,前一天晚上将野生型拟南芥浇水浸透。次日,将花序浸入提前配好的浸染液中1 min左右,为保持湿度每株拟南芥都套上袋子,置于暗培养箱中培养过夜,再将其置于光照培养箱中正常培养。第1次浸染后的第5天再次对植株进行浸染,共浸染2次。收取种子经过多代抗性筛选直至直系纯合,对纯合植株进行GUS染色。
1.4.4 GUS染色 用DMSO将X-Gluc配成20 mmol/L的母液,每管50 μL分装,置于-20 ℃保存备用。然后称取Na2HPO4·12H2O 17.9 g,NaH2PO4·2H2O 7.8 g,Na2EDTA 3.72 g,铁氰化钾0.165 g,亚铁氰化钾0.221 g,Trition-100 1 mL配成1 L X-Gluc基液(50 mmol/L PBS pH=7.0)。GUS染色液由50 μL X-Gluc母液和450 μL X-Gluc基液组成。脱色液由冰醋酸和无水乙醇3∶1混合组成。
将准备好的材料于GUS染色液中浸泡,25~37 ℃保温过夜。所有绿色材料在75%酒精中脱色2~3次,直至阴性对照呈白色。肉眼观察或显微镜下观察,白色背景上出现蓝色小点区域即为GUS的表达位点。利用体视显微镜观察拍照。
2 结果与分析
2.1BnaFIL基因启动子的克隆与顺式作用元件预测
根据数据库获得的甘蓝型油菜BnaFIL基因的启动子序列设计特异性引物,以含有全长启动子序列的质粒为模板经PCR扩增获得1 326 bp的启动子序列(图1)。通过T4连接酶连接并转化大肠杆菌获得pT-Promoter克隆载体。对启动子序列进行比对分析,结果显示,在早花材料与晚花材料启动子之间存在SNP位点,1号位点早花材料为A碱基,晚花材料为G碱基,2号位点早花材料为C碱基,晚花材料为T碱基,且其他碱基基本一致(图2)。利用PlantCARE软件对启动序列进行启动子顺式作用元件分析发现,该序列上包含多种顺式作用元件(表2),包括参与光响应的部分保守DNA模块、核心启动子必备元件TATA-BOX和CAAT-BOX等,大部分元件都位于启动子1—500 bp(图2),由此可以推断,启动子的主要功能区位于1—500 bp。
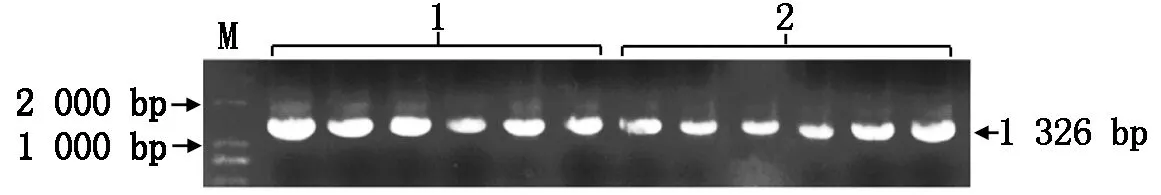
1.晚花材料;2.早花材料;M.DL2000 Marker。图3同。1.Late flower material;2.Early flower material;M.DL2000 Marker.The same as Fig.3.
1,2.SNP位点。1,2.SNP sites.

表2 启动子元件Tab.2 Promoter elements
2.2BnaFIL基因启动子表达载体构建
早花材料与晚花材料经过序列比对和顺式作用元件分析,在早花材料和晚花材料中各选取1个材料启动子序列进行启动子的表达载体构建。采用表1中含有酶切位点和保护碱基的引物ScaⅠ-P-F/BamHⅠ-P-R对启动子进行克隆,使扩增得到的片段带有酶切位点和保护碱基方便后续的酶切,扩增得到的目的条带为1 344 bp(图3)。将PCR扩增得到的目的条带进行胶回收后连接pUCm-T载体,转化大肠杆菌感受态,经过菌落PCR鉴定获得阳性菌落,摇菌提质粒,质粒保存备用。

图3 启动子扩增Fig.3 Promoter amplification
对启动子质粒用内切酶FlyCutScaⅠ和FlyCutBamHⅠ进行双酶切,回收目的片段连接至同样用内切酶FlyCutScaⅠ和FlyCutBamHⅠ进行双酶切切除CaMV35S启动子的pBI121载体(含GUS表达基因)回收的大片段上,经T4连接酶连接转入大肠杆菌感受态保存(图4)。从大肠杆菌中提取阳性质粒,经内切酶FlyCutScaⅠ和FlyCutBamHⅠ双酶切电泳检测,得到目的片段和pBI121载体片段证明pBnaFIL-pBI121植物表达载体构建成功(图5)。
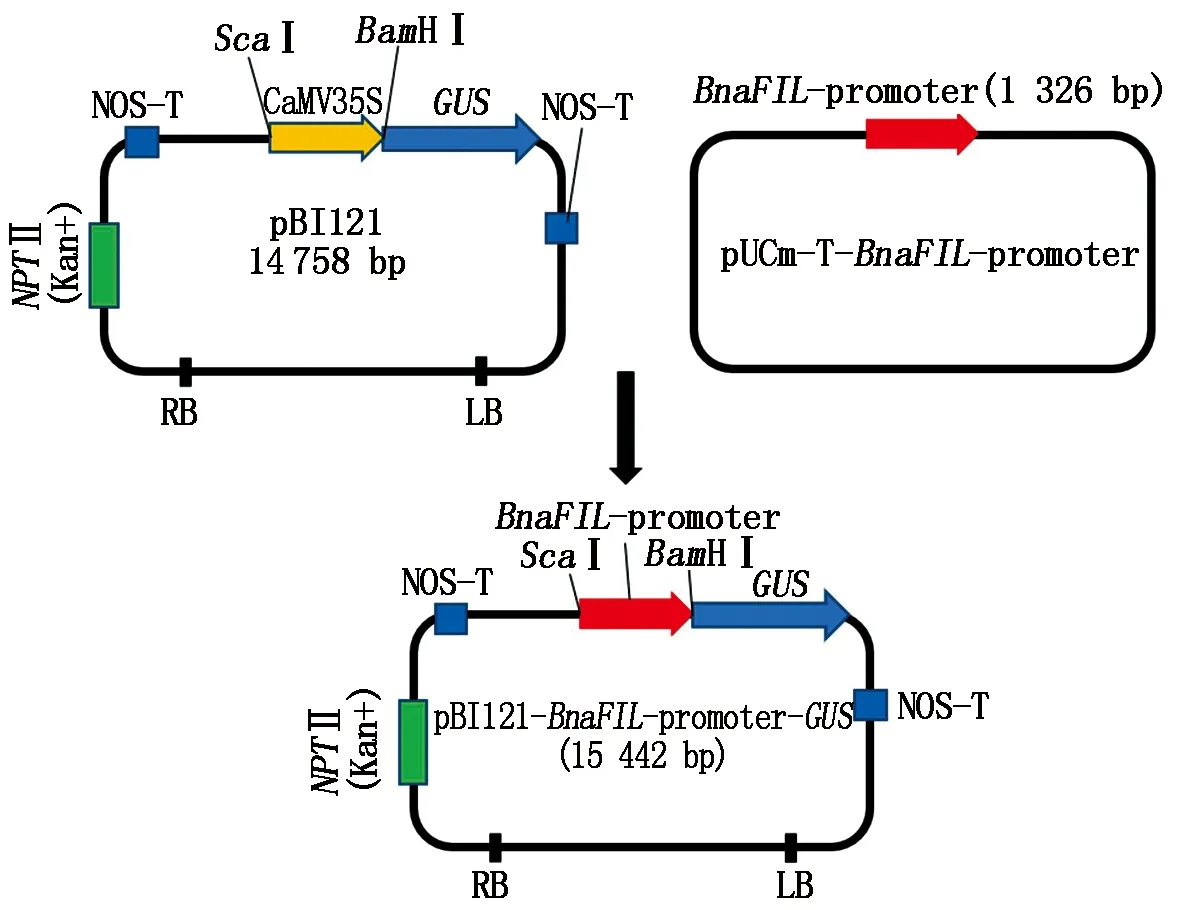
图4 植物表达载体构建过程Fig.4 Flow chart for construction of the plant expression vector
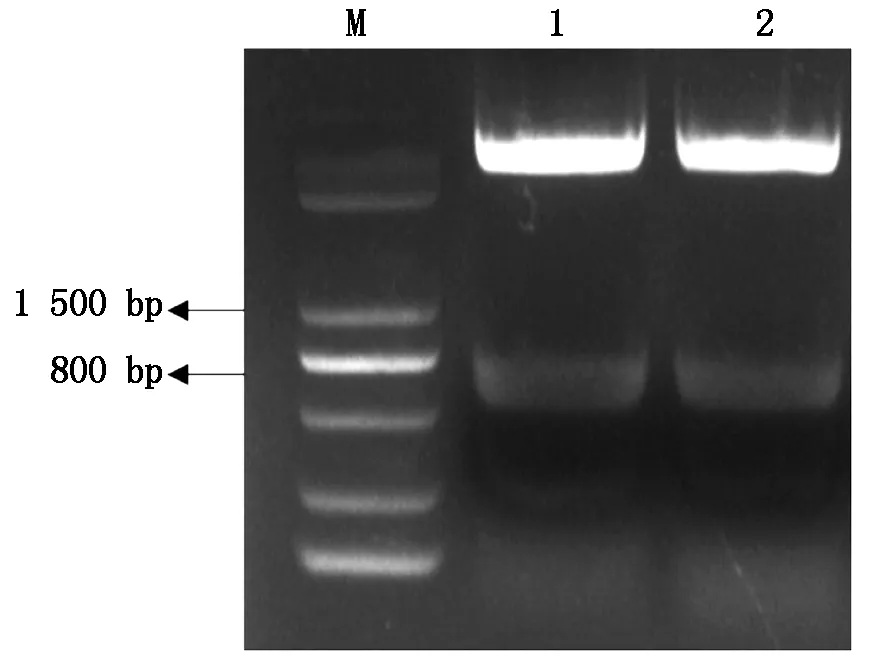
1.晚花材料重组质粒;2.早花材料重组质粒;M.Trans 5k DNA Marker。1.Recombinant plasmid of late flowering material;2.Recombinant plasmid of early flower material;M.Trans 5k DNA Marker.
将重组质粒转入农杆菌进行培养,随机挑选转入重组质粒的农杆菌单菌落进行菌落PCR鉴定,扩增出一条878 bp的目的条带(图6),表明BnaFIL启动子双元表达载体成功转入农杆菌GV3101。
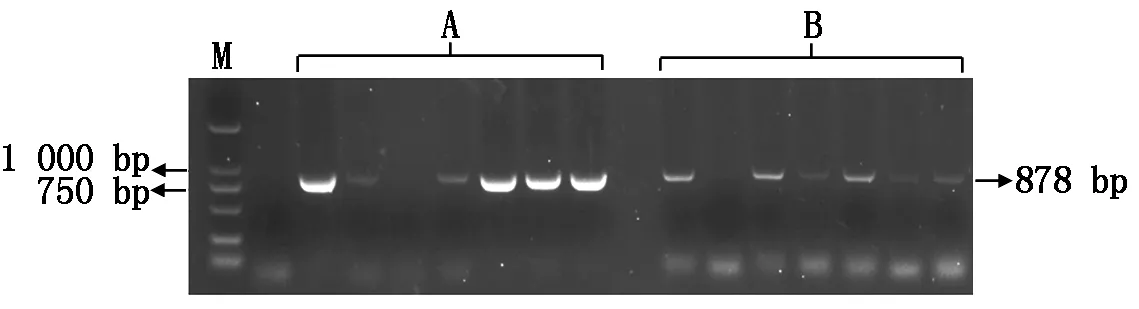
A.转早花启动子菌落PCR;B.转晚花启动子菌落PCR;M.DL2000 Marker。A.Transforming early flowering promoter colony PCR;B.Transforming late flowering promoter colony PCR;M.DL2000 Marker.
2.3BnaFIL基因启动子表达分析
将含有重组质粒的土壤农杆菌采用花序浸染法转化至野生型拟南芥植株中,转化植株置于植物生长培养箱中正常培养至收获到T0种子。将T0种子消毒后播撒在含有卡那霉素抗性的1/2 MS培养基上筛选出阳性植株。在筛选过程中阳性幼苗表现为主根和侧根均正常生长发育,阴性幼苗表现出发育迟缓且根部无法正常生长,不形成侧根。移栽时选取主根和侧根生长发育均正常的阳性苗,取幼苗时用镊子缓缓将幼苗从培养基中拔出,用无菌水清洗幼苗根部的培养基,移入灭菌的人工土,置于植物生长培养箱中正常培养。待T1拟南芥植株长至抽薹时,每株取少量叶片提取拟南芥总DNA鉴定是否为阳性植株。鉴定出3株转早花重组质粒阳性植株,5株转晚花重组质粒阳性植株(图7)。
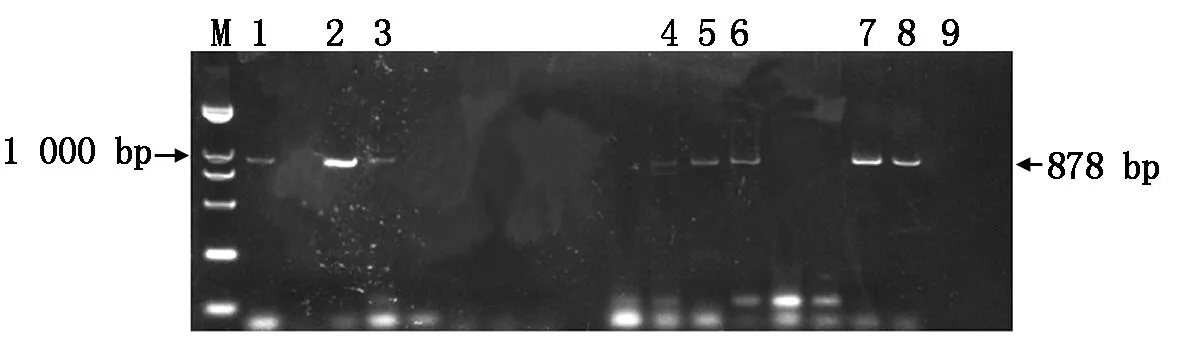
1—3.早花重组质粒抗性苗;4—8.晚花重组质粒抗性苗;9.野生型拟南芥。1—3.Early-flowering recombinant plasmid resistant seedlings;4—8.Late-flowering recombinant plasmid resistant seedlings;9.Wild type Arabidopsis thaliana.
收取T1植株种子,通过上述相同方法对T2植株进行阳性筛选,最终得到T2种子,T2种子采取单株收种。继续对T2种子进行检测至株系纯合。
将转基因拟南芥纯合株系的种子播种在含有卡那霉素抗性的1/2 MS培养基上,选取长势良好发育正常的拟南芥幼苗进行GUS染色。染色后发现转基因拟南芥幼苗GUS基因主要在根茎中表达。含有晚花启动子重组质粒的拟南芥幼苗GUS基因染色程度较浅,因此,晚花启动子在苗期表达量较小;含有早花启动子重组质粒的拟南芥幼苗GUS基因染色程度较深,因此,早花材料启动子在苗期表达量较大;在野生型拟南芥中GUS基因不表达;pBI121载体转染的拟南芥GUS基因全株表达(图8)。
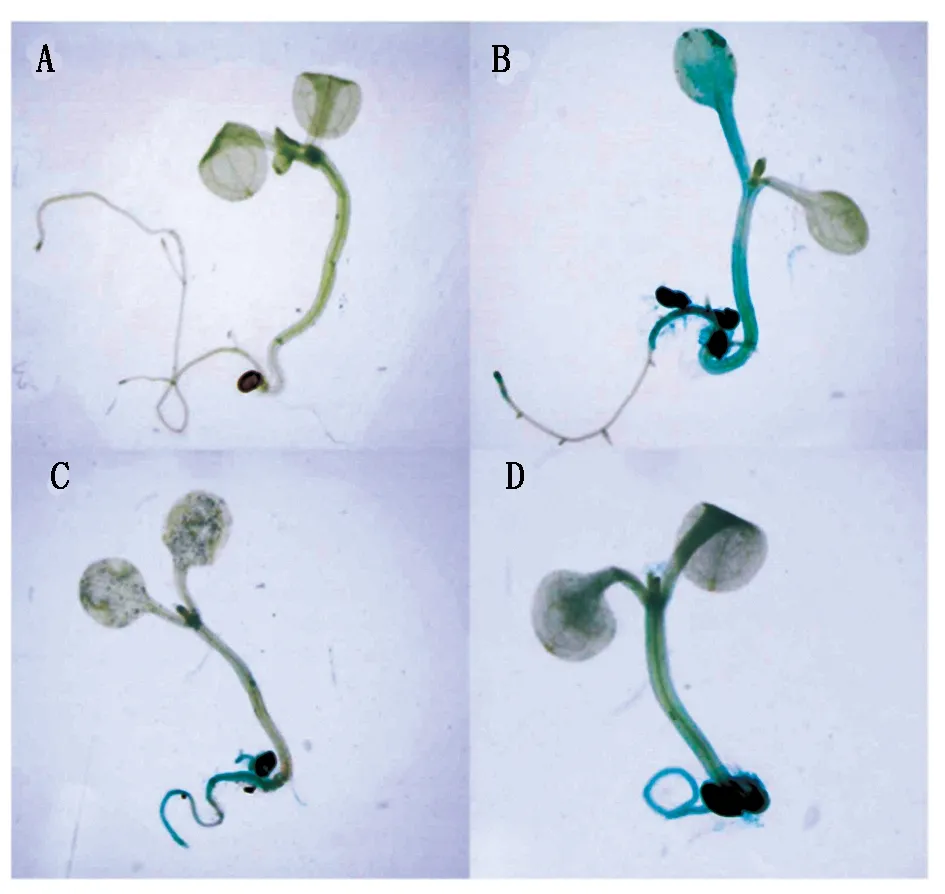
A.野生型拟南芥;B.含pBI121载体拟南芥;C.含晚花启动子重组质粒的转基因拟南芥;D.含早花启动子重组质粒的转基因拟南芥。
3 结论与讨论
在基因表达调控中基因启动子中的顺式作用元件起着重要作用,基因中不同的启动子特征决定了启动子驱动基因不同的表达特征[18]。开花对植物而言是生长发育过程中最为重要的阶段之一,植物开花也就意味着植物从营养生长向生殖生长过渡[19]。对油菜开花基因的研究能够更好地了解油菜发育过程,为提高油菜产量提供理论依据。
本研究克隆了BnaFIL基因启动子序列,并对该序列进行了启动子顺式作用元件分析,结果显示,在早花材料和晚花材料中启动子的顺式作用元件都相同,但是不同开花时期的材料还是存在SNP位点;启动子序列中包含了参与光响应的部分保守DNA模块、核心启动子必备元件TATA-BOX和CAAT-BOX、与分生组织表达有关的顺式作用的调控元件CAT-BOX以及光敏反应元件,由此推断,该启动子的表达受光照的影响较大,该启动子还含有与分生组织表达相关的顺式作用元件,也可推测,该启动子对油菜开花相关的分生组织有相应影响。由于该基因的启动子反应元件以及SNP位点主要集中在1 300 bp以内,因此,试验主要以长度为1 300 bp的启动子进行研究。为了进一步探究BnaFIL基因启动子序列上的SNP位点是否对BnaFIL基因的驱动有影响,本研究构建了BnaFIL基因启动子表达载体pBnaFIL-pBI121,鉴定结果表明,表达载体成功转入土壤农杆菌GV3101,为下一步试验奠定了良好的基础。
目前,国内外有关FIL基因对开花时期的研究还较少,但对FIL基因所属的YABBY家族研究较多。YABBY基因主要调控植物的开花以及侧枝发育等[20-22]。本研究通过构建BnaFIL基因启动子表达载体,将载体通过农杆菌花序浸染的方法成功转入拟南芥中,获得了早花启动子重组质粒阳性转基因株系和晚花启动子重组质粒阳性转基因株系。之后利用GUS基因染色的特性,对启动子的表达效果进行了检测,最终在不同的转基因拟南芥植株中均发现了GUS基因的表达,从而可以断定早花材料启动子的驱动基因表达的效果比晚花材料启动子的驱动效果要好。该结论进一步验证了早花材料中BnaFIL基因的表达量较晚花材料中BnaFIL基因的表达量更高。由于BnaFIL基因中的SNP位点位于内含子上,内含子不参与蛋白质的编码,因此,对该基因启动子上的SNP进行研究,且结果显示早花材料与晚花材料中启动子的表达效果存在一定差异,由此推断,该基因在不同材料中的表达可能是由于启动子的驱动效果决定的,从而对油菜开花早晚进行调控。
