外源水杨酸对高温胁迫下菜豆种子萌发的影响
2022-07-11刘大军冯国军杨晓旭
秦 尧,刘 畅,刘大军,冯国军,杨晓旭
(黑龙江大学现代农业与生态环境学院,哈尔滨 150000)
0 引言
作物生长过程中的温度胁迫是造成作物减产的重要因素,且在整个生长过程中,种子最先受到不利影响[1]。高温对植物几个重要的生理过程产生负面影响。首先,高温下植物体内的反应性氧物质(ROS)的含量会上升,对植物膜、蛋白质和其他大分子有害[2]。其次,高温影响了植物的光合作用,降低了植物体内的光合色素含量[3],破坏了光合作用所需的质膜系统[4-5],降低了反应所需酶的活性[6],抑制了植物的碳同化反应[7]。同时,高温会破坏植物的源库关系,从而影响有机物质的运输与积累[8-9]。高温同样会对植物的呼吸作用产生影响,主要是通过影响呼吸酶的活性和质膜的完整性来影响的。
通过稳定膜结构、稳定生物大分子物质以及与植物激素和其他代谢途径相互作用能够缓解植物在逆境条件下的不利影响。水杨酸具有较强的活性氧(ROS)清除能力,在植物遭遇逆境时可以提高作物在干旱、盐碱、高温、重金属等非生物胁迫下的抵抗力,从而减少作物因突发逆境而造成的减产以及生物量的损失[10]。前人研究已表明水杨酸作为一种植物激素参与了高等植物对温度胁迫的响应[11],但对于不同的植物类型、不同的品种及不同的胁迫程度其作用效果不一[12-14]。靳路真等[15]发现高温下大豆叶片中的各项营养物质含量均呈下降趋势,且抗氧化系统启动,MDA含量增高,正常的生长受到抑制。王维领的研究发现外源SA能显著提高高温胁迫下小麦叶片中抗氧化物酶的活性,降低叶片中的H2O2、MDA的含量,减弱膜脂过氧化反应提高小麦的抗高温胁迫的能力[16]。Kakon等[17]研究发现高温提早了菜豆的花期,但随着温度的升高,菜豆的产量和产量品质逐渐下降。王栋麟[18]对高温下的金花菜生长的研究发现高温下对照组金花菜的生长受到抑制,而外施水杨酸能提高抗氧化系统酶的活性,有效缓解高温对金花菜的抑制作用。陈贵华等[19-20]研究发现外源水杨酸能有效促进陈旧菜豆、茄子种子的萌发,且在低浓度范围内成正相关上升。
菜豆(Phaseolus vulgaris.L),豆科菜豆属,又名四季豆、芸豆等,为一年生草本植物,富含包括赖氨酸、纤维素及抗性淀粉在内的多种营养物质,是中国重要的豆类蔬菜作物之一[21-22]。菜豆喜温但不耐高温,其种子的最适发芽温度为25℃,低于此温度或高于此温度都会抑制菜豆种子的萌发[23]。随着温室效应和设施农业的发展,研究菜豆高温危害生理与防御技术是近年菜豆研究的重要课题。研究发现,适宜浓度的甜菜碱与谷胱甘肽预处理,均可以有效降低菜豆幼苗在高温胁迫下的丙二醛含量,提高可溶性蛋白含量与保护酶活性,对高温胁迫具有明显的缓解作用[24]。目前,关于SA对菜豆在高温胁迫下的研究较少,笔者选用耐热性较强的‘A18’菜豆种子为试验材料,研究其经不同浓度SA处理后在高温下的生理生化指标的变化规律,明确外源SA对高温胁迫下菜豆种子抗性的影响,以期提高菜豆的耐热性,解决夏季生产和温室生产中出现的实际问题,实现东北菜豆种植资源的温带推广,为防御菜豆高温危害提供理论依据。
1 材料与方法
1.1 试验时间及地点
试验于2020年8—9月于黑龙江大学现代农业与生态环境学院园艺植物生理实验室进行。
1.2 试验材料
试验材料为大小一致、成熟饱满的矮生菜豆品种‘A18’种子。所有参试种子均先用0.1%的升汞消毒3 min,再用蒸馏水冲洗3次,每培养皿中放置30粒种子。
1.3 试验方法
1.3.1 发芽试验 试验设置2个对照组(CK1、CK2)、4个处理组(T1、T2、T3、T4)。
①常温对照CK1:将种子于清水中浸泡6 h后取出,蒸馏水冲洗3次,滤纸吸干水分,置于放有两层滤纸的培养皿中,加入30 mL蒸馏水,放置于25℃培养箱中暗培养。
②高温对照CK2:将种子于清水中浸泡6 h后取出,蒸馏水冲洗3次,滤纸吸干水分,置于放有两层滤纸的培养皿中,加入30 mL蒸馏水,放置于33℃培养箱中暗培养。
高温处理组(T1~4):将种子分别于T1(0.005mmol/L)、T2(0.01 mmol/L)、T3(0.05 mmol/L)、T4(0.1 mmol/L)4个浓度的SA溶液中浸泡6 h后取出,蒸馏水冲洗3次,滤纸吸干水分,分别置于放有2层滤纸的培养皿中,加入30 mL蒸馏水,放置于33℃培养箱中暗培养。
每组设置3次重复。以胚根伸出种皮2 mm作为发芽标志,统计5天内每天的发芽数,并在第5天测量胚根长度。计算发芽率、发芽指数和活力指数。
1.3.2 生理试验 种子处理及培养方法与发芽实验相同。
于24、48 h后分别挑选生长状态比较一致的种子,去除种皮后取子叶的部分进行生理指标的测定。
SOD活性测定参照NBT(氮蓝四唑)法[25];可溶性蛋白含量的测定参考考马斯亮蓝法[26];MDA含量测定参考硫代巴比妥酸比色法[27];O2-.产生速率测定参照Elstner and Heupel的方法[28]。
1.4 数据处理
所有测定指标均取3次重复的平均值,绘图采用Excel,差异显著性检验采用SPSS 20进行。
2 结果与分析
2.1 SA浸种对高温下菜豆种子发芽的影响
从表1可知,高温下,不同外源SA浓度处理对于菜豆种子的发芽率、发芽指数、种子活力指数全部均存在显著性(P<0.05)差异。与CK1相比,高温下菜豆种子的发芽率、发芽指数及种子活力指数分别下降41.94%、38.53%及62.13%,差异显著。这说明菜豆在种子萌发阶段遇到高温条件,其萌发会受到显著抑制。

表1 SA浸种对高温下菜豆种子发芽的影响
经各浓度SA浸种处理的菜豆种子在高温下的萌发情况也存在显著差异。其中,浓度T1、T2组各项指标较CK2均得到提高,但仍低于CK1,且T2组处理指标均高于T1,T2组较CK2其发芽率、发芽指数及种子活力指数分别上升41.18%、29.83%及67.04%,说明0.005~0.01 mmol/L浓度SA处理能对热胁迫有一定的缓解作用;T3、T4组的各项指标与CK2相比均有下降,且与浓度呈反比趋势,说明0.05~0.1 mmol/L的水杨酸对菜豆种子的萌发产生抑制作用。综上,适宜浓度的水杨酸可以缓解高温对菜豆种子萌发的不利影响,提高其在高温下的发芽率;与其他浓度相比,0.01 mmol/L的外源SA处理更佳,且高于0.05 mmol/L的SA处理使菜豆的生长受到抑制。
2.2 高温对菜豆种子萌发生理的影响
从图1~4中可以看出,与CK1相比,高温下菜豆种子中的超氧化物歧化酶SOD的酶活性在24 h和48 h分别下降15.12%、14.35%,差异显著;高温下菜豆种子中的活性氧含量、丙二醛及可溶性蛋白的含量均有增加,其中,与CK1相比,CK2组的活性氧产生速率在24 h和48 h分别高出39.62%、48.15%,丙二醛含量在24 h和48 h分别高出143.12%、98.16%,可溶性蛋白的含量在24 h和48 h分别高出23.87%、22.95%。由此可见,高温显著抑制了菜豆种子正常的生理活动,对菜豆种子萌发有显著的抑制作用。

图1 高温对菜豆种子中可溶性蛋白含量的影响

图2 高温对菜豆种子中SOD酶活性的影响
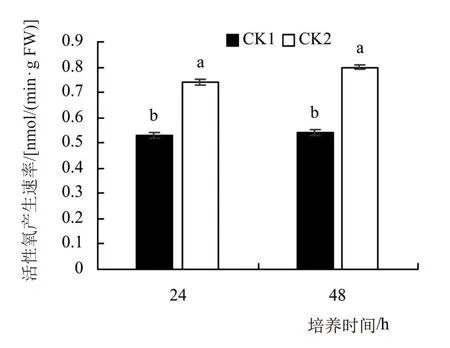
图3 高温对菜豆种子中活性氧产生速率的影响

图4 高温对菜豆种子中MDA含量的影响
2.3 SA浸种对高温下菜豆种子超氧化物歧化酶(SOD)活性的影响
由图5可看出,与高温对照相比,T1~4处理组菜豆种子中的SOD活性均存在差异,其中24 h时,T1、T2 之间差异不显著,CK2、T3、T4组间差异不显著,但T2与CK2、T3、T4之间差异显著。48 h时,T2与CK2、T3、T4之间依旧差异显著。

图5 SA浸种对高温下菜豆种子SOD活性的影响
与CK2相比,T3、T4浓度的SA处理后SOD活性受到抑制,且在24 h时分别下降3.19%、5.17%,在48 h时分别下降3.27%、9.24%;;T1及T2浓度外源SA处理后其SOD活性较CK2相比有显著上升,在24 h时分别增加6.58%、13.07%,在48 h时分别增加7.02%、11.54%。这说明适宜浓度的水杨酸可以通过提高SOD酶活性来缓解高温在菜豆种子发芽过程中的热害。
2.4 SA浸种对高温下菜豆种子中可溶性蛋白含量的影响
可溶性蛋白为重要的渗透调节物质和营养物质,他们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用。由图6可看出,在24 h时,对照组CK2及T1~4处理组菜豆种子中的可溶性蛋白含量均存在显著差异;在48 h时,对照组CK2与T1、T2、T4组存在显著差异,但CK2与T3组之间差异不显著。
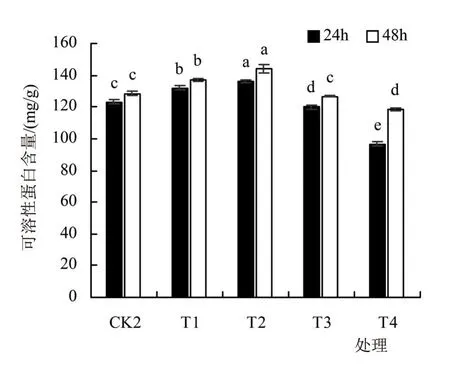
图6 SA浸种对高温下菜豆种子中可溶性蛋白含量的影响
各处理组与CK2相比,T3、T4组的可溶性蛋白含量均有所下降,且在24 h时分别下降2.77%、21.59%,在48 h时分别下降1.33%、7.51%;T1、T2组可溶性蛋白含量较对照组CK2均有显著上升,在24 h时分别上升7.01%、10.29%,在48 h时分别上升6.48%、11.91%。这说明适宜浓度的水杨酸可以通过提高菜豆种子中的可溶性蛋白含量来缓解高温在菜豆种子发芽过程中的热害。
2.5 SA浸种对高温下菜豆种子活性氧产生速率的影响
研究发现,高温条件导致菜豆种子中O2-产生速率加快,且差异显著。
由图7可看出,在24 h和48 h时,高温对照组CK2及T1~4处理组菜豆种子中的活性氧产生速率均存在显著差异。其中与CK2相比,T3、T4组的活性氧产生速率显著增加,且在24 h时分别上升9.46%、22.97%,在48 h时分别上升1.25%、8.75%;T1、T2组的活性氧产生速率显著低于CK2组,且在24 h时分别下降9.46%、13.51%,在48 h时分别下降11.25%、17.5%。这说明适宜浓度的水杨酸可以降低活性氧的产生速率,缓解高温下菜豆种子发芽过程中的热害。

图7 SA浸种对高温下菜豆种子活性氧产生速率的影响
2.6 SA浸种对高温下菜豆种子丙二醛(MDA)含量的影响
研究发现,高温条件导致菜豆种子中的丙二醛(MDA)含量累积(见图8),其中24 h时,T4与其他组相比差异显著,CK2与T3之间、T2与T1之间都存在差异,但不显著;48 h时,T4、T3、CK2之间差异显著,但T2与T1之间存在不显著的差异。

图8 SA浸种对高温下菜豆种子中丙二醛含量的影响
与高温对照CK2相比,T3、T4组的MDA含量显著上升,且在24 h时分别上升3.77%、23.77%,在48 h时分别上升16.03%、33.88%;T1、T2组在24 h与48 h时的MDA含量均显著低于高温对照CK2,在24 h时分别降低33.96%、38.49%,在48 h时分别下降24.04%、31.69%。这说明适宜浓度的水杨酸能够降低菜豆种子中MDA的含量,降低细胞质膜的损伤,缓解热胁迫。
3 讨论
研究表明,水杨酸(SA)在多种逆境条件下均能增强植物抗逆性,且其本身也参与植物的重要生理过程,能调控植物的正常生长[29-30]。本研究中,高温抑制了菜豆种子的萌发,这种不利的影响能够通过添加适宜浓度的SA的到缓解,这一结果与前人在辣椒[31]、蝴蝶兰[32]、金线兰[33]、水稻[34]等作物上施用水杨酸缓解逆境胁迫的结果和结论一致。本研究中,与常温相比,高温下菜豆种子内的O2-·物质和MDA含量均显著升高,这说明高温胁迫使种子中活性氧物质累积,使种子内细胞的膜结构受到破坏,给种子带来较强的氧化损伤,降低种子的活力。SOD作为植物体内抗氧化系统的第一道防线,能将 O2-·歧化为 O2和 H2O2,减轻 O2-·对细胞的伤害。本研究中,SA溶液浸种提高了菜豆种子的SOD活性,从而将过量的O2-·迅速分解为O2和H2O2,减少了菜豆种子中的O2-·及MDA降低了种子在高温下受到的损伤,这与李同根、张凤姣在皖贝母和金莲花中的研究结果也相一致[35-36],这说明外源水杨酸也可以提高超氧化物歧化酶的活性来提高菜豆种子对高温胁迫的抗性。
可溶性蛋白对种子萌发也很重要,其含量增加不仅能够使种子保持较低的渗透势,利于种子吸水萌发,而且会增强种子对逆境的适应能力。本研究中,高温下对照组菜豆种子中的可溶性蛋白含量较常温对照相比增多,而适宜浓度水杨酸处理又大大提高种子中可溶性蛋白的含量,这与其他作物得出的结果相一致[37]。高温胁迫条件下,菜豆种子中可溶性蛋白含量增加,一方面可能是种子中热激蛋白的作用,提高了其耐热性;另一方面可能是受高温胁迫后启动了保护酶系统,高温伤害得到了缓解从而使蛋白质降解减少。由此表明,可溶性蛋白在菜豆种子抵御高温胁迫过程中起到积极的作用。但在高温胁迫下,SA处理后菜豆种子中热激蛋白是否起到作用和其机理,还有待于进一步研究。
本研究中的外源水杨酸是采用浸种的方式应用到菜豆种子的培养过程,对于菜豆幼苗的作用需进一步研究与验证。本研究所用品种‘A18’为东北地区品种,因此,本研究的结果对东北地区菜豆种质资源的推广和利用有指导意义。
4 结论
适宜浓度的水杨酸可提高因高温胁迫而降低的SOD酶的活性,降低高温胁迫下菜豆种子中的O2-·及MDA含量,减少氧化损伤;同时,适宜浓度的SA浸种能提高菜豆种子中的可溶性蛋白含量,提高种子对逆境的抗性,缓解高温胁迫对菜豆种子的不利影响。0.005~0.01 mmol/L的SA浸种能提高菜豆种子在热胁迫下的萌发状况,0.05~0.1 mmol/L的SA浸种则抑制了菜豆种子的萌发,综合来看0.01 mmol/L的SA浸种效果最佳。研究结果可为水杨酸提高菜豆耐热性在生产中的应用提供参考。
