卡瑞利珠单抗一线治疗晚期非鳞非小细胞肺癌的疗效及安全性分析刘小兰
2022-07-11许佳佳潘桢婕楚阿兰马晓英王健
许佳佳 潘桢婕 楚阿兰 马晓英 王健



[摘要]目的探討卡瑞利珠单抗一线治疗晚期非鳞非小细胞肺癌(NSCLC)患者的临床疗效及安全性。方法选取2019年5月1日至2021年5月1日郑州大学第二附属医院收治的120例晚期非鳞 NSCLC 患者,根据治疗方案不同分为化疗组、卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组,每组各40例。评估三组近期疗效包括客观有效率(ORR)、疾病控制率(DCR)和远期疗效无进展生存期(PFS)及不良反应发生率。结果卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组的 ORR 分别为60.0%、70.0%,均高于化疗组的35.0%( P <0.05);三组 DCR 比较,差异无统计学意义( P >0.05)。卡瑞利珠联合方案较化疗组 PFS 显著延长(P=0.000),生存获益更显著。卡瑞利珠联合方案显著降低患者恶心、呕吐的发生,虽增加免疫相关反应(irAEs),但症状较轻且可控。结论卡瑞利珠联合方案较化疗可有效提高晚期非鳞 NSCLC 临床疗效,所引起的不良反应可控,安全性有保证。
[关键词]卡瑞利珠单抗;非小细胞肺癌;疗效;安全性
[中图分类号] R734.2[文献标识码] A [文章编号]2095-0616(2022)10-0149-04
Analysisonefficacyandsafetyof first -linetreatmentof advanced non-squamous NSCLC with camrelizumab
LIUXiaolan1XUJiajia1PANZhenjie2CHUA'lan3MAXiaoying4WANGJian1
1. Department of Medical Oncology, the Second Affiliated Hospital of Zhengzhou University, Henan, Zhengzhou 450000, China;2. Department of Pharmacy, the Second Affiliated Hospital of Zhengzhou University, Henan, Zhengzhou 450000, China;3. Department of Radiotherapy, the Second Affiliated Hospital of Zhengzhou University, Henan, Zhengzhou 450000, China;4. Department of Medical Equipment Management, the Second Affiliated Hospital of Zhengzhou University, Henan, Zhengzhou 450000, China
[Abstract] Objective To investigate the clinical efficacy and safety of first-line treatment of advanced non-squamous non-small cell lung cancer (NSCLC) with camrelizumab. Methods A total of 120 patients with advanced non-squamous NSCLC admitted to the Second Affiliated Hospital of Zhengzhou University from May 1, 2019 to May 1, 2021 were selected and divided into the chemotherapy group, the camrelizumab + chemotherapy group and the camrelizumab + chemotherapy + bevacizumab group according to different treatment schemes, with 40 patients in each group. The short-term efficacy including objective remission rate (ORR) and disease control rate (DCR), and long-term efficacy such as progression-free survival (PFS), as well as the incidence of adverse reactions (ARs) of the three groups were evaluated. Results The ORR in the camrelizumab + chemotherapy group and the camrelizumab + chemotherapy + bevacizumab group were 60.0% and 70.0% respectively, higher than that in the chemotherapy group (35.0%)(P <0.05). There was no statistically significant difference among the three groups in the DCR (P >0.05). The PFS in the camrelizumab combination groups was more significantly prolonged than that in the chemotherapy group (P=0.000), and the former groups had more significant survival benefits. The combination of camrelizumab significantly reduced the occurrence of nausea and vomiting in patients, and although there was an increase in immune-related events (irAEs), the symptoms were mild and controllable. Conclusion Compared with chemotherapy, the combination of camrelizumab is more effective in improving the clinical efficacy in treating advanced non-squamous NSCLC, with controllable post-treatment ARs, and therefore it is safe.
[Key words] Camrelizumab; Non-small cell lung cancer; Efficacy; Safety
肺癌是世界发病率及病死率居首位的恶性肿瘤,非小细胞肺癌(NSCLC)是最为常见的一种,大多数肺癌患者确诊时处于晚期,5年生存率仅为16%[1]。临床上晚期患者主要以铂类化疗药为治疗基础,虽能延长生存期,但免疫功能下降严重。近年来,程序性细胞死亡受体1(PD-1)抑制剂成为肿瘤领域的研究热点,化疗和抗血管生成药可增强其抗肿瘤作用[2],其疗效优越性也逐渐得到证实,因此免疫联合疗法逐渐成为临床肿瘤治疗的新希望。卡瑞利珠单抗是我国自主研发的人源化 IgG4κ型抗 PD-1抗体[3],该药于2019年被批准上市,2020年获批肝癌、非鳞 NSCLC、食管癌三大适应证。但其上市时间尚短,关于其联合治疗的疗效较少临床试验报道,本回顾性研究旨在探究卡瑞利珠一线治疗晚期非鳞 NSCLC 的疗效及安全性,为临床安全用药提供参考。
1资料与方法
1.1一般资料
回顾性分析2019年5月1日至2021年5月1 日郑州大学第二附属医院收治的120例晚期非鳞 NSCLC 患者。所有患者驱动基因(EGFR、ALK、 ROS-1)均为阴性, PD-LI 表达阳性。按治疗方案不同分为化疗组、卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组,每组各40例。并对患者进行电话随访及病例收集。患者在治疗前已被告知临床获益及不良反应。纳入标准:①符合《中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南(2018版)》[4]晚期非鳞 NSCLC 诊断标准;②临床数据完整;③重要脏器功能正常;④否认接受过相关治疗;⑤预期生存时间≥3个月。排除标准:①心肺或肝肾功能衰竭者;②伴随严重或致命性并发症者。化疗组男23例,女17例;平均年龄59.1岁;Ⅲ期25例,Ⅳ期15例;卡瑞利珠+化疗组男25例,女15例;平均年龄59.1岁;Ⅲ期21例,Ⅳ期19例;卡瑞利珠+化疗+贝伐组男26例,女14例;平均年龄59.7岁;Ⅲ期23例,Ⅳ期17例;三组患者年龄、性别、分期比较,差异无统计学意义( P >0.05),具有可比性。
1.2方法
化疗组予以 TC 方案:紫杉醇(扬子江药业集团有限公司,国药准字 H20053001)175 mg/m2,第1天,静脉滴注3 h,卡铂(齐鲁制药有限公司,国药准字 H20020180)AUC 6,第1天,静脉滴注,21 d 为1个周期,患者于应用紫杉醇前12及6 h 给予地塞米松(广东华南药业集团有限公司,国药准字 H44024469)20 mg 口服或应用前30 min 给予地塞米松(河南润弘制药有限公司,国药准字 H41020330)20 mg 静脉滴注;紫杉醇应用前30 min 给予苯海拉明(天津金耀药业有限公司,国药准字 H12020671)50 mg 肌内注射,以及西咪替丁(山东方明药业集团有限公司,国药准字 H37023309)300 mg 静脉滴注。
卡瑞利珠+化疗组:卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字 S20190027)200 mg,靜脉滴注,21 d 为1个周期;化疗使用 TC 方案,用药剂量、方法、时间与化疗组一致。
卡瑞利珠+化疗+贝伐珠组:贝伐珠单抗(齐鲁制药有限公司,国药准字 S20190040)15 mg/kg 体重,第1天,静脉滴注,21 d 为1个周期;卡瑞利珠和化疗药物的用药剂量、方法、时间与上述一致。治疗6周期,随后给予卡瑞利珠+贝伐珠维持治疗。
三组患者每2个周期行胸部 CT、复查血清肿瘤标志物评价疗效,至少评估3次。
1.3观察指标及评价标准
近期疗效评估按实体瘤疗效评价标准(RECIST)1.1版[5]分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。客观有效率(ORR)=(CR+PR)例数/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%。根据美国国立癌症研究所(NCI)-CTCAEV 5.0版评估治疗相关不良反应(TRAE)[6];统计随访无进展生存期(PFS,开始接受治疗至肿瘤进展或死亡的时间)。末次随访时间截至2021年8月1日。
1.4统计学分析
采用 SPSS 25.0统计学软件分析数据。计量资料以均数±标准差( x ± s)表示,采用单因素方差分析。计数资料以[n (%)]表示,采用χ2检验。用 Kaplan-Meier 进行生存分析, GraphPad Prism 8.0绘制生存曲线。 P <0.05为差异有统计学意义。
2结果
2.1三组近期疗效比较
卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组 ORR 均高于化疗组,差异有统计学意义(P<0.05);三组间 DCR 比较,差异无统计学意义(P >0.05)。见表1。
2.2三组远期疗效PFS比较
卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组平均 PFS 为(9.6±2.6)、(10.2±2.5)个月,明显长于化疗组的(7.0±1.6)个月(F=21.280,P=0.000),卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组平均 PFS 比较,差异无统计学意义(P>0.05)。
2.3 Kaplan-Meier生存分析
2.3.1生存分析与化疗组比较,卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组均显著延长患者mPFS,获益更显著(中位8.1个月 vs.10.9个月 vs.11.0个月,P=0.000),见图1。
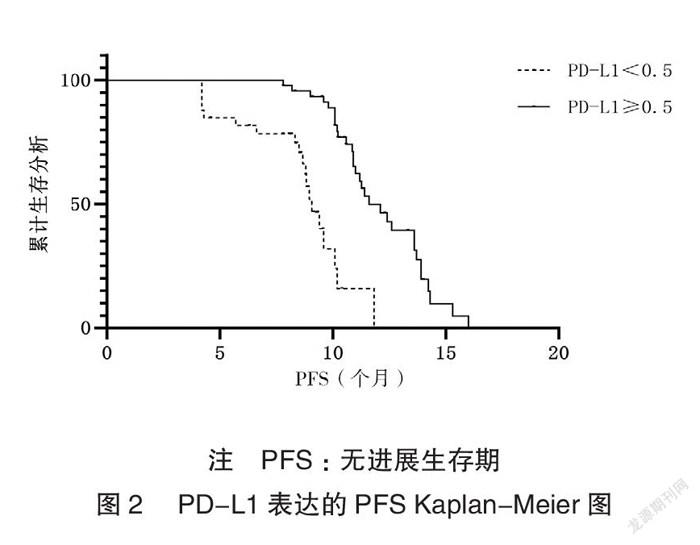
2.3.2 PD-L1亚组分析在卡瑞利珠+化疗组、卡瑞利珠+化疗+贝伐珠组中,PD-L1表达≥50%的患者为主要获益人群(P=0.000),见图2。
2.4三组TRAE比较
卡瑞利珠+化疗+贝伐珠组显著降低恶心、呕吐的发生率,且与卡瑞利珠+化疗组相比,毛细血管增生症(RCCEP)的发生率显著降低,见表2。两组特异性免疫不良反应(irAEs)程度较轻,可控。 TRAE 多为Ⅰ~Ⅱ级,其中免疫性甲状腺功能减退、 RCCEP 为卡瑞利珠引起的irAEs,此外,卡瑞利珠+化疗+贝伐珠组有2例出现高血压,卡瑞利珠+化疗组有1例出现免疫性皮炎,毒性分级为 G2,暂停药,口服激素对症治疗,症状改善后继续治疗。
3讨论
肺癌临床发病率相对较高,也是癌症相关死亡最主要原因[7]。在肿瘤发生发展过程中,免疫逃逸是重要机制之一[8],随着肿瘤免疫治疗的不断应用,免疫检查点抑制剂(ICIs)治疗的相关临床研究开展广泛, ICIs 通过作用于 PD-1和 PD-L1等相关靶点诱导 T 淋巴细胞激活,恢复其对肿瘤细胞的攻击,产生持续的抗肿瘤效应,从而抑制肿瘤的生长[9],因此 PD-1、PD-L1抑制剂逐渐成为肿瘤治疗中最具希望的新型治療方法。卡瑞利珠通过作用于 PD-1,阻断 PD-1/PD-L1结合,从而发挥抗肿瘤作用[10]。
本研究对120例晚期非鳞 NSCLC 患者的治疗效果进行比较分析,卡瑞利珠联合方案治疗的患者 PFS 临床获益均优于化疗组。目前,对于大多数晚期 NSCLC 患者的治疗以化疗为主,对于驱动基因阴性的肺腺癌患者,含铂类的双药化疗方案一直是近20年来的一线方案,但该方式使患者免疫功能下降严重,治疗期间易合并感染,总体疗效欠佳。而 PD-1抑制剂可提高患者自身免疫功能,在增强抗肿瘤作用的同时提高化疗的敏感性[11],如卡瑞利珠单抗可克服患者体内的免疫抑制,增强抗肿瘤能力。因此,与单纯化疗相比,免疫联合化疗可能为更理想的治疗方案。血管生成是肿瘤生长所依赖的环境,也是肿瘤侵袭、转移的重要条件。近年来,抗肿瘤血管生成治疗也成为重要的抗肿瘤方法之一。贝伐珠单抗是一种具有高亲和力的人源化抗血管内皮生长因子(VEGF)单克隆抗体,对肿瘤血管发挥多种作用,包括使现有的肿瘤血管退化,切断肿瘤细胞的营养供应,抑制肿瘤新生血管的生成,限制肿瘤的生长,使存活的肿瘤血管正常化,还能改变内皮细胞的通透性,从而使化疗药物更易进入肿瘤组织内[12],起到良好的抗癌效应,从而改善患者生存预后。此外还可以增加化学治疗药物与免疫检查点抑制剂的传递,改善肿瘤免疫微环境,正向调节免疫功能[13],增加活化后 T 细胞杀伤肿瘤细胞的功能并利用免疫记忆发挥持久的抗肿瘤协同作用[14],延长患者生存期,提高疗效,同时减少 PD-1抑制剂的不良事件发生率[15]。所以 PD-1抑制剂联合化疗和抗血管生成药可能成为未来治疗恶性肿瘤的焦点。
本研究中卡瑞利珠联合治疗较单纯化疗生存获益更明显,虽增加irAEs,但反应可控可防。两组卡瑞利珠联合方案间疗效分析差异无统计学意义( P >0.05),考虑纳入样本量少,缺乏足够的循证学依据,且随访时间短,患者 OS 尚不能分析,需更大样本多中心研究去进一步验证。
综上所述,卡瑞利珠联合方案一线治疗晚期 NSCLC 比单纯化疗获益更多。且降低了恶心、呕吐发生率,虽增加irAEs,但安全可控,能保证用药的安全性,为临床医生安全用药提供参考。
[参考文献]
[1] Siegel RL, Miller KD, Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2] Langer CJ,Gadgeel SM,Borghaei H,et al.Carboplatinand pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised,phase 2 cohort of the open -labelKEYNOTE-021 study[J].Lancet Oncol,2016,17(11):1497-1508.
[3] Mo H,Huang J,Xu J,et al .Safety, anti-tumouractivity, and pharmacoki-netics of fixed-dose SHR-1210, an anti-PD-1 antibody in advanced solid tumours: a dose- escalation, phase 1 study[J].Br J Cancer,2018,119(5):538-545.
[4]中国临床肿瘤学会.中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南(2018版)[J].肿瘤研究与临床,2018,30(12):793-824.
[5] Schwartz LH,Litière S,de Vries E,et al.RECIST1.1-Update and clarification: From the RECIST committee[J].Eur J Cancer,2016,62:132-137.
[6]皋文君,刘砚燕,袁长蓉.国际肿瘤化疗药物不良反应评价系统:通用不良反应术语标准5.0版[J].肿瘤,2012,32(2):142-144.
[7] Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CACancer J Clin,2019,69(1):7-34.
[8] Umansky V,Blattner C,Fleming V,et al.Myeloid-derived suppressor cells and tumor escape from immune surveillance[J].Semin Immunopathol,2017,39(3):295-305.
[9] Shen H,Yang ES,Conry M,et al.Predictive biomarkersfor immune checkpoint blockade and opportunities for combination therapie[J].Genes Dis,2019,6(3):232-246.
[10] Xie T,Chen TJ,Wang HG.Efficacy and safety ofPD-1/PD-L1 an-tibody combined with chemotherapy in the treatment of patients with advanced non-small cell lung cancer[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2020,28(10):84-88.
[11] Zitvogel L,Galluzzi L,Smyth MJ,et al.Mechanism ofaction of conventional and targeted anticancer therapies: reinstating immunosurveillance[J].Immunity,2013,39(1):74-88.
[12] 趙艳秋.从贝伐珠单抗生物类似药 IBI305的Ⅲ期临床研究结论看其临床优势[J].实用肿瘤杂志,2020,35(4):313-316.
[13] 王连祥.卡瑞利珠单抗联合贝伐珠单抗与白蛋白结合型紫杉醇/吉西他滨方案治疗晚期胰腺癌的疗效观察[J].实用医技杂志,2021,28(5):666-667.
[14] S Yasuda,M Sho,I Yamato,et al.Simultaneousblockade of programm-ed death 1 and vascular endothelial growth factor receptor 2(VEGFR2)induces synergistic anti-tumour effect in vivo[J].Clin Exp Immunol,2013,172(3):500-506.
[15] 刘甜,胡毅.PD-1/PD-L1抑制剂免疫相关不良反应及其处理综述[J].解放军医学院报,2018,39(3):251.
(收稿日期:2021-12-21)
