金樱子总黄酮对糖尿病性白内障模型大鼠眼晶状体的保护作用及机制研究
2022-07-11陈丽华李霭燕吴小桃凌梓韵
陈丽华 李霭燕 吴小桃 凌梓韵
[摘要]目的探究金樱子总黄酮对糖尿病性白内障(DC)模型大鼠眼晶状体的保护作用,并分析其可能作用机制。方法选择90只无特定病原体(SPF)级的斯泼累格·多雷(SD)大鼠,随机分为正常对照组、模型组、金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组,每组各18只。其中,正常对照组予以普通饲料饲养和自由饮水,其余四组应用小剂量链脲佐菌素(STZ)腹腔注射加膳食诱导构建DC大鼠模型,且金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组分别灌胃40、80、160mg/kg金樱子总黄酮,实验观察8周,比较各组大鼠晶状体混浊程度以及晶状体超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)水平的差异。结果与正常对照组比较,模型组大鼠晶状体混浊程度显著升高,晶状体SOD、GSH-Px表达水平更低,MDA表达水平更高,差异有统计学意义(P<0.05)。金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组大鼠的晶状体混浊程度显著低于模型组,且晶状体SOD、GSH-Px表达水平明显高于模型组,MDA水平明显低于模型组(P<0.05)。结论金樱子总黄酮能够改善DC模型大鼠眼晶状体的混浊程度,对晶状体有良好的保护作用,其机制可能与提高大鼠眼晶状体抗氧化能力有关。
[关键词]糖尿病性白内障大鼠;金樱子总黄酮;晶状体;抗氧化能力
[中图分类号]R285.5;R-332
[文献标识码]A
[文章编号]2095-0616(2022)11-0080-04
糖尿病性白内障(diabetic cataract,DC)为糖尿病的常见眼部慢性并发症,是糖尿病患者视力降低的主要原因之一。当前在临床上手术虽为DC治疗的重要手段,但部分患者受自身健康状况影响不能耐受手术,只能通过药物控制病情[1]。因此积极探索DC的发生机制,选择有效的药物延缓DC发展是当前眼科研究的热门课题。近年随着中药现代化研究与推进,越来越多研究发现从金樱子中提取的金樱子总黄酮有清除自由基、抗氧化、抗炎、防治心脑血管疾病等多种作用,也逐渐应用于糖尿病及其并发症治疗中[2-3],但关于金樱子总黄酮对DC的影响及作用机制当前尚未明确。为此,本研究应用小剂量链脲佐菌素(streptozotocin,STZ)腹腔注射加膳食诱导构建DC大鼠模型,并觀察金樱子总黄酮对DC模型大鼠晶状体混浊程度及氧化应激指标的影响,为寻找DC治疗新药物提供一定的实验依据。
1材料与方法
1.1实验材料
1.1.1实验动物选择90只无特定病原体(specific pathogen free,SPF)级的斯泼累格·多雷(Sprague-Dawley,SD)大鼠(雌雄各半),体重250~280g,均在广州中医药大学实验动物中心饲养,且在入组实验时取大鼠尾静脉血液检测血糖<6.7mmol/L,经托吡卡胺散瞳裂隙灯检查证实其晶状体透明。应用随机抽签法将上述90只大鼠随机分为正常对照组、模型组、金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组,每组各18只。
1.1.2药物与试剂金樱子浸膏(金樱子浓缩液,浓缩倍数1.1~1.3)购自西安斯诺特生物技术有限公司;链脲佐菌素(美国sigma公司,产品编号ST1668-1g,纯度≥98%);超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒均购于深圳子科生物科技有限公司。
1.1.3实验仪器瑞宇SLM-K1裂隙灯显微镜;德国罗氏血糖仪;德科H0503精密电子天平;上海继谱UV-1600紫外线分光光度计。
1.2方法
1.2.1金樱子总黄酮的制备称取500g金樱子浸膏进行真空干燥以取得金樱子提取粗品,加水溶解过滤后,用AB-8型大孔吸附树脂分离滤液,并用乙醇洗脱滤液,再进行减压蒸馏以将其制成浓缩液。然后,用聚酰胺树脂分离浓缩液,依次进行乙醇洗脱→减压蒸馏→加入分离纯化剂→过滤→冷冻干燥,制得金樱子提取物精制品。随后应用紫外分光光度法,以芦丁作为对照品测定金樱子提取物总黄酮的含量是81.21%。
1.2.2构建DC大鼠模型模型组、金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组建立DC大鼠模型,具体方法:各组大鼠均适应性喂养3d,自由饮食饮水,再在大鼠腹腔注射65mg/kg链脲佐菌素,每日取大鼠尾静脉血监测其空腹血糖水平,当其空腹血糖>16.7mmol/L提示糖尿病大鼠模型建模成功。然后每日对糖尿病大鼠模型双眼滴1%托品酰胺滴眼液,1周后用乙醚蒸气麻醉大鼠,通过裂隙灯观察大鼠晶状体,晶状体出现混浊可判断为DC建模成功,若大鼠未出现混浊继续应用托品酰胺滴眼液。在建模期间各组大鼠自由饮食水。1.2.3干预方法金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组分别每日灌胃40、80、160mg/kg金樱子总黄酮,正常对照组每日灌胃等容量的生理盐水。五组均实验观察8周。
1.3观察指标及评价标准
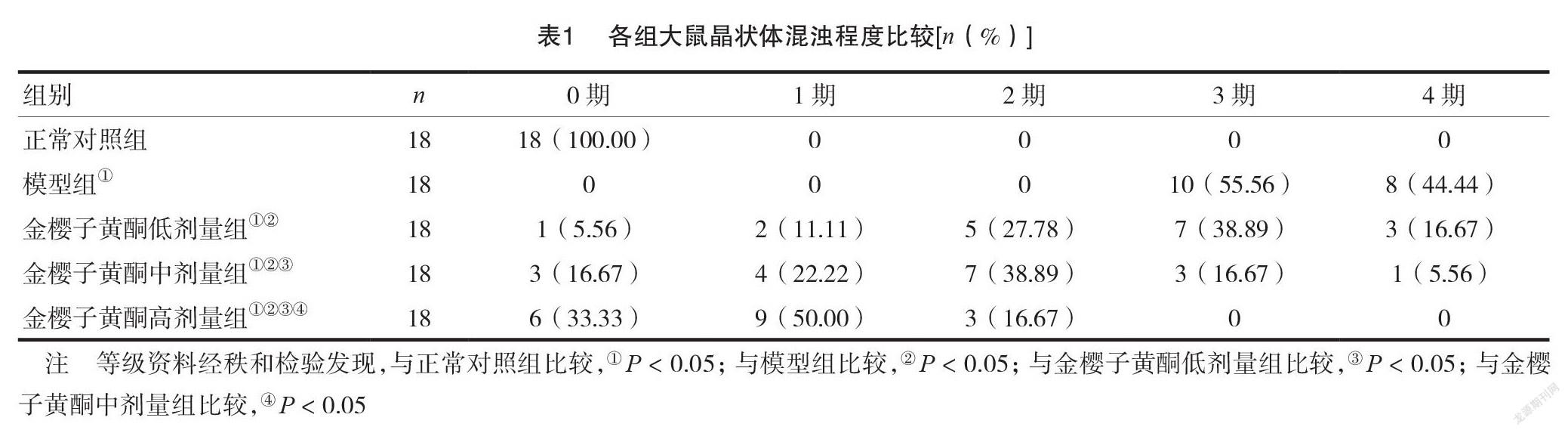
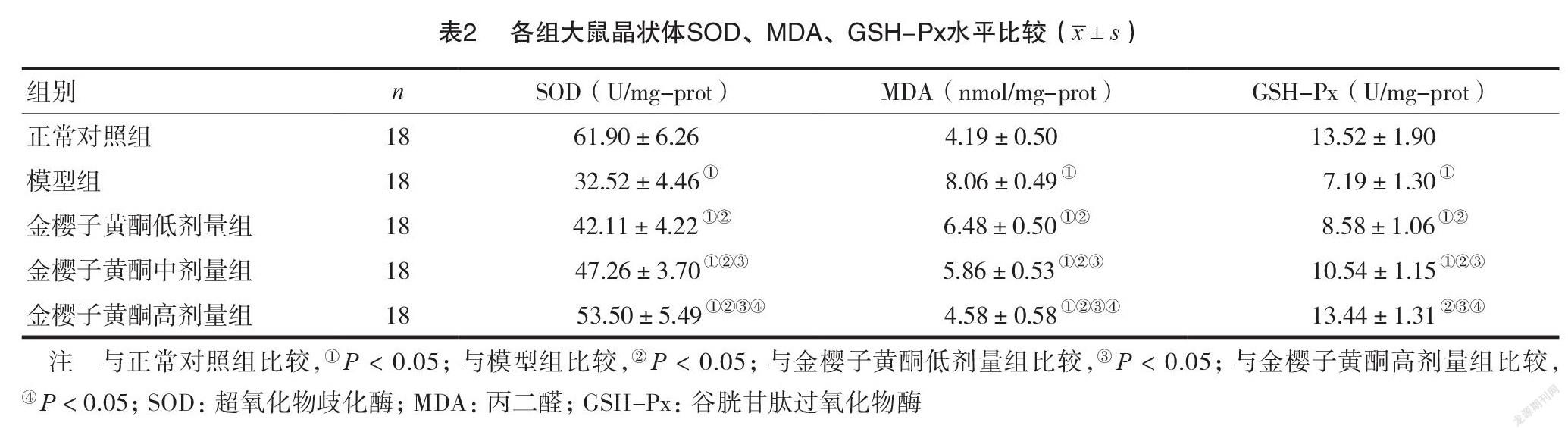
1实验观察8周后,应用裂隙灯观察大鼠晶状体变化情况,并进行组间晶状体混浊度比较。晶状体混浊度分级标准[4]:0期,晶状体透明;1期,晶状体轻度混浊,四周见有少许囊泡,但瞳孔仍透明;2期,晶状体中度混浊,周围囊泡数量增多,呈融合状,且有少量囊泡扩展到瞳孔;3期,晶状体高度混浊,瞳孔区内有大量囊泡,晶状体核混浊明显加重;4期,晶状体完全混浊。2比较各组大鼠晶状体SOD、MDA、GSH-Px水平。采用颈椎脱臼法处死实验大鼠,取晶状体用生理盐水反复冲洗吸干水分待检,SOD采用邻苯酚自氧化法测定,MDA采用硫代巴比妥酸法测定,GSH-Px采用改良Hafeman法测定。
1.4统计学处理
采用SPSS20.0统计学软件处理数据,计量资料以均数±标准差(x±s)表示,两组比较采用t检验,多组间比较行单因素方差分析;计数资料以[n(%)]表示,等级资料行秩和检验,P<0.05为差异有统计学意义。
2结果
2.1各组大鼠晶状体混浊程度比较
实验结束时,正常对照组大鼠的晶状体均完全透明。而金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组大鼠的晶状体混浊程度显著低于模型组,且随着金樱子总黄酮剂量增加,晶状体混浊程度逐渐降低,差异有统计学意义(P<0.05),见表1。
2.2各组大鼠晶状体SOD、MDA、GSH-Px水平比较
与正常对照组比较,模型组晶状体SOD、GSH-Px表达水平更低,MDA表达水平更高,差异有统计学意义(P<0.05)。金樱子黄酮低剂量组、金樱子黄酮中剂量组、金樱子黄酮高剂量组大鼠晶状体SOD、GSH-Px、MDA水平比较,差异均有统计学意义(P<0.05),见表2。
3讨论
当前在临床上DC的发生机制尚无确切的说法,研究主要集中在三个方面,分别是氧化应激机制的激活[5]、多元醇途径[6]、晶状体蛋白非酶糖基化[7]。有学者发现[8],氧化应激是其他两个理论的重要中间环节,并能够进一步介导晶状体上皮细胞凋亡。正常人晶状体内存有一定数量自由基,并存有两大抗氧化体系,分别以酶促和非酶促反应为特点,其中包括SOD、GSH等,使晶状体组织活性氧及自由基的产生和清除保持动态平衡,以免自由基的损伤。然而在外界诱发因素作用下,自由基生成会逐渐变多,抗氧化防御系统会受到抑制,致使氧化应激反应损伤加剧,损害晶状体上皮细胞,晶状体内蛋白成分比例失调,表现为不可溶性蛋白比例增多,最终促使白内障发生发展。因此,抑制氧自由基,抗晶状体氧化损伤是当前研究DC的突破口。
SOD可特异性地与超氧化物阴离子结合引发歧化反应,进而发挥清除氧自由基的作用,避免机体受到自由基的损害[9]。GSH-Px能够分解体内过氧化氢,还原氢氧化物,抑制机体氧化反应[10]。MDA是机体内脂质过氧化物降解的产物,故SOD、GSH-Px用于反映机体抗氧化能力,MDA用于反映机体氧化应激损伤程度[11]。本研究结果显示,模型组大鼠的晶状体混浊程度显著高于正常对照组,且模型组大鼠晶状体SOD、GSH-Px表达水平更低,MDA表达水平更高,说明DC大鼠晶状体抗氧化能力显著降低,存有氧化应激受损,这可能是体内过多氧自由基诱发过氧化损伤,造成实验大鼠晶状体MDA含量增加,晶状体可溶性蛋白减少,不可溶性蛋白变多,影响晶状体膜的通透性,促使晶状体光学性质、内环境变化,逐渐引起晶状体混浊[12-13]。
本研究應用金樱子总黄酮干预DC大鼠,结果显示金樱子黄酮组的晶状体混浊程度显著低于模型组,晶状体SOD、MDA、GSH-Px水平优于模型组,且随着总黄酮剂量增加,其晶状体改善效果更好,与周小平等[14]研究结果相似,说明金樱子总黄酮能够通过增加抗氧化酶的活性抑制自由基产生,阻止氧自由基挤入晶状体,进而减轻氧化应激损伤,延缓DC大鼠晶状体囊泡形成,防止DC发生发展,而且其作用随着剂量增长而加强[15]。现代药理学也报道[16],金樱子中富含黄酮、多糖、皂苷、鞣质等活性物质,其中金樱子黄酮具有抗氧化、增强免疫、抗菌和降血脂作用,但其具体分子作用机制、生物学意义尚未清楚,有待研究。而且本研究也有不足之处,未对不同剂量金樱子总黄酮的安全性进行研究,故今后需增加观察指标,进行更高水平层次探讨金樱子总黄酮对DC模型大鼠晶状体保护作用的量效关系,为临床推广应用提供高质量循证医学证据。
综上所述,金樱子黄酮能够改善DC模型大鼠眼晶状体的混浊程度,对晶状体有良好的保护作用,且其保护作用呈剂量依赖性,其机制可能与提高大鼠眼晶状体抗氧化能力有关。
[参考文献]
[1]李朝辉,马天驹,叶子.重视合并糖尿病的白内障患者管理[J].中华眼科杂志,2020,56(5):325-329.
[2]刘金安,刘相文,耿巧玉,等.金樱子不同提取方法提取物体外抑制病毒活性及机制研究[J].西部中医药,2020,33(1):9-12.
[3]蒋德旗,蒋夏荣,夏家朗,等.复合酶提取金樱子根多糖工艺的优化及其抗氧化活性[J].中成药,2018,40(11):2421-2425.
[4]王晓明,汤欣.晶状体功能失调指数在年龄相关性白内障诊断及手术中的应用[J].中华实验眼科杂志,2018,36(3):199-203.
[5]苏梅贵,罗向霞.中医药基于氧化应激途径防治糖尿病视网膜病变的机制进展[J].中国中医眼科杂志,2020,30(11):821-824,836.
[6]韩雪,苏胜,田霈,等.醛糖还原酶在糖尿病性白内障中的作用[J].现代生物医学进展,2015,15(7):1362-1364.
[7]罗云娜,赵海霞,张伊晖,等.TGF-β1、IGF-1、bFGF和IL-6在糖尿病性白内障中的表达及意义[J].内蒙古医科大学学报,2020,42(3):225-228,238.
[8]陈艳文.糖尿病性白内障患者血清与房水中细胞因子表达的变化[J].国际眼科杂志,2020,20(11):1946-1949.
[9]刘丽,艾华,康前雁,等.不同剂量白藜芦醇对糖尿病性白内障大鼠晶状体抗氧化酶活力的影响[J].现代生物医学进展,2019,19(24):4642-4645.
[10]吴群,郝丽丽,陶雯璇,等.糖尿病型白内障患者血清和房水中部分抗氧化指标及血管内皮生长因子水平[J].贵州医科大学学报,2017,42(11):1302-1305.
[11]舒畅,范强,杨丽霞,等.昆仑雪菊提取物对STZ诱导糖尿病大鼠血清SOD、MDA、GSH-PX的影响[J].中医研究,2017,30(4):70-72.
[12]李晓,刘雪薇,芦凌羽,等.氧化应激与糖尿病相关性白内障的研究进展[J].西北国防医学杂志,2020,41(7):457-462.
[13]张剑,赵燕.葛根素对大鼠糖尿病性白内障的抗氧化损伤作用及机制[J].中国老年学杂志,2018,38(8):1932-1934.
[14]周小平,周俊,肖启国,等.金樱子滴眼液抑制糖尿病大鼠白内障的机制研究[J].世界临床医学,2017,11(15):1-2.
[15]周俊,何湘珍,肖启国.金樱子通过增加Bcl-2/Bax表达比抑制大鼠糖尿病性白内障晶状体上皮细胞的凋亡[J].眼科新进展,2014,34(4):314-318.
[16]王燕,朱向东,王欢,等.金樱子的临床应用及其用量探究[J].吉林中医药,2020,40(6):806-808.
(收稿日期:2021-09-24)
