多粘菌素B对脂多糖诱导的大鼠肝星状细胞自噬的影响
2022-07-11王美娇徐军全宋维芳刘晓玲
王美娇 徐军全 宋维芳 刘晓玲
[摘要]目的探讨Toll-样受体4(TLR4)信号通路阻断剂多粘菌素B(PMB)对脂多糖(LPS)诱导的大鼠肝星状细胞系(HSC-T6)自噬的影响并探讨自噬在肝纤维化(HF)中的意义。方法将常规培养的HSC-T6分为对照组、LPS组、PMB组、LPS+PMB组,各组细胞经相应处理后,以Westernblot法检测各组微管相关蛋白轻链II(LC3II)及TLR4表达水平;免疫荧光法检测各组LC3在细胞内的分布情况;ELISA法检测各组细胞培养上清中层黏蛋白(LN)、透明质酸(HA)、III型前胶原蛋白(PCIII)及IV型胶原蛋白(CIV)含量。结果LPS组HSC-T6中LC3含量、LC3II蛋白表达水平及细胞培养上清中LN、HA、PCIII及CIV含量均高于对照组,差异有统计学意义(P<0.05);LPS+PMB组HSC-T6细胞中LC3含量、LC3II蛋白表达水平及细胞培养上清中LN、HA、PCIII及CIV含量均低于LPS组,差异有统计学意义(P<0.05)。结论LPS可能通过活化TLR4信号通路进而促进HSC-T6细胞自噬及纤维化。
[关键词]肝星状细胞;TLR4;自噬;内毒素
[中图分类号]R363
[文献标识码]A
[文章编号]2095-0616(2022)11-0035-04
肝纤维化(hepatic fibrosis,HF)是由各种致肝损伤因素作用引起慢性肝损伤并最终发展形成肝硬化的必经阶段[1-2],以细胞外基质(exrta cellular matrix,ECM)合成降解失衡导致其过度在肝脏中沉积为显著病理变化,其中肝星状细胞(hepatic stellate cells,HSCs)的活化并转化为肌成纤维细胞仍被认为是HF形成过程中ECM的主要来源[3-4]。自噬(autophagy)是在真核生物中普遍存在的一种高度保守的物质循环利用的过程,对于维持细胞内稳态具有十分重要的意义[5-6]。近年来,已有越来越多的研究表明细胞自噬在HF的发生及发展中具有十分重要的作用[7]。本实验室先前已有研究表明[8]LPS可以诱导HSC-T6自噬,但其可能并非通过NF-κB通路。Toll样受体4(Toll-like receptors4,TLR4)作为LPS引起肝脏炎症反应以及最终引起HF等过程中的关键信号通路之一,是否会影响HSC-T6自噬也有待进一步研究。本实验旨在探讨多粘菌素B(polymyxinB,PMB)预处理对LPS诱导的HSC-T6自噬的影响并探讨其可能机制。
1材料与方法
1.1实验材料
HSC-T6细胞(齐氏生物科技有限公司);高糖DMEM培养基细(武汉博士德生物工程有限公司);胎牛血清(浙江天杭生物科技有限公司);LPS、兔抗微管相关蛋白轻链(microtubule-associated protein light chain,LC3)抗体(SIGAM公司);小鼠抗TLR4抗體(Abcam公司);大鼠层黏蛋白ELISA试剂盒、大鼠透明质酸ELISA试剂盒(上海西塘生物科技有限公司);III型前胶原蛋白(PCIII)及IV型胶原蛋白(CIV)检测试剂盒(南京建成生物工程研究所);PMB(Solarbio 生物科技有限公司)。EonTM型微孔板分光光度计(美国BioTek公司);DM4000BLED型荧光显微镜(德国Leica公司);超净工作台(上海智诚公司);HF90型细胞培养箱(Heal Force公司);DYY-7C型电泳仪(北京六一机器厂);化学发光成像仪(美国Alpha Innotech公司)。
1.2方法
1.2.1细胞培养与传代HSC-T6接种于含10%胎牛血清、1%青链霉素的高糖DMEM培养基中,于37°C含5%CO2培养箱内培养,每1~2天更换新鲜培养基,待细胞汇合度大于80%时,用含EDTA胰酶消化并传代。
1.2.2实验分组接种于6孔板的HSC-T6分为对照组(不做特殊处理)、LPS组(0.1mg/LLPS处理12h)、PMB组(10mg/LPMB处理12h)及LPS+PMB组(10mg/LPMB预处理1h后立即给予终浓度为0.1mg/L的LPS处理12h)。各组细胞经相应处理后提取蛋白、固定或收集培养上清备用。
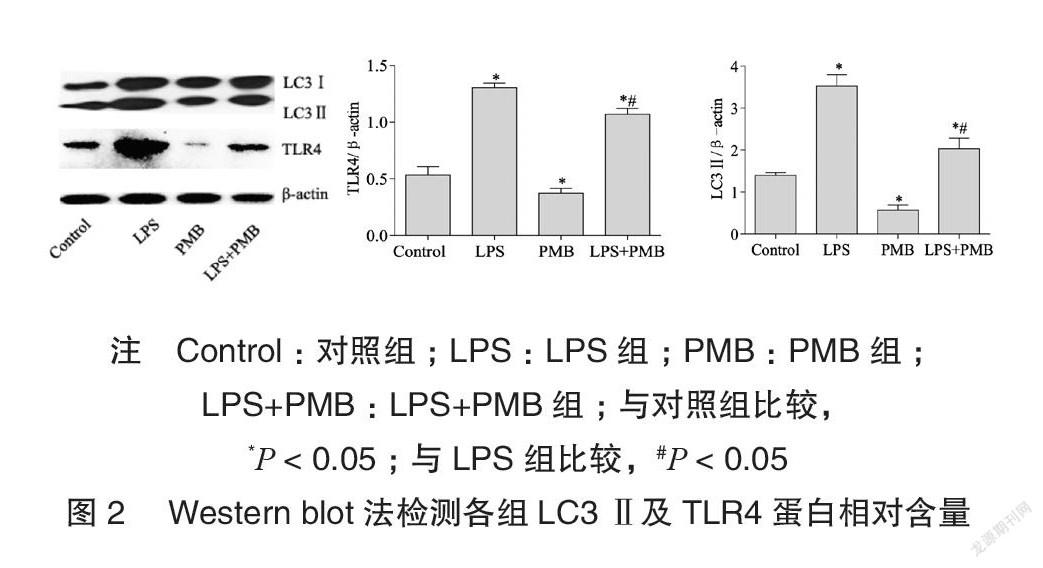
1.2.3Westernblot法各组细胞经EDTA溶液处理后收集离心并裂解,经BCA法测定后调整蛋白浓度,加入5×loadingbuffer煮沸变性后收集蛋白样品。每孔30μg总蛋白上样后经电泳、转膜、封闭后分别加入抗LC3(1∶4000)和抗TLR4(1∶500)抗体4°C过夜,TBST洗涤后分别加入HRP标记的羊抗兔(1∶20000)和羊抗小鼠(1∶1000)二抗于37°C恒温气浴70min,TBST洗涤后通过加入ECL化学发光液,X胶片曝光后通过显影定影并根据目的条带与内参β-actin积分光密度比值行半定量分析,重复三次平行实验,结果取平均值。
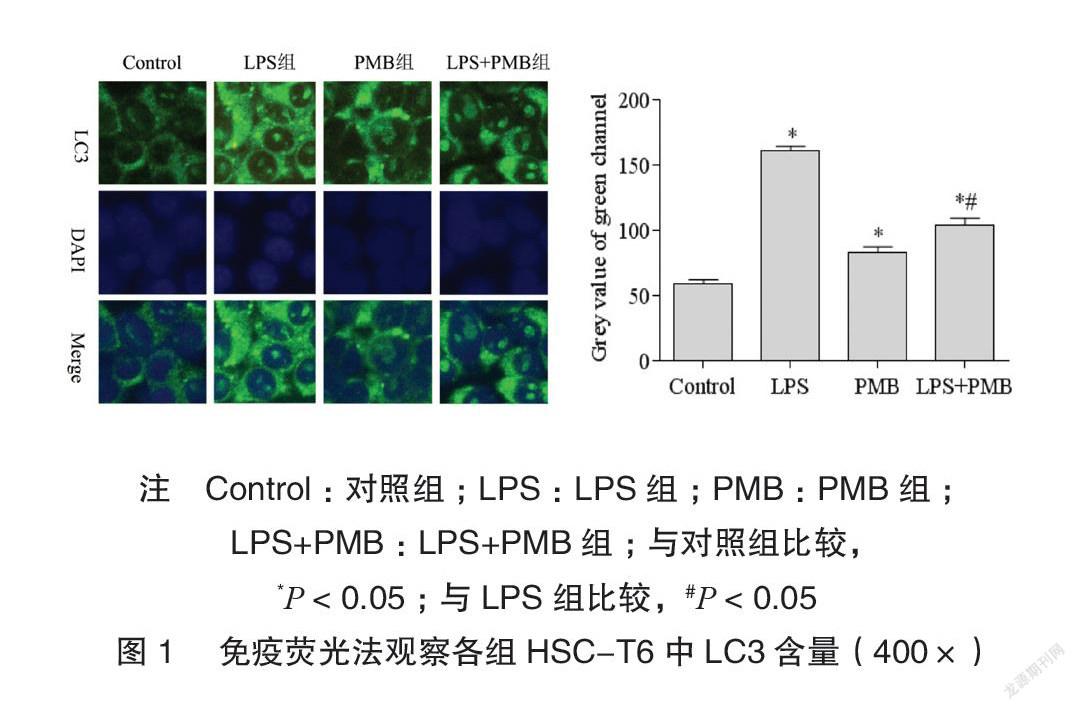
1.2.4免疫荧光法HSC-T6接种于无菌载玻片,经相应处理12h后弃培养基,用4°CPBS洗涤后再用预冷后的丙酮固定30min,PBS洗涤后经免疫荧光封闭液孵育30min,加入抗LC3抗体(1∶100),于4°C孵育冰箱过夜,经PBS洗涤后再加入荧光二抗(1∶100)37°C避光孵育1h,经PBS洗涤后对细胞核进行DAPI染色,封片处理后于荧光显微镜下观察,重复三次平行实验并通过Image-ProPlus分析各组绿通道平均灰度值。
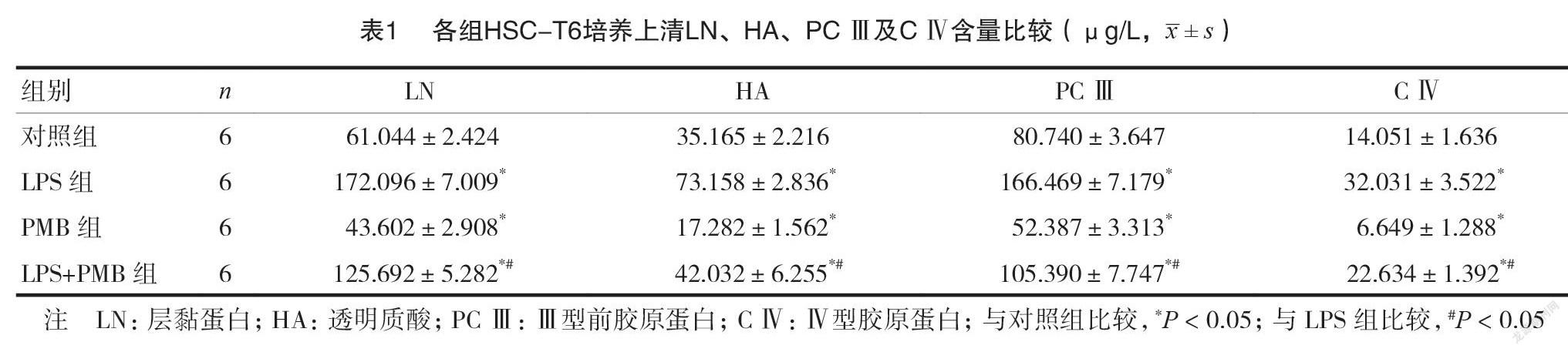
1.2.5细胞培养上清非胶原蛋白如层黏蛋白(Laminin,LN)、蛋白多糖如透明质酸(hyaluronicacid,HA)、PCIII及CIV含量的检测接种于6孔板的各组HSC-T6经相应处理12h后收集培养上清,每孔需分别加入标准品或各组待测样品各100μl,轻轻摇晃使其充分混匀后37°C孵育20min,充分洗涤3~5次并用洁净滤纸充分印干多余液体;加入一抗工作液和ddH2O各50μl后37°C孵育20min,经洗涤后每孔各加酶标抗体工作液100μl,37°C孵育10min;继续洗涤后加底物工作液各100μl,37°C孵育10min。洗涤后各加入100μl终止液并轻轻摇晃使其充分混匀,通过酶标仪在波长450nm处测OD值,重复三次平行实验,结果取平均值。
1.3统计学处理
采用SPSS25.0统计学软件进行统计分析。计量资料以均数±标准差(x±s)表示,组间差异采用单因素方差分析(ANOVA),两两比较用t检验,以P<0.05为差异有统计学意义。
2结果
2.1各组HSC-T6中LC3、LC3II及TLR4含量比较
免疫荧光结果显示LPS组LC3荧光灰度值高于对照组,差异有统计学意义(P<0.05);LPS+PMB组LC3荧光灰度值低于LPS组,差异有统计学意义(P<0.05),见图1。
Westernblot结果显示LPS组LC3II蛋白表達水平高于对照组,差异有统计学意义(P<0.05);LPS+PMB组LC3II蛋白表达水平低于LPS组,差异有统计学意义(P<0.05),见图2。
PMB组TLR4表达水平低于对照组,差异有统计学意义(P<0.05);LPS+PMB组TLR4表达水平低于LPS组,差异有统计学意义(P<0.05),见图2。
2.2各组HSC-T6培养上清LN、HA、PCIII及CIV含量比较
LPS组培养上清LN、HA、PCIII及CIV含量高于对照组,差异有统计学意义(P<0.05);LPS+PMB组LN、HA、PCIII及CIV含量低于LPS组,差异有统计学意义(P<0.05),见表1。
3讨论
我国是各种肝病的高发地区,在“肝炎-肝纤维化-肝硬化及肝癌”三部曲中,对肝纤维化的防治显得极为关键。各种急、慢性肝脏疾病多数伴有内毒素血症,目前已经公认肠源性内毒素血症可促进HF的发生与发展[9],LPS可通过LPS-LBP-CD14三元复合物作用于TLR4,由此将胞外的各种信号传递到胞内[10-11]。TLR4是识别LPS的关键受体之一,TLR4是自噬相关的先天性免疫的传感器,且自噬和TLR4介导的免疫反应具有共同的信号通路[12-13]。近年来已有大量研究提示TLR4信号通路可促进自噬,Xu等[14]通过研究发现LPS可诱导巨噬细胞自噬,而抑制TLR4信号通路可引起自噬体数量显著减少;Wang等[15]也发现用LPS刺激人腹膜间皮细胞系后自噬体数量增加,采用siRNA或用PMB阻断TLR4信号通路,LPS诱导的自噬被显著抑制。上述研究均提示TLR4信号通路与自噬密切相关且TLR4信号通路可促进自噬,但也不乏相反的报道,有研究显示,TLR信号通路中的Myd88死亡结构域与Beclin1相互作用中具有重要意义,MyD88过表达会抑制自噬[16],TLR反过来也可通过PI3K-AKT轴直接激活mTOR,从而对自噬产生影响。本研究基于HF的发生发展机制推测,LPS可能通过TLR4信号通路促进HSC-T6自噬并促进HF。
本实验中所用的HSC-T6细胞是由SV40转染SD大鼠HSC而成,具有活化HSC的表型。PMB为多肽类抗生素,具有抗菌和灭活LPS的作用,因此常作为TLR4信号通路阻断剂[17]。ECM主要由胶原(如PCIII和CIV)、LN、HA三类成分组成,因此常作为临床上监测HF程度的有效指标[18-20]。LC3是自噬的特异性标志物,当自噬发生时,LC3I被激活,转变成LC3II并附着于自噬体膜上,因此LC3II被作为反应自噬水平的有效指标[7],本研究采用LC3II/β-actin的积分光密度比值来衡量自噬水平。本实验采用PMB预处理HSC-T6细胞,Westernblot结果提示PMB可有效阻断TLR4信号通路,自噬相关蛋白LC3含量显著下降,提示阻断TLR4抑制了LPS诱导的HSC-T6自噬。为进一步探讨HSC-T6自噬在肝纤维化中的意义。本研究检测了HSC-T6培养上清中LN、HA、PCIII及CIV含量,结果显示LPS组上述指标含量显著增加,阻断TLR4信号通路后其含量下降(P<0.05),提示HSC-T6自噬在肝纤维化中起到改善或保护作用。自噬是一种高度保守的物质循环利用的过程,对于维持细胞内稳态具有十分重要的意义,在静止的HSCs中自噬可能通过激活HSCs并通过降解脂滴为其提供能量,进而促进HF的形成,而对于HSC-T6来说,自噬反而可以作为一种存活机制,通过提高细胞自噬水平维持细胞内外稳态平衡,从而达到逆转肝纤维化的目的[21-22]。
综上所述,本实验提示LPS可能通过活化TLR4信号通路进而促进HSC-T6自噬及肝纤维化。但本实验也存在不足之处,TLR活化后信号通路与自噬关键分子之间的相互作用错综复杂,具体机制仍需进一步研究,更为重要的是本实验为体外研究,无法准确反映在体内的情况,有待于接下来进一步的动物实验或原代HSC等研究。
[参考文献]
[1] Ezhilarasan D,E Sokal,M Najimi.Hepatic fibrosis: It is time to go with hepatic stellate cell-specific therapeutic targets[J].Hepatobiliary Pancreat Dis Int,2018,17(3): 192-197.
[2] Haiyin,Zheng,Xiaoying,et al.Pien-Tze-Huang ameliorates hepatic fibrosis via suppressing NF-κB pathway and promoting HSC apoptosis[J].Journal of Ethnopharmacology,2019,244:111856.
[3] H Kojiro,K Nakamura,JW Kupiec-Weglinski,et al. Therapeutic targets for liver regeneration after acute severe injury: a preclinical overview[J].Expert Opinion on Therapeutic Targets,2020,24(1):13-24.
[4] Jian-Bin Qiao,Qian-Qian Fan,Cheng-Lu Zhang,et al. Hyperbranched lipoid-based lipid nanoparticles for bidirectional regulation of collagen accumulation in liver fibrosis[J].Journal of Controlled Release,2020,321: 629-640.
[5] Deretic V.Autophagy in inflammation, infection, andimmunometabolism[J].Immunity,2021,54(3): 437-453.
[6] Alsousi, AA,O.J. Igwe.Autophagy protects against redox-active trace metal-induced cell death in rabbit synovial fibroblasts through Toll-like receptor 4 activation[J].Exp Cell Res,2019,374(1):19-28.
[7] Qian H,Chao X,Williams J,et al.Autophagy in liver diseases: A review[J].Molecular Aspects of Medicine, 2021,82:100973.
[8]王美嬌,徐军全,王明亮,等.脂多糖促进大鼠肝星状细胞系HSC-T6细胞自噬[J].基础医学与临床,2017,37(11):1579-1584.
[9] Fukui H.Gut-liver axis in liver cirrhosis: How to manage leaky gut and endotoxemia[J].World Journal of Hepatology,2015,7(3):425-442.
[10] Seifert L,Deutsch M,Alothman S,et al.Dectin-1 Regulates Hepatic Fibrosis and Hepatocarcinogenesis by Suppressing TLR4 Signaling Pathways[J].Cell Rep, 2015,13(9):1909-1921.
[11]杨坤,田珍珍,王淑华,等.LPS-TLR4信号通路在慢性酒精摄入大鼠模型肝纤维化发生中的作用及其机制[J].吉林大学学报(医学版),2015,41(4):751-755.
[12] Xu Y,Liu X,Gong X,et al.Signaling pathway of autophagy associated with innate immunity[J]. Autophagy,2008,4(1):110-112.
[13] Miao J,Benomar Y,Al Rifai Sarah,et al.Resistin inhibits neuronal autophagy through Toll-like receptor 4[J].J Endocrinol,2018,238(1):77-89.
[14] Xu Y,Jagannath C,Liu X,et al.Toll-like Receptor 4 Is a Sensor for Autophagy Associated with Innate Immunity[J].Immunity,2007,27(1):135-144.
[15] Wang J,Feng X,Zeng Y,et al.Lipopolysaccharide (LPS)-induced autophagy is involved in the restriction of Escherichia coli in peritoneal mesothelial cells[J].BMC Microbiol,2013,13(1):1-16.
[16] Shi CS,Kehrl JH.MyD88 and Trif Target Beclin 1 to Trigger Autophagy in Macrophages[J].Journal of Biological Chemistry,2008,283(48):33175-33182.
[17] Guo YB,Chen LP,Cao HW,et al.Polymyxin B antagonizing biological activity of lipopolysaccharide[J]. Chin J Traumatol,2007,10(3):180-183.
[18]冼观秀,张家明,陈聪,等.乙型肝炎肝硬化患者自身抗体检测及与生化指标和肝纤维化指数的关系[J].中国医药科学,2020,10(21):173-175,183.
[19]余思邈,金亮,朱云,等.中药软肝方改善乙型肝炎肝硬化肝纤维化的临床疗效观察[J].中国中西医结合消化杂志,2019,27(5):330-332.
[20]林鲁飞,王华.复方甘草酸苷片联合双歧杆菌三联活菌胶囊治疗儿童非酒精性脂肪性肝病的疗效和安全性[J].儿科药学杂志,2019,25(12):20-23.
[21]陈颖,付念,陈学凤,等.自噬在肝纤维化中作用的研究进展[J].广东医学,2015,36(20):3244-3246.
[22] Seki E,Brenner DA.Recent advancement of molecular mechanisms of liver fibrosis[J].Journal of Hepato-Biliary- Pancreatic Sciences,2015,22(7):512-518.
(收稿日期:2021-12-20)
