rhEGF联合卡波姆眼用凝胶治疗白内障超声乳化吸除术后干眼症的效果分析
2022-07-09吴哲董南尚利晓
吴哲 董南 尚利晓
干眼症是白内障超声乳化吸除术(PHACO)后常见的并发症[1],目前对于PHACO后干眼症的治疗主要以人工泪液为主。玻璃酸钠是一种具有较好保水性的人工泪液,能够在眼睛表面形成稳定且长效的水分膜,从而缓解干眼症症状[2]。常规的人工泪液虽然治疗效果较好,但仅能起到缓解作用,且单一用药时间较长,患者用药依从性较差。有研究发现干眼症患者泪膜稳定性下降、角膜上皮受损等诸多改变与泪液及角膜中的表皮生长因子密切相关[3]。重组人表皮生长因子(rhEGF)具有较好的促进创面愈合作用,能够促进角膜上皮细胞再生,有利于受损角膜的愈合。卡波姆眼用凝胶为泪液的替代物,有研究表明卡波姆眼用凝胶治疗干眼症的效果优于玻璃酸钠[4]。本研究观察rhEGF联合卡波姆眼用凝胶治疗PHACO后干眼症的效果。
1 材料与方法
1.1 一般资料 采用随机对照法将2016年2月~2021年2月我院PHACO后干眼症患者100例分为对照组和观察组,各50例,年龄48~64岁,病程1~4年。两组患者性别、年龄、病程、干眼症严重程度比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。

表1 两组一般资料对比(n)
纳入标准:①初次行PHACO治疗;②术后经泪液分泌试验(SIT)、泪膜破裂时间(BUT)测试等确诊为干眼症;③单眼患病。排除标准:①既往有眼部手术史或外伤者;②先天性无泪症、无泪腺者;③原发性干眼;④合并糖尿病等影响眼部健康疾病者;⑤对本研究使用药物过敏者。
1.2 方法 对照组使用玻璃酸钠滴眼液(参天制药株式会社,H20120443,5ml)治疗,1滴/次,5次/天,根据症状适当加减。观察组使用rhEGF联合卡波姆眼用凝胶治疗,滴入rhEGF滴眼液(桂林华诺威基因药业有限公司,国药准字S20020016,3ml)于眼结膜囊内,1~2滴/次,4次/天,结膜囊内滴入卡波姆眼用凝胶(山东博士伦福瑞达制药有限公司,国药准字J20160001,10g),1滴/次,4次/天,两种药物滴眼时间间隔10min以上,两组均连续治疗4周。
1.3 观察指标与评价标准 临床疗效:分为治愈(眼疲劳感、异物感、眼睛干涩等症状彻底消失,SIT>10mm)、显效(眼疲劳感、异物感、眼睛干涩等症状明显缓解,SIT 5~10mm)、有效(眼疲劳感、异物感、眼睛干涩等症状缓解,SIT<5mm)、无效(未达上述标准)。泪膜稳定性:分别于治疗前后检测患者的SIT、BUT、泪膜厚度。炎症因子及氧化应激水平:分别于治疗前后使用ELISA法检测患者的白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子(TNF-α)、丙二醇(PDO)、脂质过氧化物(LPO)、超氧化物歧化酶(SOD)水平。
1.4 统计学方法 采用SPSS 22.0软件进行分析。计量资料用±s表示,计数资料用n或%表示,分别行t检验、χ2检验,P<0.05为差异有统计学意义。
2 结果
观察组总有效率为94.00%,对照组为78.00%,两组比较差异有统计学意义(χ2=5.315,P<0.05),见表2。治疗后观察组SIT、BUT、泪膜厚度均大于对照组(P<0.05),见表3。治疗后观察组IL-6、IL-1β、TNF-α、PDO、LPO水平低于对照组,SOD水平高于对照组(P<0.05),见表4。
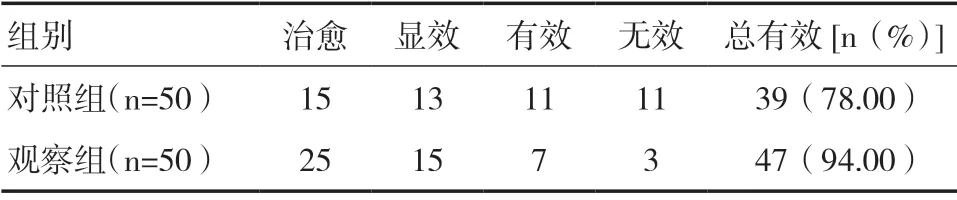
表2 两组临床疗效对比(n)
表3 两组泪膜稳定性对比(±s)
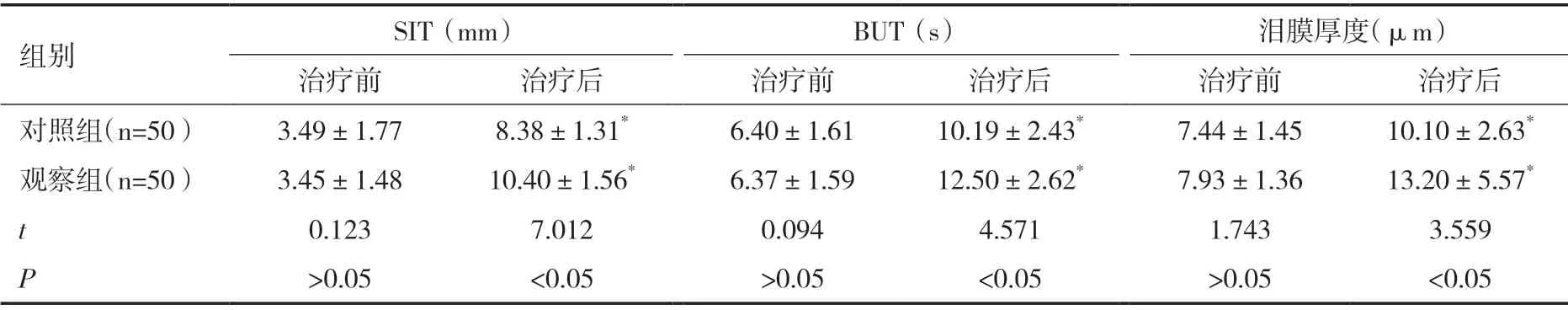
表3 两组泪膜稳定性对比(±s)
注:与本组治疗前比较,*P<0.05
组别 SIT(mm) BUT(s) 泪膜厚度(μm)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=50) 3.49±1.77 8.38±1.31* 6.40±1.61 10.19±2.43* 7.44±1.45 10.10±2.63*观察组(n=50) 3.45±1.48 10.40±1.56* 6.37±1.59 12.50±2.62* 7.93±1.36 13.20±5.57*t 0.123 7.012 0.094 4.571 1.743 3.559 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
表4 两组炎症因子及氧化应激水平对比(±s)

表4 两组炎症因子及氧化应激水平对比(±s)
注:与本组治疗前比较,*P<0.05
组别 IL-6(ng/ml) IL-1β(ng/ml) TNF-α(pg/ml)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=50) 1.50±0.29 1.25±0.26* 126.27±25.38 69.69±9.86* 262.97±50.08 223.75±41.12*观察组(n=50) 1.48±0.28 1.06±0.20* 125.86±24.95 46.28±8.54* 261.22±47.59 192.54±36.26*t 0.351 4.096 0.081 12.690 0.179 4.025 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05组别 PDO(U/L) LPO(μmol/L) SOD(mmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=50) 7.25±0.85 4.12±0.45* 2.36±0.28 1.81±0.23* 0.11±0.06 0.12±0.03*观察组(n=50) 7.20±0.79 2.59±0.30* 2.40±0.29 1.10±0.12* 0.10±0.06 0.16±0.03*t 0.305 20.004 0.702 19.352 0.833 6.667 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
3 讨论
干眼症是临床上常见的眼科疾病,近年来随着我国人口老龄化逐渐加剧,临床上PHACO治疗的白内障患者明显增多,术后干眼症等并发症发生率也明显提高[5]。据统计,PHACO后干眼症的发生率最高可达80%,一部分患者的干眼症症状随着时间的推移而消失,也有部分患者的干眼症难以缓解,反复发作,对术后恢复造成严重影响。PHACO后发生干眼症的病因较为复杂,可能与手术切口、术中器械损伤、超声用时、角膜暴露时间、麻醉药及皮质激素等药物毒性诸多因素有关。维持眼部湿润、提高泪膜稳定性是PHACO后干眼症的主要治疗原则,人工泪液能够在眼睛表面形成一种稳定且长效的水分膜,从而维持眼部湿润,是目前治疗干眼症的常用药物,但单纯人工泪液治疗的角膜上皮细胞损伤修复质量较差,无法有效促进创面愈合,导致泪膜的稳定性下降。
卡波姆眼用凝胶由固相(基质-卡波姆)和分散介质液相(水)组成,具有较高的水溶性,卡波姆是一种聚丙烯酸聚合物,能够形成高粘度的晶状透明凝胶,凝胶储留液体粘附于角膜表面,泪液的盐分使其破坏并释放水分,从而起到缓解干眼症症状的作用。rhEGF是一种外源性表皮生长因子,能够促进内源性表皮生长因子与外源性表皮生长因子相结合,刺激泪腺细胞增殖、分裂,维持角膜上皮完整性,从而促进角膜上皮修复,减少角膜损伤,增加泪液分泌,起到改善干眼症症状的作用。
本研究中,观察组总有效率(94.00%)高于对照组(78.00%),与李俊杰等[6]研究结果一致,说明rhEGF联合卡波姆眼用凝胶治疗PHACO后干眼症的效果显著。可能原因为:卡波姆眼用凝胶能够模拟人体泪液的生理功能,通过均衡释放凝胶中的水分达到维持泪液分泌的作用,从而缓解干眼症症状,同时联合rhEGF能够补充患者体内缺乏的内源性表皮生长因子,促进角膜上皮细胞的增殖、分裂,加快创面愈合,提高角膜上皮细胞损伤的修复质量,从而提高临床疗效[7,8]。
泪膜稳定性破坏是PHACO后干眼症的核心机制,SIT、BUT、泪膜厚度是临床上反映泪膜功能及稳定性的常用指标。本研究中,治疗后观察组SIT、BUT、泪膜厚度均大于对照组(P<0.05),说明rhEGF联合卡波姆眼用凝胶能够提高PHACO后干眼症患者的泪膜稳定性。分析原因:卡波姆眼用凝胶具有较高的水溶性,其生理功能与泪膜的水层、黏液层、黏蛋白层的脂质三层结构类似,能够维持眼部湿润,提高泪膜稳定性,同时联合rhEGF特异性作用于损伤角膜处,激活组织细胞修复机制,促进角膜基质的增殖、分化,间接提高结膜上附着的泪膜稳定性[9,10]。
干眼症患者由于缺乏泪液,失去蛋白质和细胞因子的眼表屏障保护,容易发生感染。PHACO后的应激反应导致机体花生四烯酸等炎症因子大量释放,高渗泪液激活炎症级联反应而引发炎症介质释放,氧化应激反应产生氧自由基并激发炎症反应,进一步损害眼表上皮细胞,加重泪液的蒸发及泪膜的不稳定性[11,12]。本研究中,治疗后观察组IL-6、IL-1β、TNF-α、PDO、LPO水平低于对照组,SOD水平高于对照组(P<0.05),说明rhEGF联合卡波姆眼用凝胶能够降低PHACO后干眼症患者的炎症因子及氧化应激水平。
综上所述,rhEGF联合卡波姆眼用凝胶治疗PHACO后干眼症的效果显著,能够提高泪膜稳定性,降低炎症因子及氧化应激水平。
