生长调节剂对球孢白僵菌产孢和分生孢子性能的影响
2022-07-09曹伟平
曹伟平,甄 伟,陈 丹,丰 硕,宋 健*
(1.河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业部华北北部作物有害生物综合治理重点实验室,保定 071000;2.河北小五台山国家级自然保护区管理局,张家口 075700)
球孢白僵菌Beauveriabassiana因其广泛的宿主范围和感染不同昆虫的毒力多样性,被世界各地广泛应用于农林害虫的生物防控[1],在我国已成功用于防治马尾松毛虫DendrolimuspunctatusWalker、天牛、玉米螟、金龟子等多种害虫,是目前我国农业生产中发展有机绿色产品的首选生物药剂之一。以白僵菌为活性成分注册登记的药剂呈现逐年增加的趋势,截至2019年,我国微生物农药共登记468个产品,其中白僵菌产品为23种。产孢量和孢子性能是发酵生产的重要指标,但不同的白僵菌菌株产孢能力存在明显差异。
培养基是影响孢子形成和产孢量的关键因子,丰富的氮源可以促进菌丝的生长并能增加菌苔厚度,还有利于白僵菌孢子的萌发[2];如果营养物质供给不足,容易衰老退化,出现菌落局变、菌苔生长瘠薄或菌丝徒长的现象,导致分生孢子产率下降[3],针对营养物质包括碳氮源[4-6]、维生素、无机盐[7,8]和微量元素[9,10]等对真菌无性生殖的研究已有较多报道。研究还发现,不同产孢培养基上分生孢子产孢量和毒性方面有显著差异[11]。李会平等[12]把白僵菌菌株多次接种于桑天牛Aprionagermari幼虫,可以提高白僵菌对桑天牛幼虫的侵染力,而在 SDAY培养基多次传代培养得到的白僵菌,对桑天牛幼虫的侵染力则有所降低。张慧等[6]在培养基中添加蝉蜕或西花蓟马虫尸粉,白僵菌产孢量会随培养代数呈现指数上升。关兵兵等[13]发现白僵菌在蝉蜕诱导培养基上的产孢量显著高于PDA培养基,且与产孢相关的蛋白表达上调,体现出一定的毒力相关性。除营养因素外,很多学者针对真菌进行了诱导产孢的相关研究,如采用菌丝损伤法[14-16]、光照射法[17,18]、变温处理法[19]诱导番茄早疫病菌Alternariasolani产孢;菌丝损伤处理和紫外线照射法诱导辣椒褐斑病Cercosporacapsici产孢[20];蓝光照射法诱导绿僵菌Metarhiziumanisopliae产孢[21]等,均可显著提高产孢量。
生长调节剂是一类与激素具有相似生理和生物学效应的物质,具有调控植物等生长和发育的功能物质,Kamisaka等[22]发现培养基中添加浓度为10~200 mg/L的赤霉素(GA3)可以促进葡萄酒酵母菌Saccharomy ceselliptoideiis产孢,超出此范围的GA3对酵母菌产孢量造成了不同程度的减少,而5~400 mg/L的生长素IAA、2,4-d和NAA均抑制酵母菌的产孢。在从枝菌根Abruscularmycoihrrazs生长过程中外施激素吲哚乙酸(IAA)、GA3和6-苄氨基腺嘌呤(6-BA)对从枝菌根的侵染、产孢均有不同程度的影响[23,24]。笔者实验室筛选到了对华北大黑鳃金龟Holotrichiaobeita和暗黑鳃金龟Holotrichiaparallela幼虫高毒力的球孢白僵菌菌株JG-17(文章待发表),试验发现,JG-17在SDAY培养基上菌丝茂盛,产孢周期长,产孢量低,为了提高产孢量,研究了外施生长调节剂对白僵菌产孢的诱导作用,明确生长调节剂促进白僵菌产孢的适宜用量和应用时期,为提高白僵菌发酵生产效率提供理论依据和技术参数。
1 材料和方法
1.1 供试菌株及生长调节剂
球孢白僵菌菌株 JG-17(以下简称白僵菌),由河北省农林科学院植物保护研究所杀虫微生物实验室分离保存。在SDAY平板培养基(牛肉蛋白胨1%、葡萄糖4%、酵母浸粉1%、定容1000 mL、琼脂1.6%、自然pH,121 ℃灭菌30 min)上接种,(26±1)℃培养20 d,收集孢子粉,4 ℃保存备用。
生长调节剂:97%萘乙酸(NAA,Solarbio,溶于丙酮),98%二氯苯氧乙酸(2,4-d,北京金泰宏达生物科技有限公司,溶于乙醇),99% 6-苄氨基腺嘌呤(6-BA,Solarbio,溶于乙酸),99%脱落酸(ABA,Solarbio,溶于乙醇),98%吲哚乙酸(IAA,Solarbio,溶于丙酮),90%赤霉素(GA3,Solarbio,溶于乙醇),85%乙烯利(上海源叶生物科技有限公司,溶于水),除乙烯利外,其余几种物质均用少量有机溶剂溶解后,再用蒸馏水稀释,常温放置备用,使用前用0.22 μm微孔过滤器灭菌。
1.2 球孢白僵菌发育进程的观察
将白僵菌JG-17孢子粉置于装有玻璃珠的灭菌0.1% Tween -80溶液的三角瓶中,摇床180 r/min振荡分散均匀,血球计数板计数并稀释得到1×107孢子/mL的孢悬液。取100 μL涂布于SDAY平板上,然后将灭菌盖玻片30度角斜插入平板上,以便生长的菌丝延伸到盖玻片上。将平板放置于(26±1)℃、RH 60%±10%、黑暗条件下培养,分别于0、1、2、3、4、5、6、7、8、9、10、11 d小心取下盖玻片,于40×光学显微镜下观察菌株发育特征;并取培养144、168、192、216、240、264、288、312、336、360、384 h的平板,使用内径为5.0 mm的打孔器,于平板1/2半径的圆上等距离打孔,取5个菌饼,置于有5 mL灭菌0.1% Tween -80溶液的试管中,漩涡器上充分振荡,双层纱布过滤,稀释适当倍数后用血球计数板计数,计算单位面积产孢量,每个时间段取3个平板进行计数。计算式为产孢量Q=X×N×5×104/nπr2(其中X为稀释倍数,N为5中格内的孢子计数,n为打孔菌饼数,r为打孔器内径),制作产孢量随时间变化曲线。
1.3 生长调节剂的筛选
将SDAY培养基倒入平板待培养基冷却凝固后,将生长调节剂溶液通过0.22 μm微孔过滤器灭菌,用Potter喷雾塔(在无菌操作间进行,使用前喷雾塔的喷头和喷台用75%酒精消毒)将生长调节剂溶液均匀喷洒在SDAY培养基表层,使其在培养基表层的剂量为20、100、1000 ng/cm2,以未喷施生长调节剂的培养基作为空白对照。移液器吸取5 μL浓度为1×107孢子/mL孢悬液,点接于SDAY平板培养基上,在(26±1)℃下培养。每隔2 d用游标卡尺测量菌落生长直径,共测定10 d,以最小二乘法计算各个处理下白僵菌菌落的生长速率。培养至第16 d测定产孢量,方法同1.2。
1.4 菌株JG-17不同生长阶段施用乙烯利
同方法1.2,吸取1×107孢子/mL JG-17孢悬液100 μL均匀涂布于SDAY平板上,置于(26±1)℃、黑暗条件下培养,在白僵菌JG-17营养生长阶段(5~7 d菌龄)、生殖生长初期(8~9 d菌龄)和生殖生长阶段(10~14 d菌龄),利用喷雾塔在菌丝表层施用不同剂量的无菌乙烯利溶液,喷施剂量为20、40、80、100、200、500、1000、1500 ng/cm2,每处理3次重复,设置未处理对照,各处理置于(26±1)℃下恒温培养至第16 d时测定产孢量,方法同1.2。
1.5 孢子活力及抗逆性检测
1.5.1 孢子萌发率测定 对促进JG-17产孢效果明显的乙烯利处理浓度,培养至第16 d后,分别收集各处理平板的分生孢子,使用灭菌0.1%(v/v)Tween -80溶液配置较高浓度母液,再稀释配成浓度为1×107孢子/mL的孢悬液,取100 μL涂布接种于SDAY平板,于(26±1)℃恒温培养,于24 h后在40×光学显微镜下统计孢子萌发率,用最小二乘法计算50%孢子萌发所需的时间GT50[25,26]。分生孢子芽管长度大于其直径的1/2视为萌发,每处理重复3次。
1.5.2 耐热性测定 吸取1.5.1中浓度为1×107孢子/mL孢悬液0.5 mL置于1.5 mL离心管中,于50 ℃恒温水浴处理5 min后,吸取100 μL涂布接种于SDAY平板上,(26±1)℃恒温培养24 h后,测定萌发率,分生孢子萌发标准同1.5.1,每处理重复3次。
1.5.3 耐紫外线测定 取1.5.1中浓度为1×108孢子/mL孢悬液300 μL滴在灭菌盖玻片上,待风干后置于8 W紫外灯下距离30 cm照射5 min,然后将载有孢子的盖玻片置于黑暗处放置30 min。用3 mL无菌0.1% Tween-80溶液充分洗涤盖玻片上的分生孢子,使其分散均匀后取100 μL涂布于SDAY平板上,(26±1)℃恒温培养24 h后,测定最终萌发率,分生孢子萌发标准同1.5.1,每处理重复3次。
1.6 生物测定
将1.5.1中孢悬液母液稀释至浓度为5×107孢子/mL,测定JG-17菌悬液对华北大黑鳃金龟和暗黑鳃金龟幼虫的致病力。生测方法:将规格为高100 mm×直径15 mm指形管在电热恒温鼓风干燥箱175 ℃灭菌2 h,每个指形管底部放入1.5 cm3大小土豆块作为幼虫饲料,细土曝晒过筛后,加水混匀,使其湿度为18%~20%,细土装至指形管四分之三处,作为幼虫处置室。挑取健康活泼、大小一致的2龄金龟子幼虫,将试虫逐头浸没在JG-17孢悬液中5 s,取出后放在滤纸上吸去多于水分后放入幼虫处置室中,待试虫钻入土中后在幼虫处置室口塞入灭菌棉球,如有长时间未钻入土中的试虫,将其取出并挑取新的幼虫重新在相应的JG-17孢悬液浸没处理,至所有处理幼虫均钻入土中。每个幼虫处置室放置1头幼虫,每处理设3次重复,每重复10头试虫。试虫置于27 ℃下饲养,施药后定期检查蛴螬死虫数,将死虫挑出后保湿处理,待其体表长出白色菌丝体视为菌株JG-17侵染致死。计算死亡率和校正死亡率:死亡率(%)=死虫数/试虫数×100;校正死亡率(%)=(处理组死亡率—对照死亡率)/(100—对照组死亡率)×100。
1.7 数据统计与分析
采用Excel计算平均值±标准差,采用SPSS 18.0软件中的Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 球孢白僵菌菌株JG-17发育时段
白僵菌菌株JG-17分生孢子接种在SDAY培养基上经历萌发、芽管、菌丝及产孢四个发育阶段(图1)。孢子在培养基上首先吸水膨大,之后伸出芽管,以分生孢子芽管长度大于其直径的 1/2视为萌发。JG-17分生孢子为(1.7~2.2)μm×(3.6~5.3) μm的短柱状(图1a);培养1 d时,多数孢子已萌发,从一端或两端伸出芽管(图1b);2~3 d时,菌丝致密成团,呈现树状分支,边缘菌丝延展(图1c);生长至4~5 d时,培养基平板上有可见白色菌落,边缘菌丝继续延展,菌丝出现弯曲交接(图1d);生长至6~7 d,菌落更加致密,菌丝体出现明显分隔(图1e);生长至8~9 d时,显微镜下可看到较多的具有分支的瓶型分生孢子梗,视野里仍为大量致密菌丝体,可见极少量分生孢子(图1f);10~11 d时,显微镜视野内观察到分生孢子长链及较多量的孢子(图1g);12 d时,视野内分生孢子逐渐增多(图1h),平皿菌落表面为厚实的白色絮状菌丝,未见明显的孢子层(图2)。产孢量的检测结果表明(图3),培养216 h时,有极少量孢子产生,产孢量为1.0×105孢子/cm2;240 h时,产孢量为8.0×105孢子/cm2;之后,产孢量逐渐上升,264~312 h,为分生孢子形成快速上升期;312 h时,产孢量为6.5×106孢子/cm2,达到产孢量的83%;336 h后,产孢量上升速度有所减缓,产孢量趋于稳定。

图1 球孢白僵菌JG-17不同发育阶段Fig.1 The development stages of B.bassiana strain JG-17

图2 球孢白僵菌JG-17菌落特征Fig.2 Morphological characteristics of strain JG-17

图3 球孢白僵菌JG-17不同生长阶段的产孢量Fig.3 Conidiation abundance at different growth stages of B.bassiana strain JG-17
从形态观察和产孢量分析,菌株JG-17发育24 h前为萌发期,48~168 h为菌丝快速生长期,216 h为产孢前期,240 h为产孢初期,264~312 h为产孢盛期,336 h后进入产胞末期。
2.2 生长调节剂对球孢白僵菌JG-17生长发育的影响
菌株JG-17在含有生长调节剂的SDAY平板培养基上生长时(表1),除6-BA显著抑制菌株JG-17的生长发育,其余5种生长调节剂的3个使用剂量均没有显著影响JG-17的生长,生长速率和未处理对照均没有显著差异(P>0.05);从单位面积产孢量来看,生长调节剂剂量为20 ng/cm2和100 ng/cm2时,各处理二者之间的孢子数量差异不显著(P>0.05),当剂量增加到1000 ng/cm2时,各处理产孢量在数值上表现为下降趋势;100 ng/cm2的乙烯利可以显著促进菌株JG-17产孢(P<0.05),相比未处理对照产孢量提高了97.3%。

表1 生长调节剂对球孢白僵菌JG-17生长发育的影响Table 1 Effect of plant growth regulators on the growth and development of B.bassiana strain JG-17
2.3 在不同生长阶段施用乙烯利对球孢白僵菌JG-17产孢速度和产孢量的影响
在球孢白僵菌 JG-17营养生长阶段和生殖生长初期喷施乙烯利,可显著缩短 JG-17产孢时间,提高JG-17产孢水平。在菌丝表层施用乙烯利,第二天镜检即有可见孢子,而未施用乙烯利的对照,第10 d进入产孢阶段。从乙烯利施用剂量来看,20~1500 ng/cm2乙烯利对JG-17产孢均有不同程度的促进作用,80~500 ng/cm2乙烯利处理的产孢量相对更优,其中100 mg/cm2的乙烯利处理,产孢量最高,1500 ng/cm2处理所得的产孢量最低。从施用时期来看,在菌株JG-17生殖生长初期(8 d菌龄)施用乙烯利最有利于促进产孢,最高产孢量为未处理对照的6.28倍(表2)。在生殖生长阶段施用乙烯利,各处理的最高产孢量为未处理对照的2.84倍,低于在营养生长阶段和生殖生长初期的处理,且随着菌龄的增加,所有施用剂量处理后的产孢量均呈现出逐渐降低的趋势(表3)。

表2 营养生长阶段和生殖生长初期喷雾施用乙烯利对球孢白僵菌JG-17产孢量的影响Table 2 Effect of ethephon used at mycelial growth and begining of the forming sporulation stage on B.bassiana strain conidial production

表3 生殖生长阶段喷雾施用乙烯利对菌株JG-17产孢量的影响Table 3 Effect of ethephon used at forming sporulation stage on strain JG-17 conidial production
2.4 乙烯利对球孢白僵菌JG-17分生孢子活力和抗逆性的影响
进一步测定乙烯利剂量20~1500 ng/cm2处理菌株JG-17 8 d菌龄所得分生孢子的活力和抗逆性,结果表明,乙烯利剂量20~1500 ng/cm2对分生孢子的萌发率和萌发速度没有明显的影响。菌株JG-17耐热性较差,所有处理50 ℃恒温5 min均大幅度降低孢子的萌发率,萌发率均不及未处理所得孢子的25%,各处理之间差异不显著(P>0.05),初始观察到孢子萌发的时间均延长到42 h之后;紫外线照射极大降低了菌株JG-17分生孢子的萌发率,所有处理孢子的萌发率均不及未处理孢子的15%,各处理之间差异不显著(P>0.05),孢子初始萌发时间延长到了60 h之后(表4)。

表4 乙烯利处理对球孢白僵菌JG-17分生孢子活力和抗逆性的影响Table 4 Effect of ethephon on the viability and stress tolerance of B.bassiana strain JG-17 conidia
2.5 蛴螬接种球孢白僵菌JG-17孢子悬浮液后幼虫死亡率的变化
蛴螬感染白僵菌JG-17后,初期行动呆滞,身体呈萎靡状态,虫体死亡初期,身体僵硬呈“C”形,身体开始变硬,之后变为暗红色,保湿放置2~3 d后虫体长出白色绒毛状菌丝(图4)。菌株JG-17经不同剂量乙烯利处理后获得的分生孢子对华北大黑鳃金龟和暗黑鳃金龟两种幼虫的侵染趋势均基本保持一致,1000 ng/cm2和1500 ng/cm2两个剂量处理的菌株JG-17孢子对两种金龟子幼虫的累计死亡率虽然低于其余乙烯利处理和未处理对照,但差异不显著(P>0.05)(图5);100 ng/cm2和200 ng/cm2乙烯利处理菌株JG-17对华北大黑鳃金龟幼虫的致死效率没有影响,LT50与未处理对照接近,1500 ng/cm2乙烯利在一定程度上影响了对华北大黑鳃金龟幼虫的致死效率,LT50较未处理对照延长了2.6 d;各剂量乙烯利对暗黑鳃金龟幼虫的致死效率没有明显影响,与未处理对照的LT50较为接近(表5)。

表5 球孢白僵菌JG-17对华北大黑鳃金龟和暗黑鳃金龟幼虫的LT50Table 5 LT50 of B.bassiana strain JG-17 to larvae of H.obeita and H.parallela

图4 球孢白僵菌JG-17感染的蛴螬Fig.4 The grubs infected by B.bassiana strain JG-17
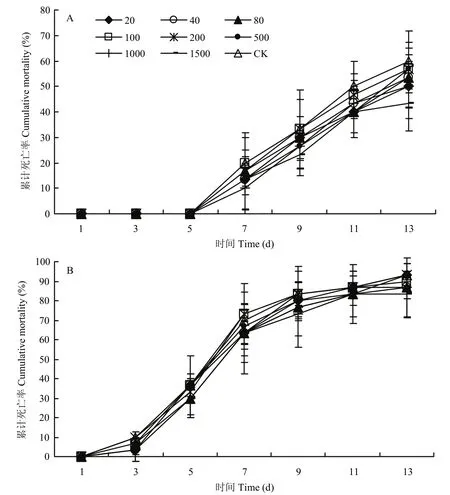
图5 蛴螬接种乙烯利处理后的球孢白僵菌JG-17孢悬液的累计死亡率Fig.5 Cumulative mortality of grubs inoculated with conidia suspension of B.bassiana strain JG-17 treated by different dosage of ethephon
3 讨论
乙烯利作为一种优良生长激素具有增强促进细胞中核糖核酸和蛋白质合成的作用,对植株的营养生长和生殖生长有一定的影响作用,常用于促进植株老叶脱落、果实的着色和成熟。本研究表明,对于在SDAY上不易产孢的白僵菌菌株 JG-17,在营养生长阶段和生殖生长初期,通过外源法在菌丝体表层喷施20~500 ng/cm2的乙烯利,均可显著提升菌株JG-17的产孢量,以192 h菌龄施用100 ng/cm2处理产孢量最佳,产孢量为未处理对照的 6.28倍;在生殖生长阶段喷施乙烯利,仅当乙烯利施用量为 100 ng/cm2和200 ng/cm2的处理可以显著提高产孢量,但产孢量也明显低于营养生长阶段和生殖生长初期的同水平处理,其余处理反而降低了产孢量。何雪娇等[27]应用乙烯利可促进蕨类植物高山羊齿的生殖生长,提高了高山羊齿的产孢率;刘思俭等[28]研究发现在较低浓度可以刺激海藻类江篱孢子的萌发,但高浓度则导致植物体死亡。本试验印证了合理的乙烯利浓度可以促进真菌的生长发育。
在不同营养条件下产生的真菌孢子与目标害虫具有不同程度的毒力,真菌孢子抗逆性会有所差异[25,29]。乙烯利处理菌株JG-17所得孢子的活孢率、耐热性和耐紫外线能力与对照没有显著差异,对靶标害虫华北大黑鳃金龟和暗黑鳃金龟幼虫的致病力也没有显著影响,表明在发酵过程中外施乙烯利可以作为一种促进白僵菌产孢的有效手段。
影响真菌产孢的因素较多,在菌株生长过程中通过外界刺激法诱导产孢对于真菌发酵是一种简便易行的发酵技术,前人在促进真菌产孢方面进行了很多尝试和研究,刘丽丽等[30]对7株茄链格孢Alternariasolani菌株在培养7 d后通过刮除气生菌丝法(菌丝损伤)可抑制气生菌丝的营养生长,使其转为生殖生长,使得产孢量极显著增加,相比未经菌丝损伤的处理,产孢量最高可提高342.9倍。郭春秋等[31]对10种在常规人工培养基上只形成营养菌丝体而不产生繁殖孢子的真菌进行了扫刷营养体的处理,其中2种真菌经扫刷营养体可诱导产孢。通过喷雾塔在菌丝体表层施用乙烯利,不排除气流所产生的冲击对于菌丝体存在一定的损伤作用,通过外源法引入乙烯利促进白僵菌孢子产生的机制以及乙烯利的利用效率和代谢产物对农作物生长的影响还有待进一步研究。
一定剂量范围的乙烯利可以显著促进白僵菌孢子的形成及脱落,缩短白僵菌繁殖周期,极大地提高白僵菌分生孢子的生产效率,且喷施乙烯利使用形式方便,发酵基质可以为平板培养基,也可以是其他形式的固体培养基,是一种改善有益病原真菌发酵工艺的优良方法。试验结果可应用到更多的菌类研究和制剂化生产中,为提升真菌等有益菌株的工业化生产效率提供了新的思路。
