红枣多糖的提取工艺及药理活性研究
2022-07-08王佩佩同美霖毛跟年陈福欣
龚 频,王佩佩, ,同美霖,龙 辉,毛跟年, ,陈福欣
(1.陕西科技大学食品与生物工程学院,陕西西安 710021;2.西安科技大学化学与化工学院,陕西西安 710054)
红枣(Ziziphus jujubeMill.)是鼠李科枣属植物,广泛分布在南亚、东亚及澳大利亚等地区[1]。我国的枣属植物品种约700 余种,主产于西北地区、黄河流域地区及东部地区[2]。《黄帝内经》中将红枣列为最具有价值的“五果”之一,《神农百草经》中称红枣为上乘草药。红枣果实中富含维生素C、多糖[3−4]、酚酸[5]、黄酮类化合物[5−6]、三萜类化合物[6−8]、环核苷酸[9]和氨基酸等代谢物。众多研究表明红枣多糖是红枣中丰富且具有药理活性的主要成分之一[10],现已报道的红枣多糖的单糖组成包括鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和糖醛酸半乳糖醛酸和葡萄糖醛酸[11],发挥降糖、抗肿瘤[12]、胃肠保护[13−14]、免疫调节[15]及保肝[16]等药理活性。
目前对多糖的提取多采用热水提取(HAE)、超声辅助提取(UAE)[17]、酶辅助提取(EAE)及微波辅助提取(MAE)[18−19]等方法。超声提取是借助超声波的热效应、机械效应及空化效应破坏红枣的细胞壁,增加多糖分子的溶出速度,因其具有操作简便、提取效率稳定、不影响成分结构及活性等优点,广泛地应用于各类植物中化合物的提取。近年来超声辅助提取方式被广泛应用于红枣多糖的提取,Ji 等[20]采用超声辅助双水相萃取(UAATPE)一步法提取大枣多糖,并通过单因素实验和响应面法优化多糖得率。黎云龙等[21]通过优化超声波辅助提取法提取骏枣多糖,确定最佳提取条件,为后续研究提供理论参考。李栋等[22]通过比较不同提取方式对多糖得率的影响,结果表明超声辅助提取方式明显优于回流提取、复合酶提取等方式。Li 等[23]研究发现超声辅助提取将多糖的产率从6.23%提高至7.95%,而且获得的多糖成分不被破坏。因此,超声辅助提取具有良好的应用前景。
本研究采用单因素实验对红枣多糖超声辅助的条件进行优化,对提取中的水浴时间、料液比、超声时间和超声功率进行了考察,利用响应面法进行优化分析。同时通过测定DPPH 自由基、羟基自由基清除能力及还原力探索红枣多糖的抗氧化能力。此外,通过测定红枣多糖对α-淀粉酶和α-葡萄糖苷酶抑制率以考察其降糖活性,研究发现其降糖活性具有明显的量效关系,而关于其降糖机制鲜有报道,因此本研究进一步通过体外实验结合分子生物学技术(WB)探究红枣多糖缓解胰岛素抵抗引起的肝损伤的作用机制。因此,红枣多糖可作为一种潜在药食同源的抗氧化剂或功能性食品,为进一步将红枣多糖开发为抗氧化产品以及降糖产品提供理论和实践基础。
1 材料与方法
1.1 材料与仪器
沧州金丝小枣 河北沧州市;葡萄糖标品、无水乙醇、浓硫酸、30%过氧化氢、苯酚、水杨酸、DPPH、石油醚、铁氰化钾溶液 深圳市文乐生物科技有限公司;三氯乙酸、氯化铁溶液、α-葡萄糖苷酶溶液(50 U/mg)、α-淀粉酶(4 U/mg)、阿卡波糖、胰岛素、葡萄糖测试试剂盒 均购于上海源叶生物科技有限公司;pNPG 溶液 广州吉英生物科技有限公司;可溶性淀粉溶液、DNS 试剂 北京索莱宝科技有限公司;DMEM 深圳市益百顺科技有限公司;MTT 溶液 北京雪杰特科技有限公司;显影液 喀斯玛广州地化所共建仓储配送中心;HepG2 细胞株保存于本实验室;高糖DMEM 培养基、青霉素-链霉素双抗、胰酶(0.25%的酶活)、二甲基亚砜(DMSO)、噻唑蓝(MTT)粉末 均购于生工生物工程有限公司;胎牛血清 购于美国Gibco 公司;PI3K、p-PI3K、AKT、p-AKT、GAPDH 抗体、抗兔IgG 二抗 购于Santa Cruz 公司;PI3K 抑制剂LY294002 购于碧云天生物试剂有限公司。
T2600 紫外可见分光光度计 上海佑科仪器仪表有限公司;KQ-100DE 超声波清洗机 昆山市超声波仪器有限公司;HC-150T2 高速多功能粉碎机永康市绿可食品机械有限公司;TDL-40B 电子天平上海精密科学仪器有限公司;RE52CS 旋转蒸发仪上海亚荣生化仪器厂;H-1850R 台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;BBS-V800 超净工作台 山东博科生物产业有限公司;JXFSTPRP-24 恒温CO2培养箱 赛默飞世尔科技公司;Varioskanfiash 全波长扫描式多功能酶标仪 赛默飞世尔科技有限公司;FD-1D-50 真空冷冻干燥机 上海比郎仪器制造有限公司;TS10 荧光倒置显微镜 尼康仪器有限公司。
1.2 实验方法
1.2.1 红枣多糖提取方法 将新鲜红枣置于干燥箱中55 ℃烘干。将干燥的红枣片粉碎得到红枣粗粉。粗粉经石油醚浸泡48 h,除去脂溶性物质并通过萃取的方式去掉石油醚,然后进行水浴60 ℃[24]超声,经抽滤收集滤液,滤渣加入水后再次提取,合并两次所得滤液后用旋转蒸发仪浓缩[25]。采用Sevag 法[26]除去蛋白质,简要步骤为将复溶于水的粗多糖溶液置容量瓶中,以三分之一体积的Sevag 试剂(氯仿:正丁醇=4:1),反复震荡20 min,静置,保留上层清液。旋转蒸发除去剩余的氯仿、正丁醇和水,随后加入4 倍体积95%乙醇(95%)溶液醇沉多糖,4 ℃静置过夜。以4000 r/min 离心15 min,加入适量蒸馏水溶解沉淀后于−50 ℃真空冷冻干燥50 h 得红枣多糖(ZJP)。
1.2.2 多糖提取的单因素实验 称取经去脂处理的红枣粗粉2 g,按上述1.2.1 方法处理。料液比1:15,超声功率100 W,超声时间30 min 条件下,水浴时间分别为10、20、30、40 和50 min,研究水浴时间对多糖得率的影响;水浴时间40 min,超声功率100 W,超声时间30 min 条件下,料液比分别为1:5、1:10、1:15、1:20 和1:25,研究料液比对多糖得率的影响;料液比1:15,超声功率100 W,水浴时间40 min条件下,超声时间分别为10、20、30、40 和50 min,研究超声时间对多糖得率的影响;料液比1:15,水浴时间40 min,超声时间30 min 条件下,超声功率分别为60、70、80、90 和100 W,研究超声功率对多糖得率的影响。
1.2.3 响应面试验 采用响应面法优化提取工艺,以多糖得率为响应值设计四因素三水平的试验,试验因素和水平见表1。

表1 Box-Behnken 试验设计Table 1 Experimental design of Box-Behnken
1.2.4 红枣多糖得率测定 采用硫酸-苯酚法[27]测定红枣多糖含量,精密称取葡萄糖标准品和红枣多糖0.03 g 进行梯度稀释,分别向不同浓度的标准品溶液和红枣多糖溶液中加入5%苯酚溶液0.30 mL 及浓硫酸3.00 mL,静置15 min 后于490 nm 处测吸光度;然后根据标准品曲线计算红枣多糖含量,经三次平行实验,实验得葡萄糖标准曲线的回归方程为:y=0.0137x+0.0898;R2=0.9924。多糖得率的计算公式如下:
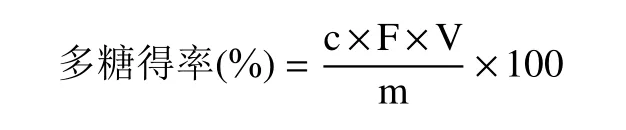
式中:c 为红枣多糖浓度,mg/mL;F 为稀释倍数;V 为多糖溶液的总体积(mL);m 为取红枣多糖质量(mg)。
1.2.5 红枣多糖中蛋白质含量测定 采用考马斯亮蓝法测定红枣多糖中蛋白质含量,制备不同浓度(0.0、5.0、10.0、15.0、20.0、25.0、30.0 μg/mL)的牛血清蛋白标准溶液和1 mL 红枣多糖溶液,加入2.00 mL 考马斯亮蓝溶液混匀,于595 nm 处测定吸光度[28],以牛血清蛋白标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,蛋白质标准曲线回归方程:y=0.009x+0.0234;R2=0.9931,多糖溶液测得吸光度值经标准曲线计算蛋白含量。
1.2.6 羟基自由基清除能力测定 采用水杨酸法测定羟基自由基清除能力,取2 mL 梯度浓度红枣多糖溶液并加入等体积等浓度(9 mmol/L)的FeSO4溶液与水杨酸-乙醇溶液,混匀后继续加入2 mL 8.8 mmol/L的H2O2溶液,在37 ℃下静置1 h 后取样在510 nm波长处测定吸光度,记为Ai。空白组以蒸馏水代替多糖溶液,吸光度记为A0。对照组以蒸馏水代替水杨酸-乙醇溶液,吸光度记Aj,按照公式计算清除率。此实验以VE为阳性对照。
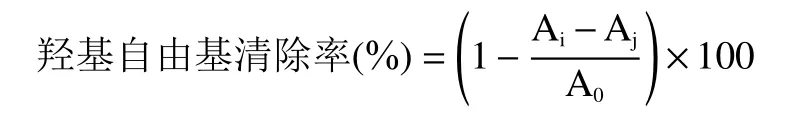
1.2.7 DPPH 自由基的清除能力测定 取梯度浓度红枣多糖溶液2 mL 并加入2 mL 0.05 mg/mL 的DPPH 溶液,在黑暗条件下静置30 min,于517 nm处测其吸光度Ai,以无水乙醇代替DPPH 测吸光度Aj,以蒸馏水代替多糖溶液测定A0。以VE作为阳性对照,按照公式计算清除率。
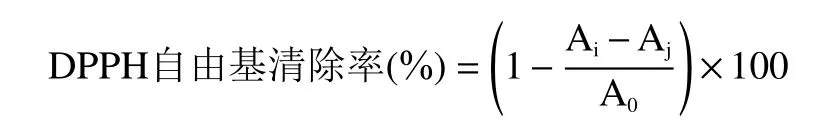
1.2.8 还原力测定 采用铁氰化钾法测定还原力,在0.5 mL 样品中加入2.5 mL 磷酸缓冲液(0.2 mol/mL,pH6.6)及2.5 mL 1%的铁氰化钾溶液,于50 ℃水浴20 min 后加入2.5 mL 10%三氯乙酸,静置10 min后加入0.5 mL 0.1%氯化铁溶液进行反应,10 min后于700 nm 处吸光值。
1.2.9 红枣多糖对α-葡萄糖苷酶抑制率的测定 以磷酸钾盐缓冲溶液(0.1 mol/mL,pH7.4)配制0.2 U/mL的α-葡萄糖苷酶溶液,将25 μL 的α-葡萄糖苷酶溶液和40 μL 的样品溶液进行水浴孵化10 min,再加入50 μL 的10 mmol/L pNPG 溶液水浴孵化30 min,最后加入90 μL Na2CO3溶液,于405 nm 波长下测定吸光度Ai,以缓冲液代替酶液测吸光度Aj,以蒸馏水代替多糖溶液测定A0。以阿卡波糖作为阳性对照,按照公式计算抑制率。
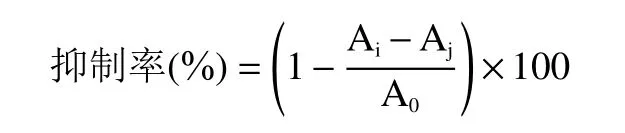
1.2.10 红枣多糖对α-淀粉酶抑制率的测定 以磷酸钾盐缓冲溶液(0.1 mol/mL,pH7.4)配制0.2 U/mL的-淀粉酶酶溶液,将25 μL 的α-葡萄糖苷酶溶液和25 μL 的样品溶液进行水浴孵化10 min,再加入25 μL的2 mg/mL 可溶性淀粉溶液水浴再孵化10 min,最后加入50 μL 的DNS 试剂(3,5-二硝基水杨酸,氢氧化钠,酒石酸钾钠),于沸水浴中反应5 min 后冷却至室温,于540 nm 波长下测定吸光度Ai,以缓冲液代替酶液测吸光度Aj,以蒸馏水代替多糖溶液测定A0。以阿卡波糖作为阳性对照,按照公式计算抑制率。
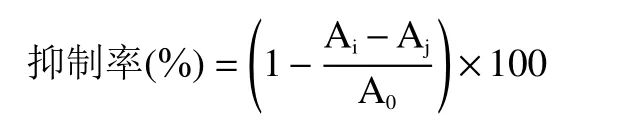
1.2.11 HepG2 细胞培养 将HepG2 细胞接种于培养瓶中,加入含10%胎牛血清及100 U/mL 青霉素-链霉素双抗的DMEM 高糖培养基,置于37 ℃、5%CO2的恒温培养箱中培养,取对数生长期的细胞进行试验。
1.2.12 HepG2 胰岛素抵抗细胞模型的建立 将红枣多糖配制成高浓度水溶液,微滤膜过滤后,用无血清DMEM 培养液稀释至所需浓度待用。
首先建立HepG2 胰岛素抵抗细胞模型[29−30],将对数期生长的细胞用含体积分数10%胎牛血清的DMEM 培养基调整细胞密度为105个/mL,转入96孔板中,每孔100 μL。待细胞单层贴壁后进行试验。加入新配制的含有10−7mol/L 胰岛素的培养液100 μL,并设无胰岛素的空白对照孔。用胰岛素溶液处理48 h 后分别将建模成功的细胞设为空白对照组、胰岛素抵抗模型组、二甲双胍组(0.01 mg/mL)、红枣多糖组(0.125、0.25、0.5、1.0 及2.0 mg/mL)。在培养箱孵育24 h 后,用葡萄糖试剂盒(葡萄糖氧化酶法)测定各孔培养液中葡萄糖的浓度,计算葡萄糖的消耗量。
同时进行MTT 毒性试验,在葡萄糖消耗试验结束将待测培养液移出后,每孔加入150 μL DMEM及2 mg/mL MTT 溶液50 μL 作用4 h,孵育完成后,吸弃上清液,每孔加入150 μL DMSO,震荡10 min使蓝紫色结晶溶解完全后,立即在酶标仪波长490 nm处测定吸光值。
1.2.13 免疫印迹法检测细胞中PI3K、p-PI3K、AKT及p-AKT 蛋白表达 将细胞培养于培养瓶中,加入新配制的含有10−7mol/L 胰岛素的培养液并处理48 h 后,并设无胰岛素的空白对照组。分别设空白对照组、胰岛素抵抗模型组、PI3K 抑制剂LY294002组(20 μmol/L)、红枣多糖组(1 mg/mL)及抑制剂联用红枣多糖组。孵育24 h 后,加入细胞裂解液抽提细胞总蛋白并测定蛋白浓度;将蛋白样品与等体积上样缓冲液混匀后置于沸水浴中煮沸5 min 变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜,以5%脱脂奶粉封闭2 h 后,加入按照1:1000 比例稀释的PI3K、p-PI3K、AKT、p-AKT 及GAPDH 一抗工作液4 ℃孵育过夜。经按照1:5000比例稀释的二抗工作液室温孵育2 h 后,以化学发光剂显影曝光显影。
1.3 数据处理
试验重复进行3 次,所有结果用均值±标准差表示;采用SPSS25.0 进行数据处理和分析;使用GraphPadPrism8.0.2 绘图;其中Design Expert 8.0 软件用于响应面试验方案设计以及分析。
2 结果与分析
2.1 单因素实验结果
如图1 所示,在水浴10~30 min 时,随着水浴时间的延长,多糖得率增加,水浴时间为30 min 时得率达到最大值。当水浴40~50 min 时,得率随时间的增加有所下降,这可能是由于其他水溶性杂质溶出原因。故水浴时间为30 min 最佳。
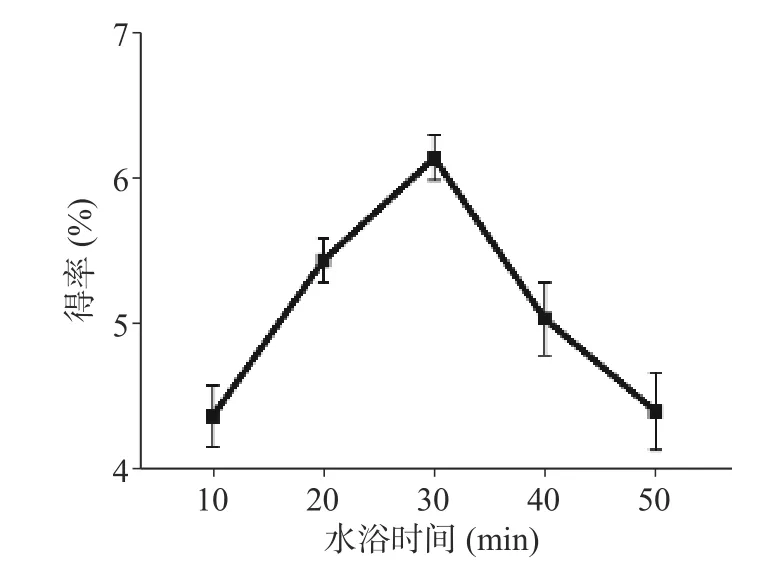
图1 水浴时间对多糖得率的影响Fig.1 Effect of water-bath incubation time on extraction rate of ZJP
当料液比为1:5~1:20 时,多糖得率随着料液比增大而增加。如图2 所示在1:20 g/mL 时多糖得率达到最大。在料液比为1:20 后随着料液比进一步增大但多糖提取率未持续增加,因此选择最佳料液比为1:20。如图3 所示,当超声时间从10 min 增加到40 min时,多糖的得率随着超声时间延长而上升,在超声40 min 时得率最高。然而过长的超声时间可能会导致多糖的降解和转化,因而确定40 min 为最佳超声时间。
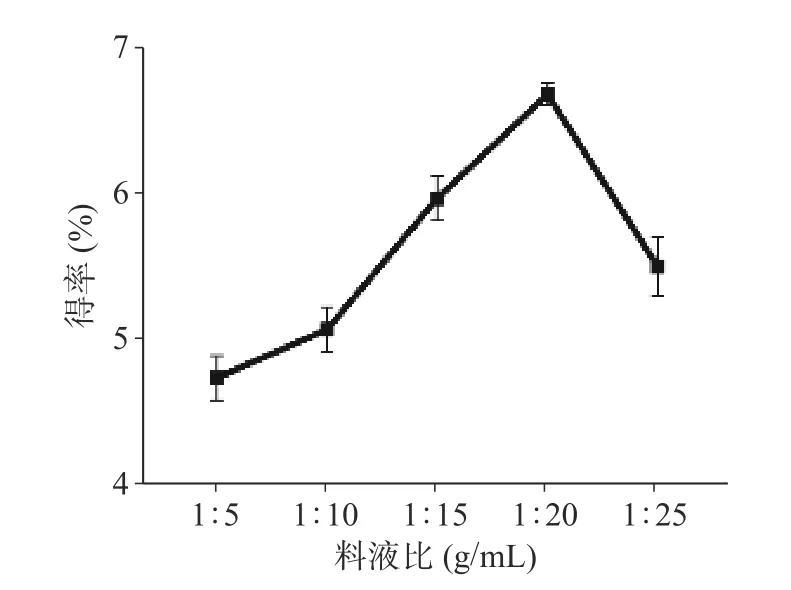
图2 料液比对多糖得率的影响Fig.2 Effect of solid-liquid ratio on extraction rate of ZJP
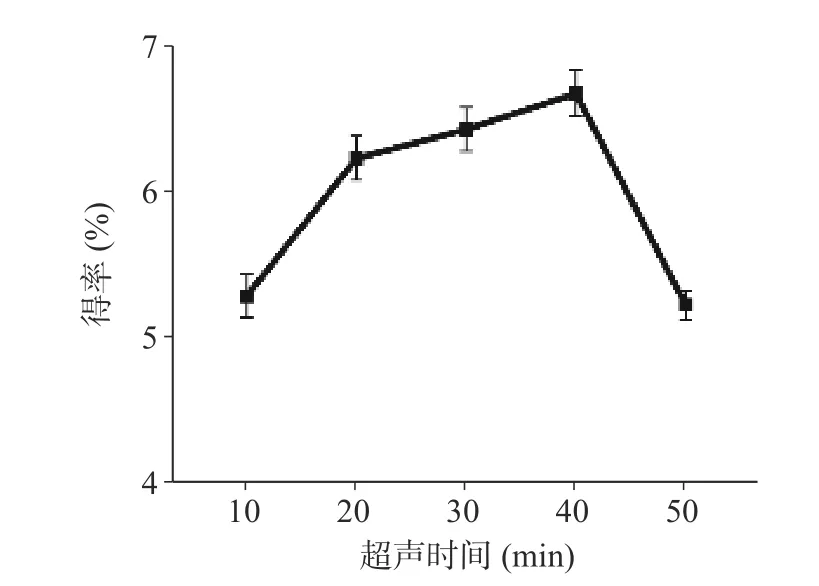
图3 超声时间对多糖得率的影响Fig.3 Effect of ultrasonic time on extraction rate of ZJP
如图4 所示,超声波功率为80 W 时,多糖得率最高为6.73%。然而,随着超声功率的进一步增加,多糖得率下降,这可能是因为较高的超声功率导致了多糖的降解,因此选择80 W 作为最佳提取超声功率。
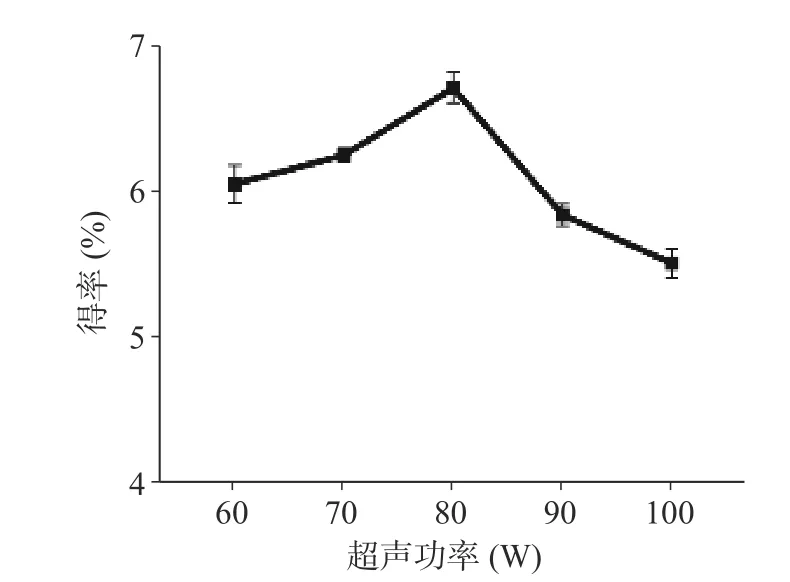
图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on extraction rate of ZJP
2.2 响应面试验
2.2.1 响应面设计及得率分析 通过响应面分析对红枣多糖提取工艺进行预测与优化,设计方案和结果见表2,利用DesignExpert 软件对试验数据进行回归拟合,可得到多糖得率Y 对各因素回归方程如下所示:
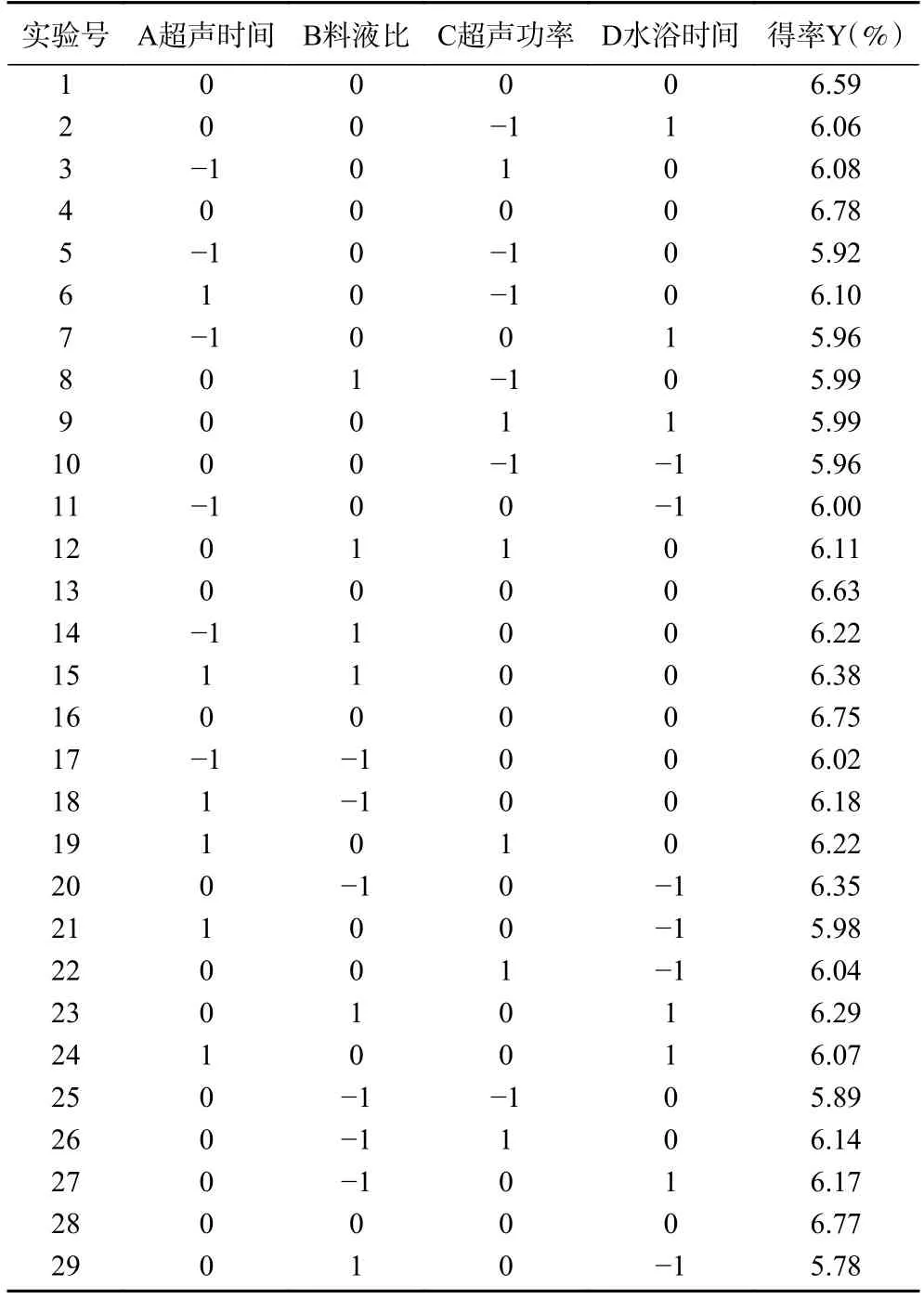
表2 响应面试验设计与结果Table 2 Design and results of response surface methodology
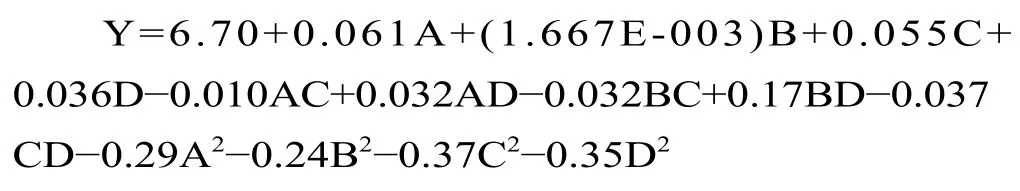
2.2.2 响应面方差分析及响应面图形分析 对多糖得率的回归模型进行方差分析,如表3 所示,回归模型P<0.0001,说明该模型具有极显著性;失拟项P=0.2184>0.05,表明失拟项差异不显著;决定系数R2=0.9026,说明实验值与预测值的一致性良好,该模型可用于多糖得率的分析和预测。通过F值可得,影响多糖得率的因素超声时间>超声功率>水浴时间>料液比。
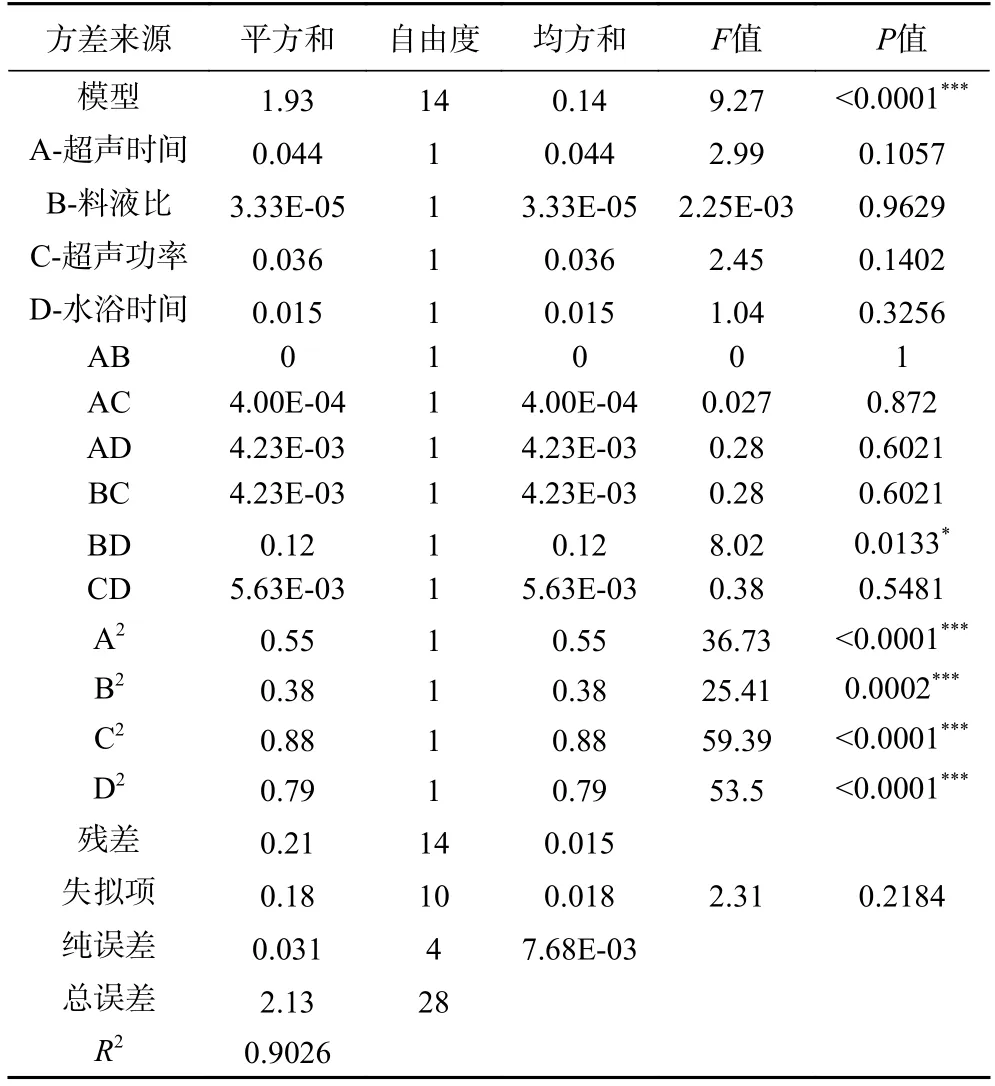
表3 响应面模型方差分析Table 3 ANOVA for response surface quadratic model
根据拟合模型绘制的多糖得率三维响应面和等高线图如图5~图10 所示。其中响应面越陡说明影响因素较为显著,等高线的形状则可反映出交互效应的强弱。如图9 所示,料液比和水浴时间两个坡度相对较陡,对多糖得率的影响呈二次抛物线状,说明料液比和水浴时间的交互作用对多糖得率的影响显著。
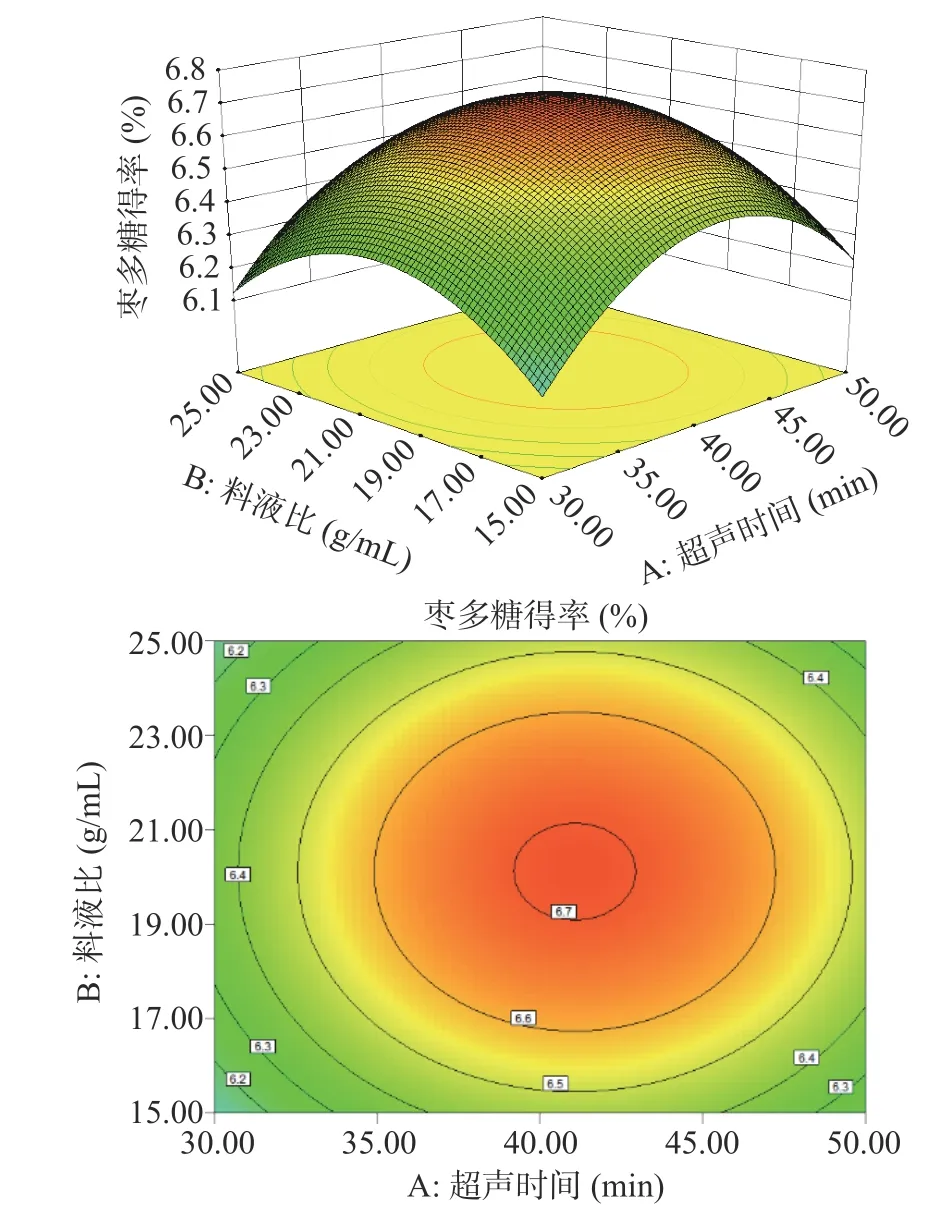
图5 超声时间(A)和料液比(B)对多糖得率的影响Fig.5 Effect of ultrasonic time (A) and solid-liquid ratio (B) on extraction rate of ZJP
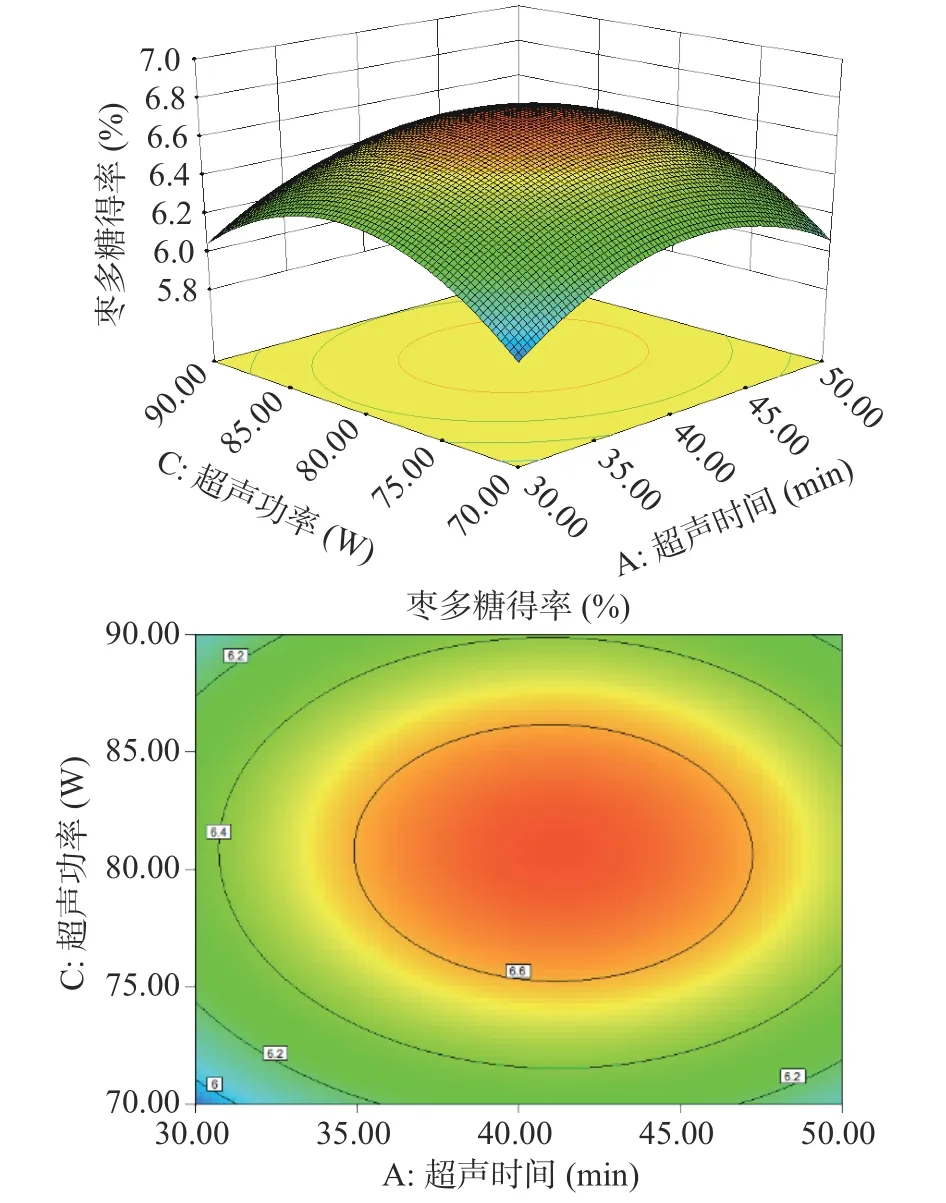
图6 超声时间(A)和超声功率(C)对多糖得率的影响Fig.6 Effect of ultrasonic time (A) and ultrasonic power (C) on extraction rate of ZJP
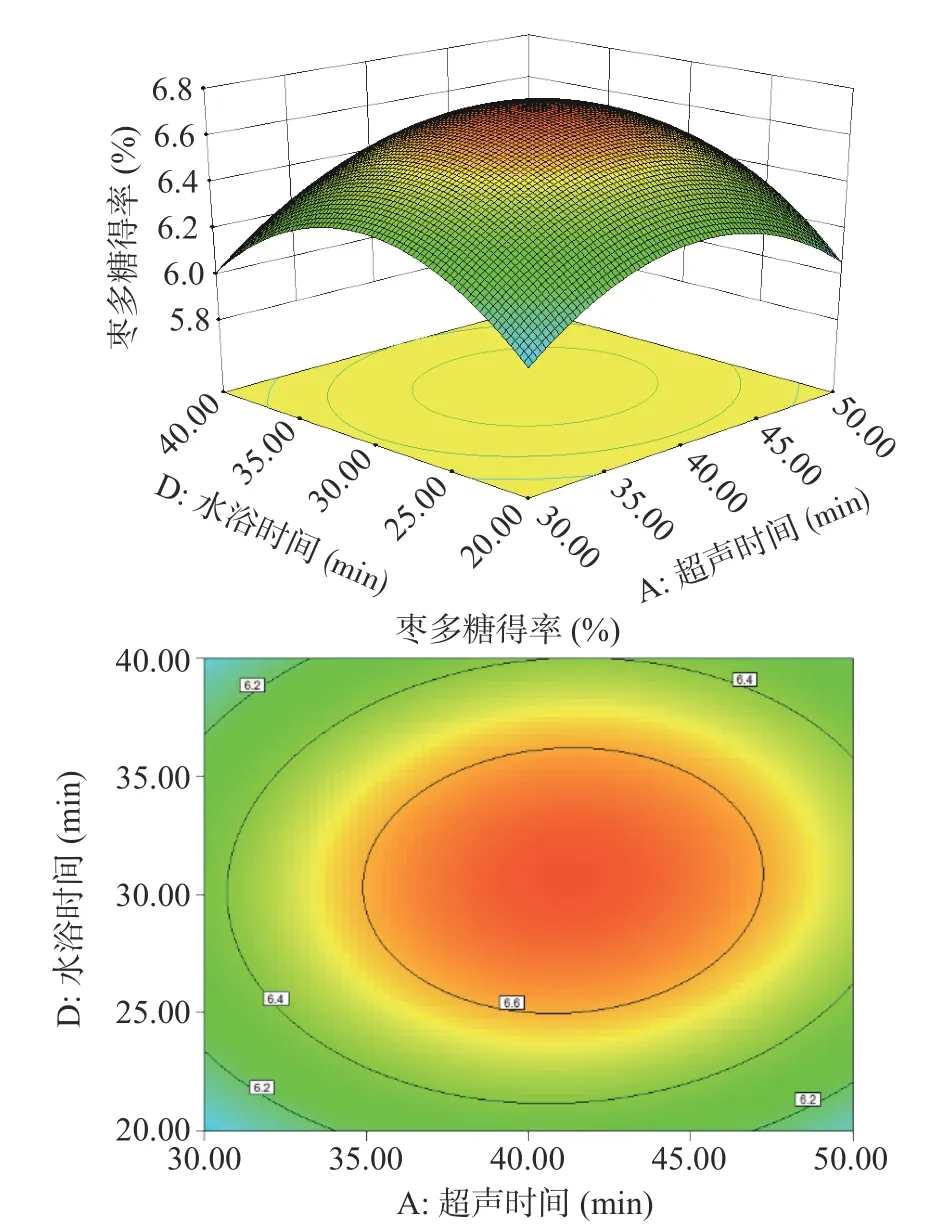
图7 超声时间(A)和水浴时间(D)对多糖得率的影响Fig.7 Effect of ultrasonic time (A) and water-bath incubation time (D) on extraction rate of ZJP
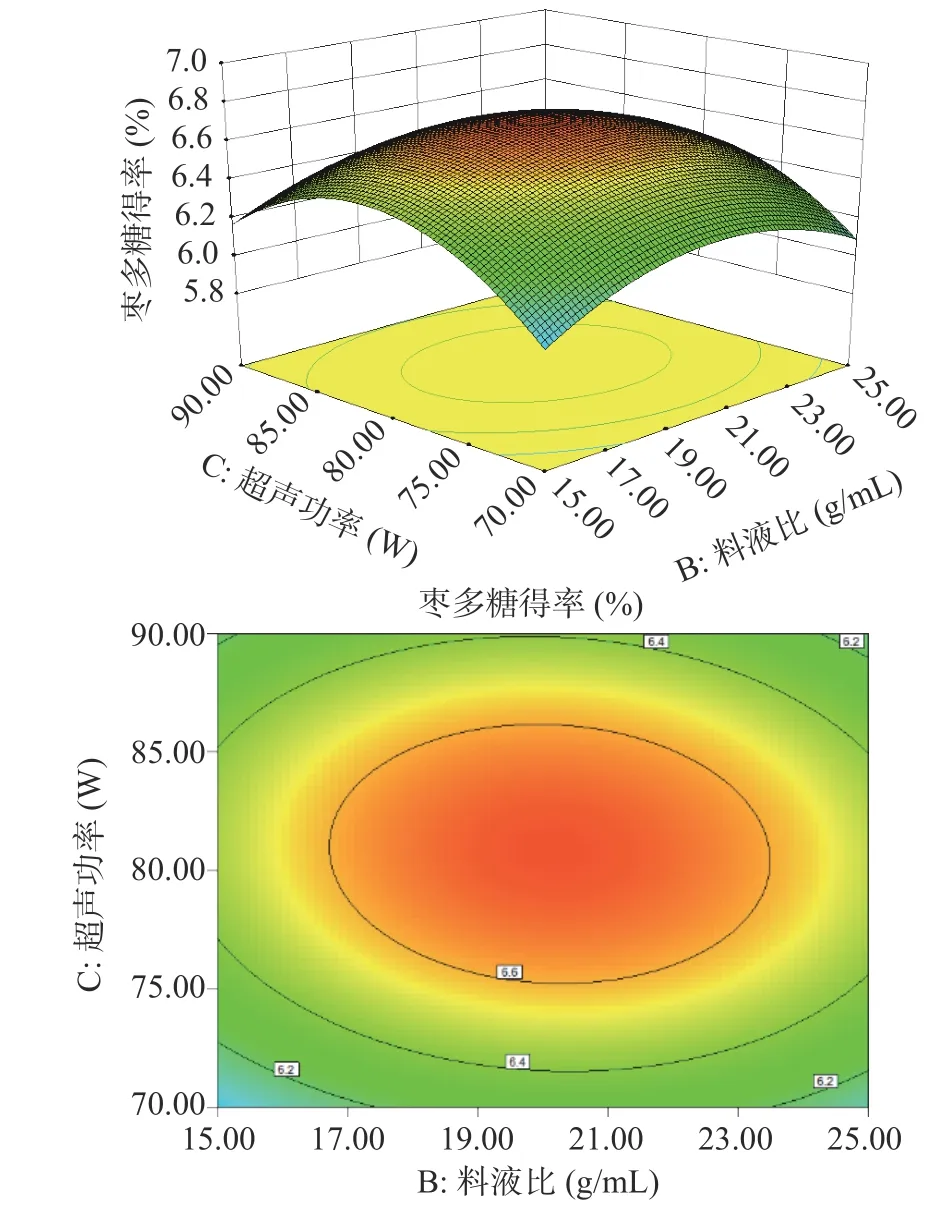
图8 料液比(B)和超声功率(C)对多糖得率的影响Fig.8 Effect of solid-liquid ratio (B) and ultrasonic power (C)on extraction rate of ZJP
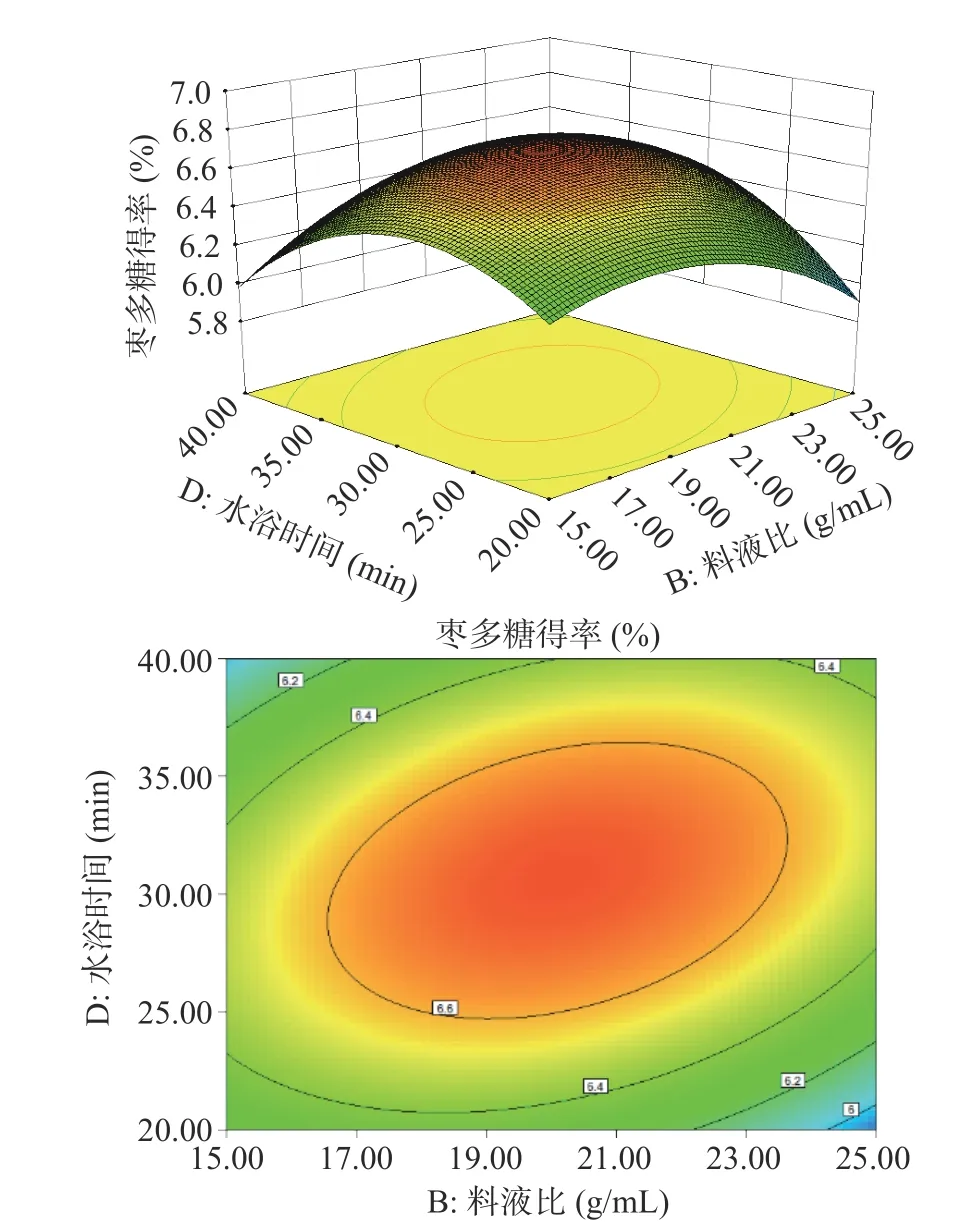
图9 料液比(B)和水浴时间(D)对多糖得率的影响Fig.9 Effect of solid-liquid ratio (B) and water-bath incubation time (D) on extraction rate of ZJP
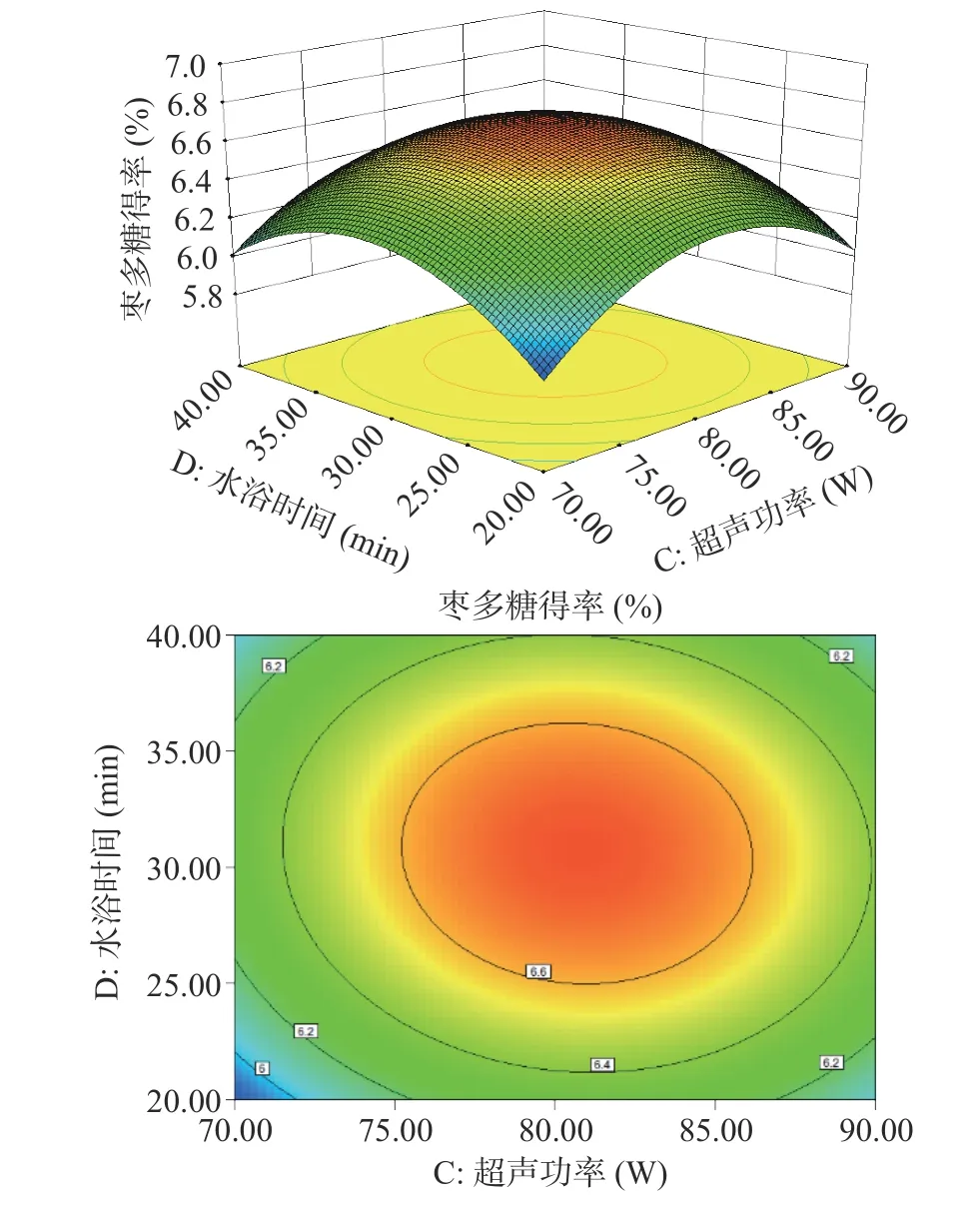
图10 超声功率(C)和水浴时间(D)对多糖得率的影响Fig.10 Effect of ultrasonic power (C) and water-bath incubation time (D) on extraction rate of ZJP
利用软件对工艺条件进行优化,得到最佳理论工艺条件为超声时间41.07 min,料液比1:20.09,超声功率80.70 W,水浴时间30.57 min,多糖得率理论可达6.71%。为检验试验结果是否与真实情况一致,按照上述结果进行类似验证实验,考虑实验的可操作性,将最佳工艺条件修正为超声时间40 min,料液比1:20,超声功率80 W,水浴时间30 min,进行3 次平行实验,多糖平均得率为6.58%,与理论预测值相对误差(2%)较小,且按上述1.2.4 方法计算得红枣多糖总含糖量为58.88%,并根据回归方程计算蛋白质含量,经计算可得蛋白质含量为7.13%。因此该数学模型有效。
2.3 红枣多糖体外抗氧化活性测定
如图11 所示,随着红枣多糖浓度的上升,其羟基自由基清除率增大并呈明显的剂量依赖关系。如图12 所示,红枣多糖DPPH 自由基清除能力随样品浓度的增大而增大,展现出良好的自由基清除能力。如图13 所示,红枣多糖浓度增加,其还原力同步提升,提示了其作为抗氧化剂的潜力。目前关于中药以及药食同源物质中多糖提取物质的抗氧化活性均已报道[31−32]。而多糖的抗氧化活性大多数是由于结构中含有多羟基结构。
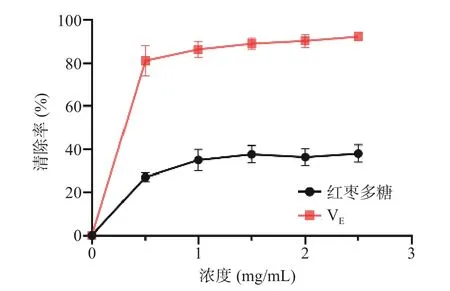
图11 红枣多糖对羟基自由基清除能力的影响Fig.11 Effect of ZJP on hydroxyl radical scavenging
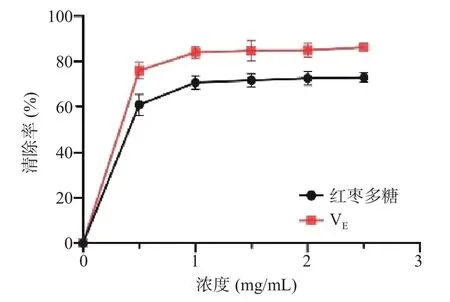
图12 红枣多糖对DPPH 自由基清除能力的影响Fig.12 Effect of ZJP on DPPH radical scavenging
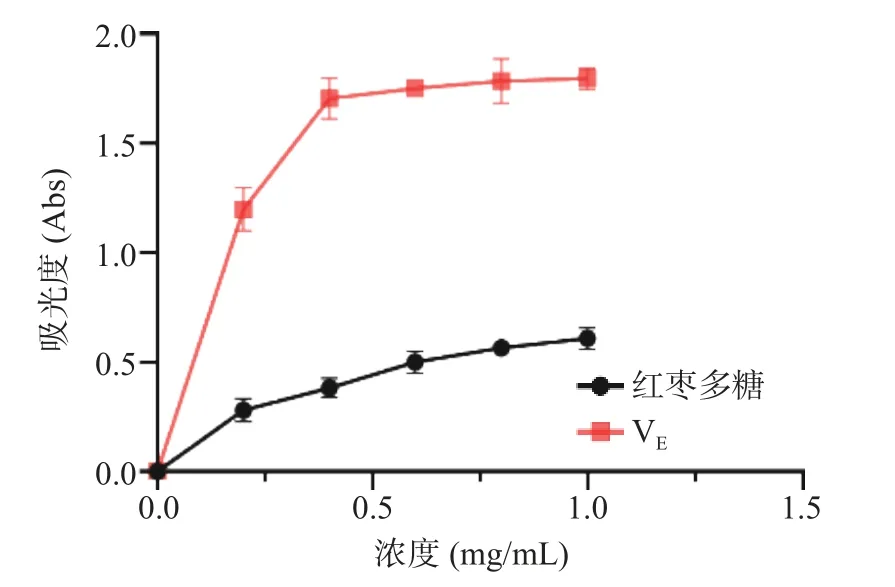
图13 红枣多糖对Fe3+还原力的影响Fig.13 Effect of ZJP on Fe3+ reducing power
2.4 红枣多糖体外降糖活性测定
如图14 所示,红枣多糖对α-葡萄糖苷酶展现出良好的抑制活性,其抑制活性随着多糖浓度的增加而增大,具有明显的量效关系。当红枣多糖的浓度为14 mg/mL 时对α-葡萄糖苷酶活性的最高抑制率为51.56%。同时,如图15 所示,随着红枣多糖浓度的增加,其对α-淀粉酶活性的抑制活性也增大,在试验浓度范围内,红枣多糖对α-淀粉酶活性的最高抑制率28.43%,对应的浓度为4 mg/mL。
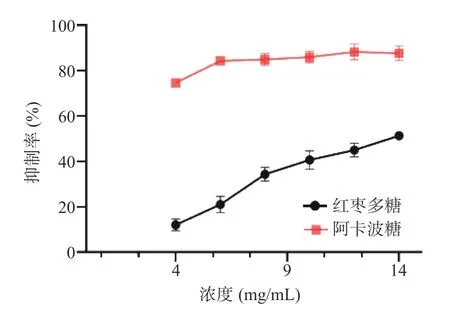
图14 红枣多糖对α-葡萄糖苷酶的抑制作用Fig.14 Inhibitory effects of ZJP on α-glucosidase
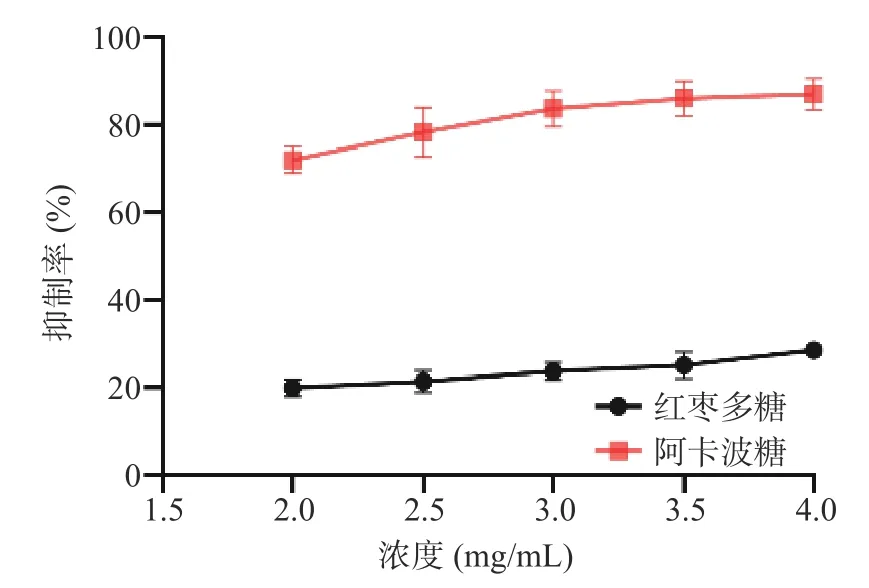
图15 红枣多糖对α-淀粉酶的抑制作用Fig.15 Inhibitory effects of ZJP on α-amylase
2.5 红枣多糖对胰岛素抵抗的HepG2 细胞葡萄糖消耗和细胞活性的影响
从表4 可见,与空白组相比较,模型组的葡萄糖消耗量明显下降,说明该模型可以用于评价红枣多糖降糖活性。与模型组比较,二甲双胍及红枣多糖能促进胰岛素抵抗的HepG2 细胞对葡萄糖的消耗,当红枣多糖给药浓度在0.125~2.0 mg/mL 时,葡萄糖消耗量随着加药浓度的增加而增大,呈现一定的量效关系。当加药浓度为1.0 mg/mL 时,细胞对葡萄糖的消耗量最大,GC/MTT 平均值达到了模型组的154.2%。糖尿病的主要特征包括胰岛素抵抗,肝脏细胞对葡萄糖的摄取减少,从而造成血液中葡萄糖水平升高。本实验使用的HepG2 属满足典型胰岛素受体所有要求,其中包括葡萄糖摄取、糖原合成酶的代谢等,是研究高葡萄糖消耗模型和研究胰岛素抵抗的理想模型。胰岛素抵抗模型试验中,红枣多糖能显著降低胰岛素抵抗作用,促进高胰岛素诱发的胰岛素抵抗细胞对葡萄糖的消耗,增加细胞对葡萄糖的摄取与利用。
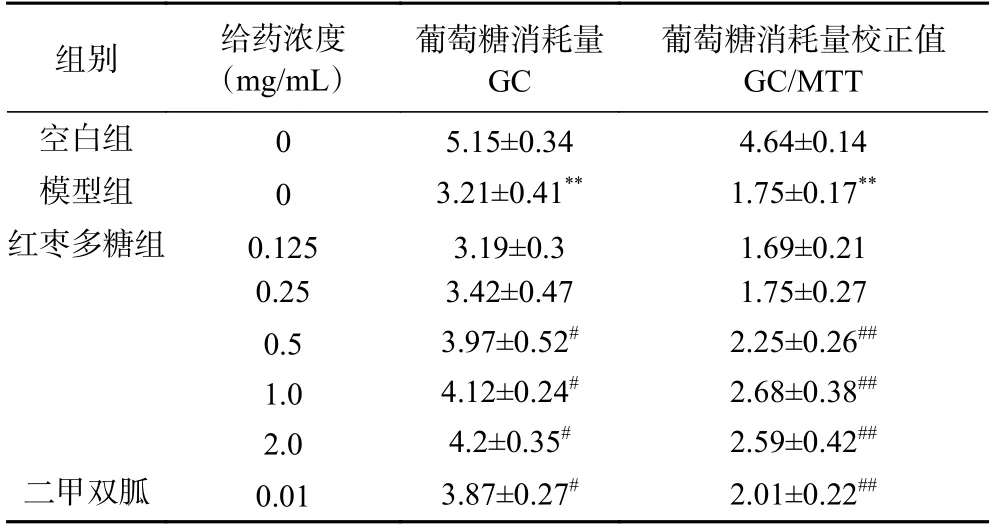
表4 红枣多糖对HepG2 细胞的降血糖活性Table 4 The hypoglycemic activity of ZJP on HepG2 cells
2.6 红枣多糖对PI3K/Akt 通路的激活作用
见图16 和表5,各组PI3K、AKT 蛋白表达水平变化不大,而p-PI3K 和p-AKT 蛋白表达水平显示,与空白对照组比较,胰岛素抵抗模型组中加入PI3K抑制剂后,PI3K/Akt 通路相关蛋白p-PI3K 和p-AKT 表达水平显著下调(P<0.01)。与模型组相比,红枣多糖组细胞中p-PI3K 和p-AKT 表达水平明显上升(P<0.01)。LY294002 抑制剂孵育后,p-PI3K和p-AKT 蛋白表达显著降低,而对PI3K、AKT 水平无影响,说明红枣多糖通过上调HepG2 细胞的PI3K/Akt 通路中相关蛋白p-PI3K 和p-AKT 表达水平进而缓解胰岛素抵抗,减少对细胞的损伤。
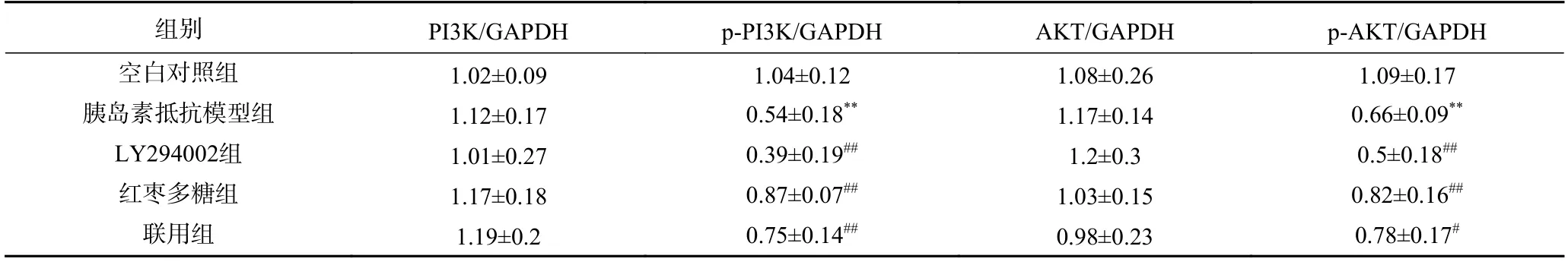
表5 各组细胞中 PI3K/Akt 通路相关蛋白表达水平比较Table 5 Comparison of the expression levels of PI3K/Akt pathway related proteins in cells of each group
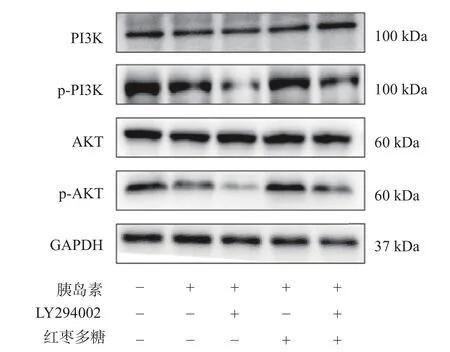
图16 WB 检测细胞中PI3K/Akt 通路相关蛋白表达结果Fig.16 Expression of PI3K/Akt pathway related proteins in cells by WB detection
3 讨论与结论
多糖是红枣中丰富且具有药理活性的主要成分之一,对红枣多糖的提取方法进行优化从而提高多糖得率具有很高的应用价值。本研究采用单因素实验和响应面分析对红枣多糖超声辅助的条件进行了优化,得到最佳工艺条件为超声时间40 min,料液比1:20,超声功率80 W,水浴时间30 min,在此条件下多糖得率为6.58%。此外,通过测定DPPH 自由基、羟基自由基的清除效果以及还原力证实红枣多糖具有良好的抗氧化活性,并且对α-淀粉酶和α-葡萄糖苷酶最高抑制率分别为51.56%和28.43%,表现出降糖潜力。
肝脏是胰岛素作用的主要靶器官,在葡萄糖和脂代谢过程中起重要的作用,胰岛素抵抗状态下,胰岛素糖代谢中葡萄糖输出作用增强,肝糖原合成作用减弱,导致血糖水平升高。HepG2 满足典型胰岛素受体所有要求,是研究高葡萄糖消耗模型和研究胰岛素抵抗的理想模型。许多研究证实胰岛素抵抗的作用机制与抑制PI3K/Akt 信号通路有关[33−34],红枣多糖是红枣中主要的活性成分,本研究进一步确定红枣多糖可以上调p-PI3K、p-AKT 蛋白的表达水平,激活PI3K/Akt 信号通路,从而改善胰岛素抵抗,达到治疗糖尿病的目的。
本研究证实红枣多糖可作为一种潜在药食同源的抗氧化剂或功能性食品,为进一步将红枣多糖开发为抗氧化产品以及降糖产品提供理论和实践基础。
