超声波辅助热碱法提取藜麦蛋白的工艺优化
2022-07-08袁孝瑞陈贺宇武青杭赵岩岩周海旭朱明明蔡自然赵圣明
袁孝瑞,陈贺宇,刘 玉,武青杭,杨 柳,赵岩岩,周海旭,朱明明,蔡自然,赵圣明
(河南科技学院食品学院,河南新乡 453003)
藜麦(学名:Chenopodium quinoaWilld)是藜科藜属植物,具有多种药用价值,被列为十大营养食品之一[1]。藜麦作为类全谷物,氨基酸种类丰富,除了9 种人类必需氨基酸外,还含有许多非必需氨基酸,特别是富集多数作物没有的赖氨酸,且蛋白质含量最高可以达到16%~22%,营养价值与奶粉及肉类相当,还含有丰富的不饱和脂肪酸、少量的糖类物质、多种矿物质和维生素等,具有促进人体健康的作用,被国际营养学家称为丢失的“远古黄金”,被素食主义爱好者奉为“素食之王”[2−4]。
目前已有关于藜麦蛋白提取工艺的相关报道。王棐[5]采用碱提酸沉法提取藜麦蛋白,通过正交优化得到蛋白提取率可达67.13%。但正交试验只能分析离散型数据,精确度不高且预测性较差。马洪鑫等[6]采用碱提酸沉法提取藜麦蛋白,再利用响应面法对蛋白质提取工艺进行优化,总蛋白提取率可达76.84%。田格等[7]采用复合酶解法提取藜麦蛋白,总蛋白提取率达到了76.82%。CBRINEGAR 等[8−9]分别在pH9和pH11 的碱性条件下浸提藜麦蛋白,得到相应的Q9 和Q11 两种蛋白质。但由于pH 高导致Q11 在提取过程中发生了变性。虽然碱法工艺成本低,但是存在pH 高、制备蛋白易变性且提取率低等缺点;干法分级和湿法碾磨得到的谷物蛋白营养成分流失较少,可充分挖掘谷物的营养价值和经济价值,但获取组分中蛋白纯度较低;酶法制备藜麦蛋白反应条件较温和,所得蛋白营养价值高,但其工艺成本较碱法高[10]。超声波提取技术通过空穴效应,有利于蛋白质的快速分离和制备,可以提高蛋白的提取率,缩短提取时间,使用范围广,操作简单且成本低[11−12]。超声波辅助提取法目前已广泛用于小麦蛋白、玉米蛋白和花生蛋白等的提取工艺中[13−15]。但关于超声波辅助碱法提取藜麦蛋白的研究却鲜有报道。
本文以市售新鲜藜麦为原料,以藜麦蛋白的提取率为考察指标,利用超声波辅助热碱法,研究料液比、超声功率、温度和超声时间等因素对藜麦蛋白提取率的影响,通过响应面优化获得各因素的最优组合,并且测定了蛋白的乳化性和稳定性,旨在为藜麦蛋白的提取及进一步开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
藜麦(九月中下旬采收) 山东老乡生态农业有限公司;大豆油 益海(周口)粮油工业有限公司;氢氧化钠 天津市东丽区天大化学试剂厂;考马斯亮蓝G-250、磷酸 天津市科密欧化学试剂有限公司;无水乙醇 天津新技术产业园区科茂化学试剂有限公司;盐酸 郑州派尼化学试剂厂;十二烷基硫酸钠(SDS) 西陇科学股份有限公司,以上试剂均为分析纯。
FW100 高速万能粉碎机 天津泰斯特仪器有限公司;722N 可见光分光光度计 上海菁华科技仪器有限公司;Sorvall LYNX 4000 高速离心机 赛默飞世尔科技(中国)有限公司;SB-4200 DTD 型超声波清洗机 宁波新芝生物科技股份有限公司;雷磁PHS-2F pH 计 上海雷磁仪器有限公司;梅特勒-托利多ME104 电子天平 梅特勒-托利多国际贸易(上海)有限公司;QL-866 旋涡混合器 海门市其林贝尔仪器制造有限公司;IKA T18 高速分散机 德国IKA 公司。
1.2 实验方法
1.2.1 原料预处理 将藜麦清洗干净,经80 ℃恒温干燥4 h 去除水分,使用粉碎机粉碎,过60 目筛,得到藜麦粉,置于干燥器中备用。
1.2.2 藜麦蛋白的提取 参考薛颖等[16]和桂向东等[17]的方法,取5 g 藜麦粉,以1%的NaOH 溶液作为溶剂,将其充分溶解后,采用超声波辅助法进行蛋白的提取,在4 ℃、8000 r/min 条件下离心10 min,收集上清液,使用HCl 调节pH 至4.5,静置30 min 后,在5000 r/min 条件下离心15 min,收集沉淀,使用蒸馏水洗涤,最后将所得沉淀pH 调至7,冷冻干燥后,即得所提藜麦蛋白。
1.2.3 单因素实验
1.2.3.1 温度对藜麦蛋白提取率的影响 称取5 g 藜麦粉,在超声功率250 W,料液比1∶20 g/mL,超声时间1.5 h 的条件下,分别考察不同温度(35、40、45、50、55、60 ℃)对藜麦蛋白提取率的影响。
1.2.3.2 超声时间对藜麦蛋白提取率的影响 称取5 g藜麦粉,在超声功率250 W,料液比为1∶20 g/mL,超声温度35 ℃,的条件下,分别考察不同时间(0.5、1、1.5、2、2.5、3 h)藜麦蛋白提取率的影响。
1.2.3.3 料液比对藜麦蛋白提取率的影响 称取5 g藜麦粉,在超声功率250 W,超声温度35 ℃,超声时间1.5 h 的条件下,分别考察不同料液比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40 g/mL)对藜麦蛋白提取率的影响。
1.2.3.4 超声功率对藜麦蛋白提取率的影响 称取5 g 藜麦粉,在提取温度35 ℃,料液比1∶20 g/mL,超声时间1.5 h 条件下,考察不同超声功率(100、200、250、300、350、400 W)对藜麦蛋白提取率的影响。
1.2.4 响应面试验 由于超声时间对藜麦蛋白提取率的影响较显著,所以在单因素实验结果的基础上,选取温度(A)、料液比(B)、超声功率(C)三个因素为考察对象,探究三个因素对藜麦蛋白提取率的综合影响,依据中心组合设计(CCD)进行试验设计,采用Design-Expert 8.0.6 软件处理数据,对藜麦蛋白的提取工艺做进一步的优化[18−20]。
1.2.5 藜麦蛋白提取率的计算
1.2.5.1 标准曲线的绘制 考马斯亮蓝G-250 溶液的配制:取25 mL 95%的乙醇,50 mg 考马斯亮蓝G-250,再加入60 mL 85%的磷酸,蒸馏水定容至500 mL,避光保存备用。分别吸取1.0 mg/mL 的标准蛋白质溶液0、0.02、0.04、0.06、0.08、0.1 mL 于试管中,用蒸馏水补足溶液为0.1 mL。每管加入5.0 mL 考马斯亮蓝G-250 试剂,混合均匀等待2 min,在595 nm 处测定吸光度值[21−22]。以牛血清蛋白的质量浓度(mg/mL)数为横坐标(x 轴),595 nm下的吸光度值为纵坐标(y 轴),绘制标准曲线,建立回归方程,得到回归方程为y=0.5279x−0.0014(R2=0.9998)。
1.2.5.2 总蛋白的测定及提取率的计算 藜麦中总蛋白含量的测定采用凯氏定氮法,参照GB/T5009.5-2010 食品中蛋白质的测定[23]。由1.2.5.1 建立的回归方程,计算出提取的蛋白质含量,按照式(1)计算蛋白质的提取率[24]:
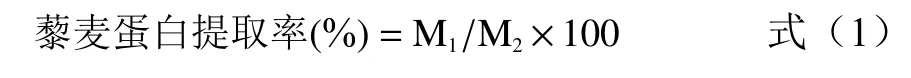
式中:M1为超声辅助提取获得的藜麦蛋白质量,g;M2为样品中总蛋白质质量,g。
1.2.6 藜麦蛋白功能特性测定
1.2.6.1 溶解度的测定 将提取的藜麦蛋白分别配制成浓度为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的蛋白悬浮液,采用双缩脲法测定其蛋白溶解性[25],将配制好的蛋白悬浮液经10000 r/min 离心20 min,除去不溶物,取上清液1 mL 加入4 mL 双缩脲,混匀后静置30 min,在540 nm 波长下测定其吸光度值,进而计算上清液中藜麦蛋白浓度(mg/mL)占总蛋白浓度的百分数,计算公式如下:

1.2.6.2 乳化性及乳化稳定性的测定 参考Jiang 等[26]的方法,并稍作修改。分别取6 mL 浓度为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的藜麦蛋白溶液,与2 mL 大豆油混合均匀。然后用高速分散机12000 r/min 乳化2 min,制成藜麦蛋白乳液,立即从烧杯底部取50 μL 乳状液与5 mL 0.1 g/100 mL SDS 混匀,在500 nm 波长处测定吸光度A0。静置30 min 后按相同方法测定乳状液的吸光度A30,每组三个平行。乳化性(EA)和乳化稳定性(ES)的计算公式如下:
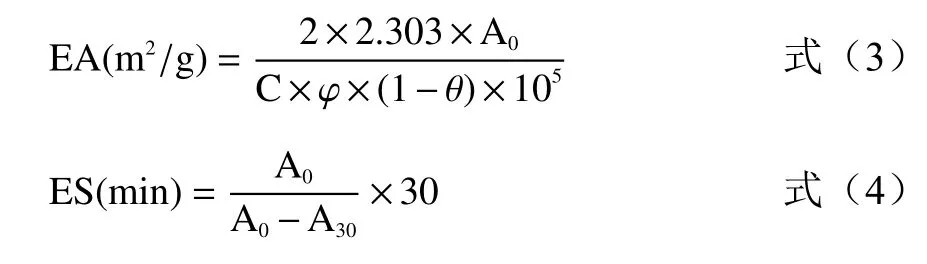
式中:C 表示形成乳状溶液之前蛋白质的浓度,g/mL;φ=0.01,代表光程,θ=0.25,代表乳状液中油所占的体积分数。
1.2.6.3 起泡性及起泡稳定性的测定 参照蔡沙等[24]的方法测定,并作适当修改。分别取10 mL 浓度为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%的藜麦蛋白溶液,于20000 r/min 高速分散器下均质1 min,读取泡沫体积(mL),放置30 min 后再次读取泡沫体积。起泡性(FC)和起泡稳定性(FS)按照式(5)、(6)计算:

1.3 数据处理
所有试验均重复3 次,结果以平均值±标准差表示。采用Excel、SPSS Statistics 23.0 和Design-Expert8.0.6 软件进行试验数据的处理和显著性分析,使用Origin2018 绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 温度对藜麦蛋白提取率的影响 温度对藜麦蛋白提取率的影响如图1 所示。由图可知,随着温度的升高,藜麦蛋白的提取率呈先上升后下降的趋势,在40 ℃达到最大值为65.83%,其结果与韩宗元等[27]的研究结果趋势一致。温度低于40 ℃时随着温度的增加蛋白质分子热运动增加,溶出率增高。40~60 ℃范围内提取率显著降低(P<0.05),可能是由于高温使部分物料略有糊化,溶液黏度变大,分子运动变慢,从而导致提取率下降[24]。因此,确定藜麦蛋白的最适提取温度为40 ℃。
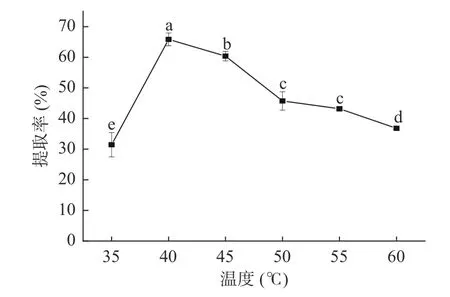
图1 温度对藜麦蛋白提取效果的影响Fig.1 Influence of extraction temperature on extraction effect of quinoa protein
2.1.2 超声时间对藜麦蛋白提取率的影响 超声时间对于藜麦蛋白提取率的影响如图2 所示。由图可知,0.5~2.0 h 的范围内,藜麦蛋白的提取率显著增加(P<0.05),在2.0 h 时达到最大值为59.50%。这是因为随着反应时间的延长,藜麦粉与碱性物质充分接触,使蛋白质与纤维素等成分分离,从而导致提取率增加[28]。当超声时间超过2.0 h 时,藜麦蛋白的提取率从59.50%逐渐下降到28.16%,可能是因为随着超声时间的延长,温度升高过快,使得蛋白质颗粒之间的作用增强,易凝集而沉淀,藜麦中部分成分分解或挥发,蛋白发生变性,使藜麦蛋白的提取率下降[16]。因此,确定2 h 为藜麦蛋白的最适提取时间。
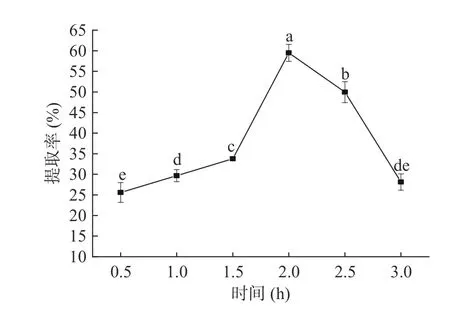
图2 超声时间对藜麦蛋白提取效果的影响Fig.2 Influence of ultrasionic time on extraction effect of quinoa protein
2.1.3 料液比对藜麦蛋白提取率的影响 料液比对于藜麦蛋白提取率的影响如图3 所示。由图可知,随着料液比的增加藜麦蛋白的提取率呈现先上升后下降的趋势。可能是随着料液比的增加,溶液中的藜麦蛋白不断溶出,当料液比到达1∶30 g/mL 时,藜麦蛋白提取率达到最大值52.74%。当料液比大于1∶30 g/mL 后,溶液中藜麦蛋白已达到饱和状态,溶液中的蛋白溶度与藜麦蛋白组织中的浓度趋于平衡,过量的藜麦蛋白不再溶解,且料液比过大时,不利于蛋白质提取后的浓缩沉淀,所以提取率显著下降(P<0.05)[15]。其结果与宁芯等[29]的研究结果相一致。因此,确定藜麦蛋白的最适提取料液比为1∶30 g/mL。
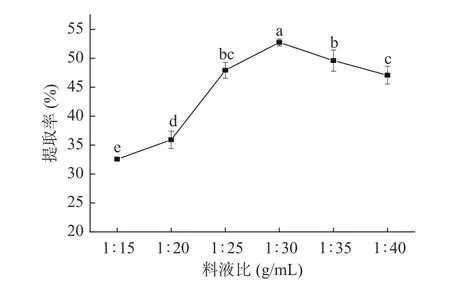
图3 料液比对藜麦蛋白提取效果的影响Fig.3 Influence of solid-liquid ratio on extraction effect of quinoa protein
2.1.4 超声功率对藜麦蛋白提取率的影响 超声功率对于蛋白提取率的影响如图4 所示。由图可知,在超声功率100~350 W 范围内,藜麦蛋白提取率显著上升(P<0.05),在350 W 时蛋白提取率达到最大值43.10%。当超声功率超过350 W 时,藜麦蛋白提取率变化不显著(P>0.05)。这是因为在提取初期,藜麦蛋白没有充分溶解,随着超声功率的提高,分子扩散速度逐渐变大,溶剂更容易渗透到藜麦内部,蛋白质分子渗出加快,溶出量变大[16]。当超声波功率大于350 W 时,在固定条件下,大部分蛋白已经溶出,所以提取液中的蛋白含量没有显著变化(P>0.05)。因此,确定藜麦蛋白的最适超声提取功率为350 W。
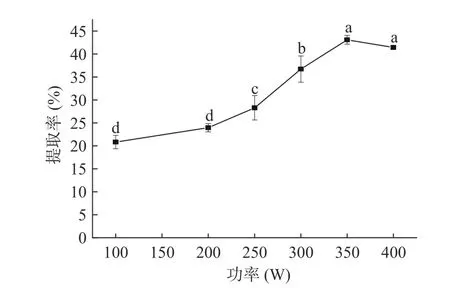
图4 超声功率对藜麦蛋白提取效果的影响Fig.4 Influence of ultrasonic power on extraction effect of quinoa protein
2.2 响应面试验结果分析
2.2.1 响应面试验设计与结果 通过单因素实验确定藜麦蛋白的最佳提取工艺参数,根据表1 中因素和水平的设计试验,利用Design-Expert 8.0.6 软件进行优化设计,以蛋白质提取率为响应值,结果见表2。
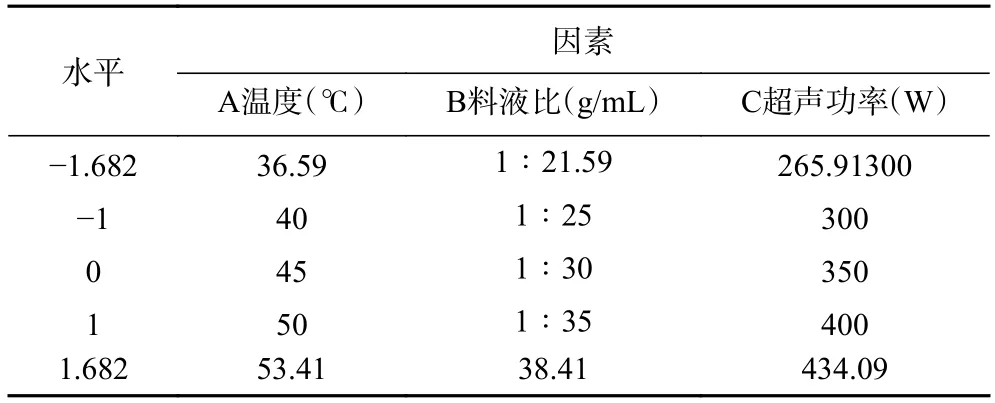
表1 响应面自变量因素编码和水平Table 1 Factors encoding and levels in response surface methodology
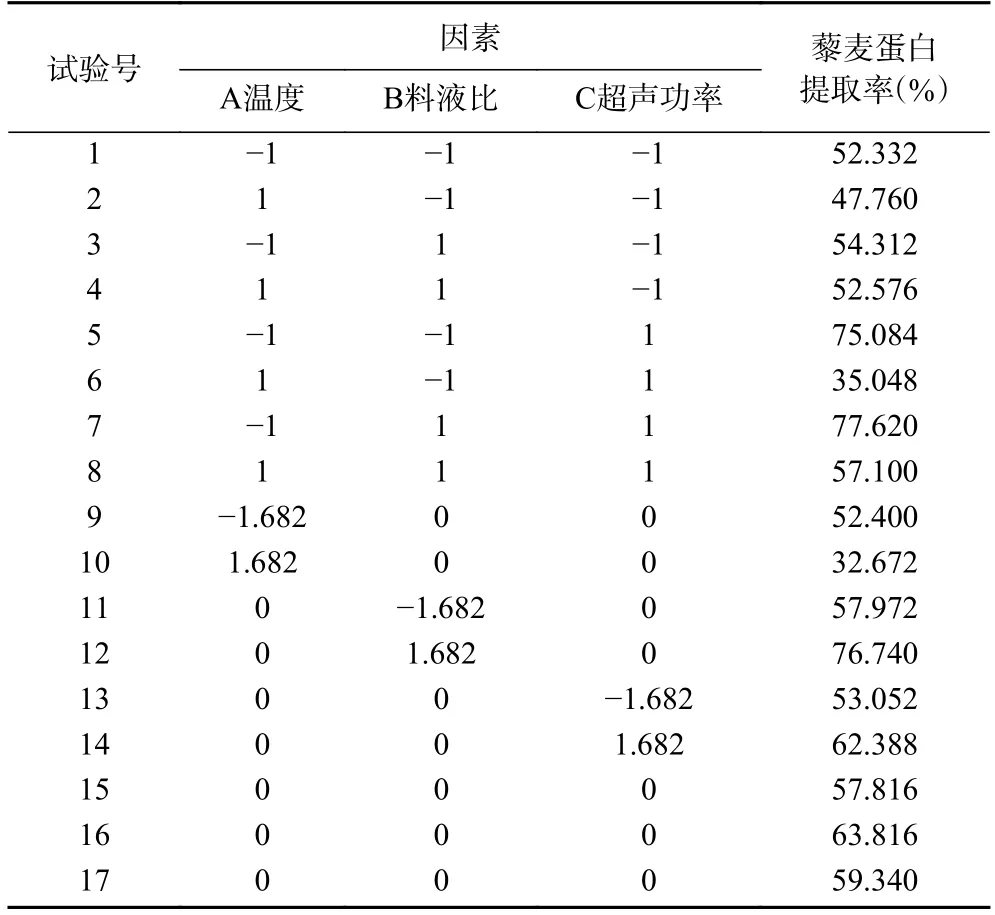
表2 超声波辅助热碱法提取藜麦蛋白响应面试验设计结果Table 2 Experimental results of ultrasonic-assisted thermoalkaline extraction of quinoa protein
利用响应面软件对温度(A)、料液比(B)、超声功率(C)等三个因素进行回归拟合分析,得到如下回归方程(Y 代表藜麦蛋白质提取率):
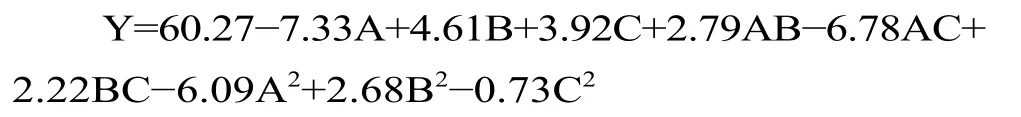
回归方程方差分析结果如表3 所示。回归模型的参数P<0.01,说明响应面的模型拟合较好,本次试验的可信度高。表中可以看出模拟项A、B、C、A2和交互项AC 对藜麦蛋白提取率影响极显著;B2对藜麦蛋白提取率影响显著;其中失拟项P=0.421 失拟项不显著(P>0.05),说明该模型可用于分析和预测藜麦蛋白的提取率。从建立的回归模型中可以得出各因素的影响的主次顺序为:温度>料液比>超声波功率,也表明了三因素对提取蛋白的重要程度。
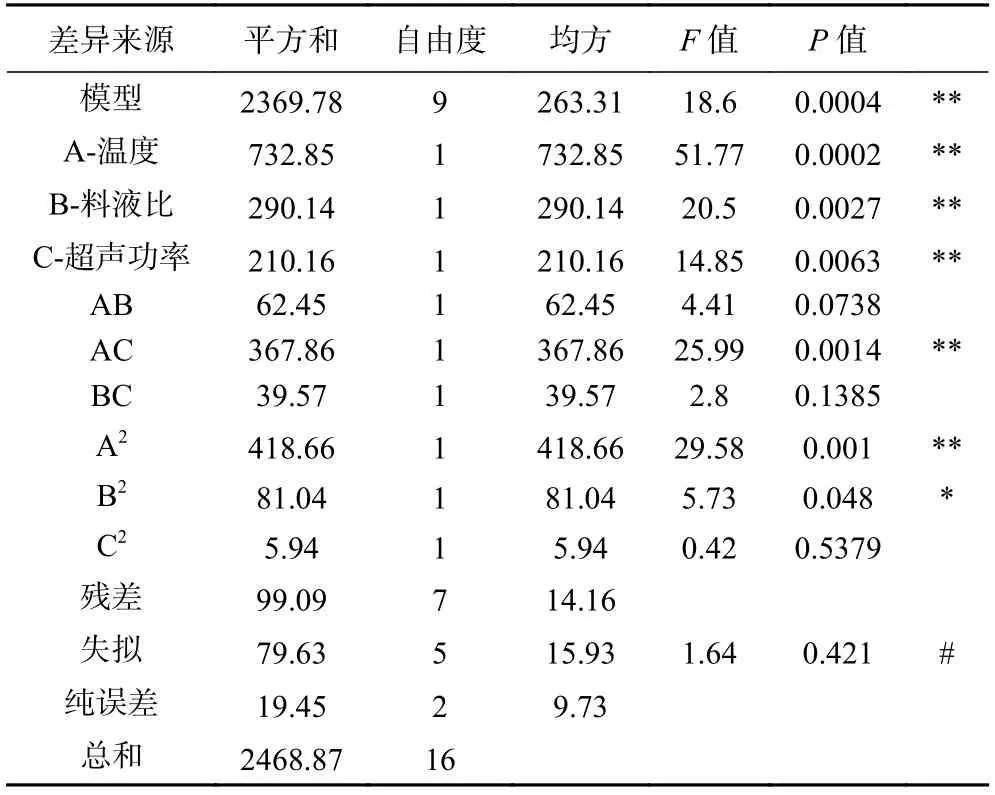
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.2.2 响应面优化提取条件 为进一步研究温度、料液比和超声功率各因素之间的交互作用对藜麦蛋白提取率的影响,应用Design-Expert 8.0.6 进行分析[30]。图5 为各因素交互作用的响应面图。图5-a为温度和料液比对藜麦蛋白提取率的交互作用,图5-b为温度和超声功率对藜麦蛋白提取率的交互作用,图5-c 为料液比和超声功率对藜麦蛋白提取率的交互作用。
响应面图可以最直观地展示出各因素对蛋白提取率影响的大小,曲面越陡峭,说明两因素对响应值的交互影响越大;曲面越平缓,说明两因素对响应值的交互影响越小[31]。图5-a 和图5-c 两图曲面坡度较平缓,说明料液比与超声功率及温度的交互作用对于藜麦蛋白提取率的影响较小。从图5-b 响应面可以看出曲面的坡度较陡,说明温度和超声功率的交互作用对于藜麦蛋白提取率的影响较大,而且温度所对应的曲面与超声功率相比,坡度更陡,说明温度对藜麦蛋白提取率的影响大于超声功率。此结果与方差分析结果一致。
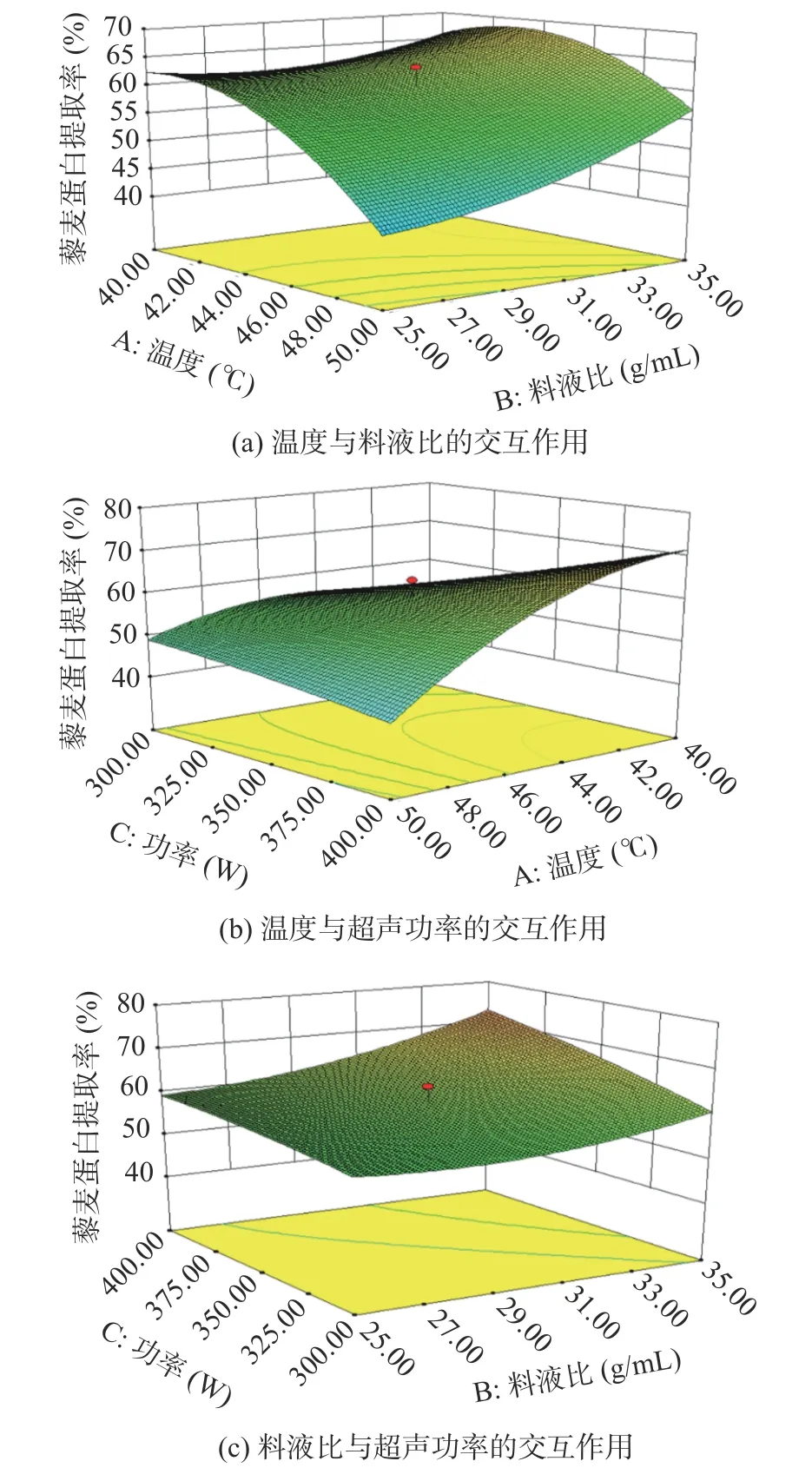
图5 各因素交互作用响应面图Fig.5 The response surface of the interaction of various factors
通过Design-Expert8.0.6 软件分析得出,当料液比为1∶35 g/mL、提取温度为40.35 ℃、超声功率为400 W 时,藜麦蛋白提取率最高为78.229%。但考虑实际操作情况,将最优提取工艺参数调整为料液比1∶35 g/mL、温度40 ℃,超声功率400 W。
为了检验响应面试验得到的藜麦蛋白提取率模型的正确性和合理性,进行了一组验证试验。验证试验结果表明:在料液比为1:35 g/mL,超声功为400 W,温度为40 ℃的条件下,藜麦蛋白的提取率为78.20%。由此可知,藜麦蛋白提取率验证试验的实际值与模型预测值之间比较接近,说明该模型可以较准确地分析和预测藜麦蛋白的提取率。
2.3 藜麦蛋白特性研究
2.3.1 溶解度 溶解度是测量蛋白功能特性重要指标之一,它体现的蛋白质在水中分散水平,同时蛋白质的变性程度也可以通过溶解行为的变化来表示[32]。如图6 所示,超声辅助法提取的藜麦蛋白的溶解性,随着蛋白悬浮液浓度的增加不断增大,在3.5%浓度时达到最大,最大值为61.18%,在大于3.5%时,蛋白悬浮液的溶解度变化不显著(P>0.05),可能是因为此时溶液已达到饱和。
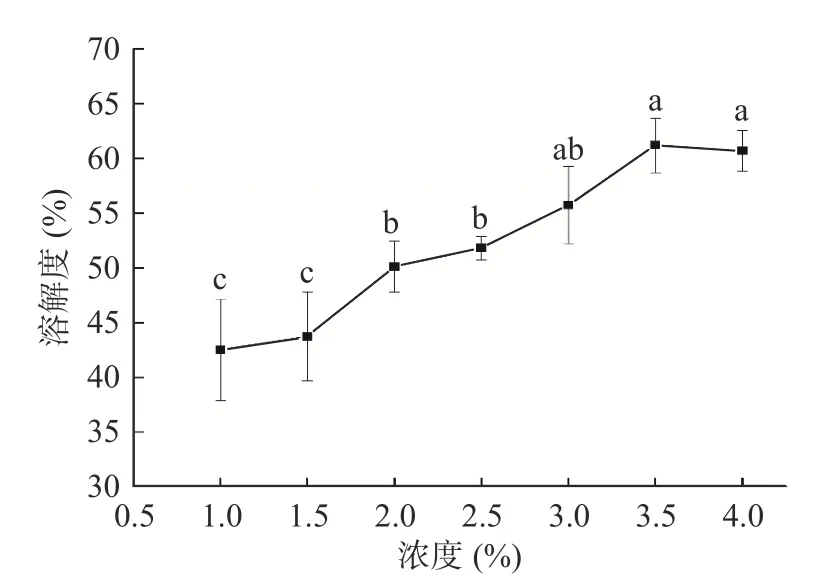
图6 蛋白悬浮液浓度对藜麦蛋白溶解度的影响Fig.6 Effect of protein concentration on protein solubility of quinoa protein
2.3.2 乳化性及乳化稳定性 在高速搅拌下,蛋白与油被均匀分散在水中形成乳化液的能力叫蛋白乳化性;维持蛋白乳化液稳定且不出现明显分层的能力即蛋白乳化稳定性,溶液pH、离子浓度、温度和蛋白质浓度都对蛋白乳化性及乳化稳定性有不同程度的影响[33]。如图7 所示,藜麦蛋白的乳化性和乳化稳定性随着藜麦蛋白浓度的增加呈现先增高后降低的趋势,在3.5%浓度时,乳化性和乳化稳定性均达到最大值分别为5.39 m2/g 和255.59 min,其结果与王棐等[28]的研究结果相比,藜麦蛋白的乳化性增加了0.18 m2/g,因此超声辅助提取的藜麦蛋白在3.5%浓度时具有良好的乳化性及乳化稳定性。
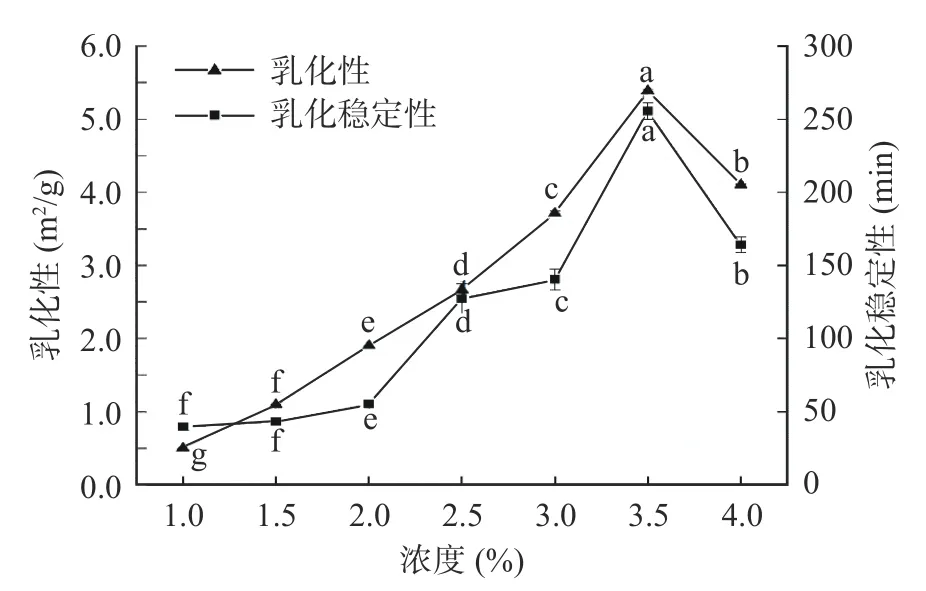
图7 蛋白浓度对藜麦蛋白乳化特性的影响Fig.7 Effect of protein concentration on emulsifying properties of quinoa protein
2.3.3 起泡性及起泡稳定性 蛋白起泡性是指蛋白样品在高速搅打过程中通过降低水的表面张力,并扑捉气体最终形成泡沫的能力;起泡稳定性指蛋白泡沫产生后保持泡沫稳定的能力[34]。不同浓度下藜麦蛋白的起泡性及起泡稳定性的变化如图8 所示,随着藜麦蛋白浓度的不断增加起泡性及起泡稳定性呈现先升高后降低的趋势,在浓度为3%时均达到最大值,分别为101.0%和66.0%,其结果与Elsohaimy等[35]的研究结果相比藜麦蛋白的起泡性增加了22.31%,稳定性相比增加了11.46%。因此,超声辅助提取的藜麦蛋白在3%浓度时具有良好的起泡性和起泡稳定性。
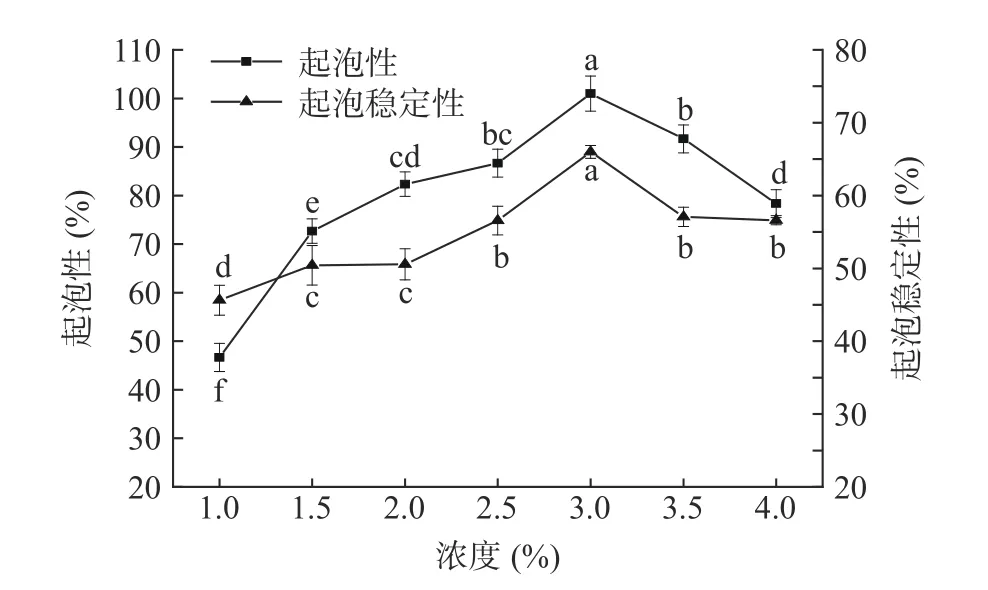
图8 蛋白浓度对藜麦蛋白起泡特性的影响Fig.8 Effect of protein concentration on foaming properties of quinoa protein
3 结论
本文以藜麦为原料,通过超声波辅助热碱法提取藜麦蛋白,利用单因素和响应面法优化藜麦蛋白提取工艺,确定蛋白最佳提取工艺条件为料液比1∶35 g/mL、超声功率400 W、温度40 ℃,超声时间2 h,在此条件下,藜麦蛋白提取率可达到78.20%。在3.5%浓度时蛋白溶解度最好,在3.5%和3%浓度时表现出最佳的乳化性和起泡性。超声辅助的提取藜麦蛋白的方法与其他单一的碱提酸沉法相比,提高了藜麦蛋白的提取率,同时也显著提高藜麦蛋白的起泡性与乳化性,通过响应面优化的方法,探究出了最佳的处理工艺条件,为藜麦蛋白的改性提供了理论的基础,但此种方法对于藜麦蛋白其他性质的影响尚需进一步的研究。
