不同分子量红花籽抗氧化肽稳定性研究
2022-07-08刘晓艺周玉岩过利敏郝光飞
刘晓艺,周玉岩,过利敏,郝光飞,
(1.河北工程大学生命科学与食品工程学院,河北邯郸 056107;2.河北省食品药品医疗器械检验研究中心,河北石家庄 050299;3.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐 830091)
红花(Carthamus tinctoriusL.)为菊科红花属,为新疆地区代表作物之一。红花籽为红花的种子,气香性温,功能与花相同,都具有防治心脑血管疾病、降低血压等药用价值,富含油脂、蛋白质、维生素与矿物质等营养成分[1−3]。红花籽油中亚油酸含量高达75%~85%,在低温或受热条件下油质稳定[4−5]。红花籽榨油后籽粕中富含蛋白质,同样具有很高的营养价值,其氨基酸种类齐全且比例适宜,疏水性及耐热性氨基酸含量高达40%,可作为补充氨基酸和制备生物活性肽的优质蛋白原料[6]。目前,食源性优质蛋白已成为研究热点,越来越多新型功能肽被开发利用,如沙棘籽蛋白、西瓜籽蛋白及菠萝蜜籽蛋白等[7−9]。与其他植物蛋白相比,红花籽蛋白不仅资源更加丰富,还具有一定的加工特性,乳化性及发泡性与大豆蛋白相似,但在酸性及中性环境中优于大豆蛋白[6,10]。在蛋白酶解多肽生物活性方面,红花籽蛋白经单酶水解后得到具有抗氧化活性的多肽,证实了其制备抗氧化肽的可行性[11]。
多肽作为蛋白质的降解衍生物,更容易被人体吸收利用,在较小浓度下具有较强的生物活性,其性质与蛋白质类似,容易受到环境因素影响,如在食品加工过程中(如高温)或机体胃肠消化阶段,多肽可能会因氧化、脱酰胺或环化等作用而发生降解,导致活性下降甚至消失,此外,常见的食品原辅料及金属离子也可能会与多肽发生作用影响活性。因此,研究红花籽抗氧化肽稳定发挥活性作用的环境条件可保证其在加工过程中的稳定性,为产品的开发及工业化应用提供参考[12]。目前,大部分对红花籽多肽的研究主要在制备工艺、分离纯化及功能构效等方面,对其生物活性的稳定性方面研究较少[13],近年来,已发现杏鲍菇多肽、菜籽肽在高温、强酸强碱环境下会失活[14−15],但关于红花籽抗氧化肽在加工、贮藏应用及胃肠消化等环境中活性稳定性研究尚浅,因此,有必要对红花籽抗氧化肽稳定性研究,保证多肽产品能稳定发挥抗氧化效果。
由于红花籽与籽粕蛋白氨基酸含量及成分等相差甚微[6],考虑红花籽的综合利用,减少营养物质浪费,本试验以脱壳红花籽粕为原料,提取蛋白质后通过复合酶解法制备红花籽抗氧化肽并超滤分离,研究不同分子量多肽在食品加工、贮藏过程及模拟胃肠消化等环境因素中抗氧化活性的稳定性,旨在筛选得到抗氧化活性及稳定性较高的多肽组分,得出抗氧化活性稳定的加工应用条件,为红花籽抗氧化肽的产品开发及产业化提供理论依据。
1 材料与方法
1.1 材料与仪器
脱壳红花籽粕 新疆伊犁州察布查尔县雅其娜农业发展有限公司;碱性蛋白酶(75000 U/g)、中性蛋白酶(64000 U/g)、胰蛋白酶(25000 U/g)、胃蛋白酶(3000 U/g) 北京博奥拓达科技有限公司;DPPH、邻苯三酚、水杨酸 上海阿拉丁公司;NaCl、柠檬酸、蔗糖、葡萄糖、山梨酸钾、苯甲酸钠 国药集团化学试剂有限公司;其余试剂为国产分析纯。
1000A 高速万能粉碎机 永康市太阳机电有限公司;PHJ-3F pH 计 天津赛得利斯实验有限公司;JA1003 电子天平 上海精科天平;581R 高速冷冻离心机 德国Eppendorf 公司;UV1901 紫外可见分光光度计 杭州艾普仪器设备有限公司;DK-98-1 电热恒温水浴锅 天津泰斯特;SCIENTZ-10ND 冷冻干燥机 宁波新芝生物公司;ZJMP10-002 超滤系统美国Millipore 公司。
1.2 实验方法
1.2.1 红花籽蛋白的提取 脱壳红花籽粕粉碎机粉碎过80 目筛,1:5(W/V)正己烷脱脂,搅拌浸提6 h,反复三次,1:10(W/V)比例溶于去离子水,NaOH(1 mol/L)调pH 至10,搅拌1 h,4000 r/min 冷冻离心10 min,取残渣进行二次浸提,HCl(1 mol/L)调上清液pH 至5.5,静置30 min,4000 r/min 冷冻离心10 min,取沉淀,调pH 至中性,−80 ℃冷冻干燥后−20 ℃封装储藏备用[10]。
1.2.2 红花籽蛋白复合酶水解 配制底物浓度为5%红花籽蛋白溶液,采用碱性蛋白酶与中性蛋白酶2:1 复合酶解,酶解温度50 ℃,酶解2 h,酶添加量7000 U/g,酶解过程用NaOH 维持pH 为8 不变。以反应过程中NaOH 的消耗量计算水解度(DH),控制水解程度[16],反应完全后,100 ℃灭酶10 min,调溶液pH 至中性,3500 r/min 离心10 min,得到红花籽蛋白酶解液,测定抗氧化活性,上清液冷冻干燥备用[17]。
1.2.3 红花籽蛋白酶解产物超滤分离 将红花籽蛋白酶解产物复溶于去离子水中,调pH 为7,0.45 μL微孔滤膜过滤,选择3、5、10 kDa 超滤膜,调节超滤模板进口压力为0.2 Mpa,出口压力不高于0.03 Mpa,常温超滤,收集所得组分SSPH-Ⅰ(<3 kDa)、SSPH-Ⅱ(3~5 kDa)、SSPH-Ⅲ(5~10 kDa)和SSPH-Ⅳ(>10 kDa)多肽溶液,分别测定各组分体外抗氧化活性后冷冻干燥,−20 ℃保存备用。
1.2.4 红花籽蛋白多肽抗氧化稳定性研究
1.2.4.1 温度对红花籽不同分子量多肽抗氧化稳定性的影响 配制浓度为2 mg/mL 不同分子量多肽液,分别在水浴条件60、70、80、90、100、121 ℃保温处理2 h,取样后冰水浴迅速冷却至室温进行测定,以各组室温条件抗氧化活性为处理前参照,计算清除能力维持率[14]。
1.2.4.2 pH 对红花籽不同分子量多肽抗氧化稳定性的影响 将多肽样品分别溶于pH 为3、4、5、6、7、8、9、10、11 的Na2HPO4-柠檬酸缓冲液(0.1 mol/L)中,配成质量浓度为200 μg/mL 溶液,用HCl 和NaOH(1 mol/L)分别调节pH,在室温下静置2 h,以去离子水配制肽溶液为参照,计算清除能力维持率[14]。
1.2.4.3 食品原辅料对红花籽不同分子量多肽抗氧化稳定性影响 配制浓度为2 mg/mL 不同分子量多肽液,分别添加NaCl、蔗糖、葡萄糖、柠檬酸、防腐剂山梨酸钾及苯甲酸钠。其中,NaCl、蔗糖和葡萄糖溶液的浓度为2、4、6、8、10 g/100 mL,柠檬酸和防腐剂的浓度为0.04、0.08、0.12、0.16、0.2 g/100 mL,添加蔗糖和葡萄糖组分在100 ℃下放置20 min,其他在室温下静置反应2 h,以未添加以上食品原辅料肽样品为参照,计算清除能力维持率[15,18]。
1.2.4.4 金属离子对红花籽不同分子量多肽抗氧化稳定性的影响 配制浓度为2 mg/mL 不同分子量的多肽液,分别加入含有K+、Ca2+、Mg2+、Zn2+和Cu2+的金属盐,使溶液中的金属离子质量浓度为250 μg/mL,在室温下静置2 h,以未添加以上金属盐的肽样品为参照,计算清除能力维持率[15]。
1.2.4.5 体外模拟消化对红花籽蛋白及不同分子量多肽抗氧化稳定性的影响 制备模拟胃液及肠液后,分别取红花籽蛋白(SSP)及分离后的多肽2 mg/mL,调pH 至2,控制温度37 ℃,加入5 mL 人工胃液混匀,37 ℃水浴振荡2 h,100 ℃水浴加热10 min终止反应,冷却后5000 r/min 离心15 min。胃模拟处理2 h 后NaOH 调pH 为8,加入5 mL 人工肠液,37 ℃水浴反应3 h,每1 h 取样,沸水浴加热10 min终止反应,冷却后5000 r/min 离心15 min,以红花籽蛋白为对照,分别计算胃消化、肠消化上清液自由基清除率[19]。
1.2.5 体外抗氧化活性和维持率的测定
1.2.5.1 体外抗氧化活性的测定 DPPH 自由基清除率参考MULLA 等[20]的方法并稍加改动,水杨酸法测定·OH 清除率参考胡磊[21]的方法稍加改动,邻苯三酚法测定O2−·清除率参考LU 等[22]的方法并稍加改动。
1.2.5.2 抗氧化活性维持率的测定 为了更直观表达红花籽多肽抗氧化稳定性,各组分别测定处理前、后的DPPH 自由基、O2−·及·OH 清除率,方法参考1.2.5.1,比值定义为能力维持率,各自由基清除率分别以处理前样品活性为参照,计算公式如下:

式中:A0、A1分别表示处理前、后多肽DPPH自由基清除率;A2、A3表示处理前、后多肽O2−·清除率;A4、A5表示处理前、后多肽·OH 清除率。
1.3 数据处理
每组做三次平行试验,采用Excel 对试验数据进行整理,SPSS 20.0 软件对数据进行差异显著性分析,结果用“平均值±标准差”表示,使用Origin 8.5 绘图。
2 结果与分析
2.1 红花籽蛋白酶解产物及不同分子量多肽抗氧化活性测定
测定酶解产物及各超滤组分DPPH 自由基、O2−·及·OH 自由基清除率以评价不同组分的抗氧化活性。分离后的红花籽蛋白多肽SSPH-Ⅰ、SSPH-Ⅱ组抗氧化活性显著高于酶解产物(P<0.05),SSPH-Ⅲ、SSPH-Ⅳ组抗氧化活性对比分离前显著降低(P<0.05)(见图1),多肽的抗氧化活性与分子量大小、氨基酸组成种类及排列顺序有关[23],超滤分离后,分子量较小的红花籽多肽抗氧化活性显著高于酶解产物和分子量较大多肽(P<0.05),这可能是因为超滤分子量小的多肽具有较小的空间位阻,可以作为更好的电子供体,与自由基发生反应,将其转化为更稳定的最终产物,这与桃仁、玉米及紫苏籽等大部分植物蛋白肽研究结果相同,同样发现分子量较小的多肽自由基清除率较高[24−26]。因此,只对初步分离后SSPH-Ⅰ和SSPH-Ⅱ的抗氧化活性稳定性进行研究。
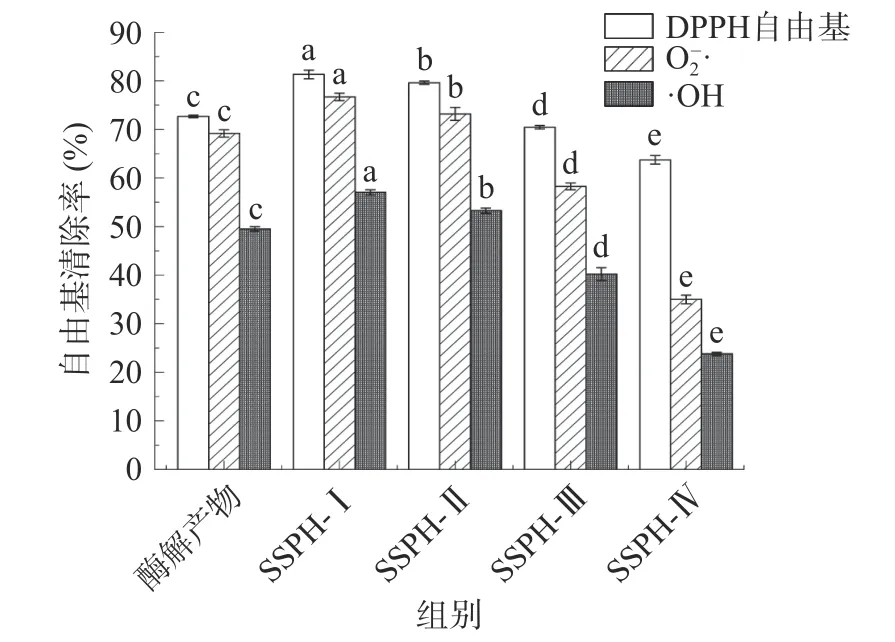
图1 红花籽蛋白酶解产物及不同分子量多肽抗氧化活性测定Fig.1 Determination of antioxidant activity of different molecular weight polypeptides and proteolytic products of safflower seed
2.2 红花籽蛋白抗氧化肽活性稳定性研究
2.2.1 温度对红花籽不同分子量多肽抗氧化稳定性的影响 温度升高对SSPH-Ⅰ和SSPH-Ⅱ多肽组分DPPH 自由基、O2−·及·OH 清除率的影响并不明显(图2),SSPH-Ⅱ组O2−·和·OH 清除能力维持率虽在100 ℃时出现波动,但121 ℃时各自由基清除能力维持率最低仍维持93%左右。SSPH-Ⅰ与SSPH-Ⅱ抗氧化活性对温度的敏感度都较低,这与玉米肽在高温环境下仍能保持抗氧化活性相似[25]。这可能是因为肽段的分子量较小,在不超过某个特定温度的条件下,肽的结构变性较少,也可能是因为,肽的结构较简单,没有受高温分解发生不可逆变性,且红花籽蛋白耐热性氨基酸含量高,红花籽多肽可能含有如Pro 等能表现出抗热、抗盐的氨基酸基团[9,27]。因此,在热稳定性测定中,SSPH-Ⅰ与SSPH-Ⅱ的抗氧化活性受高温影响较小。
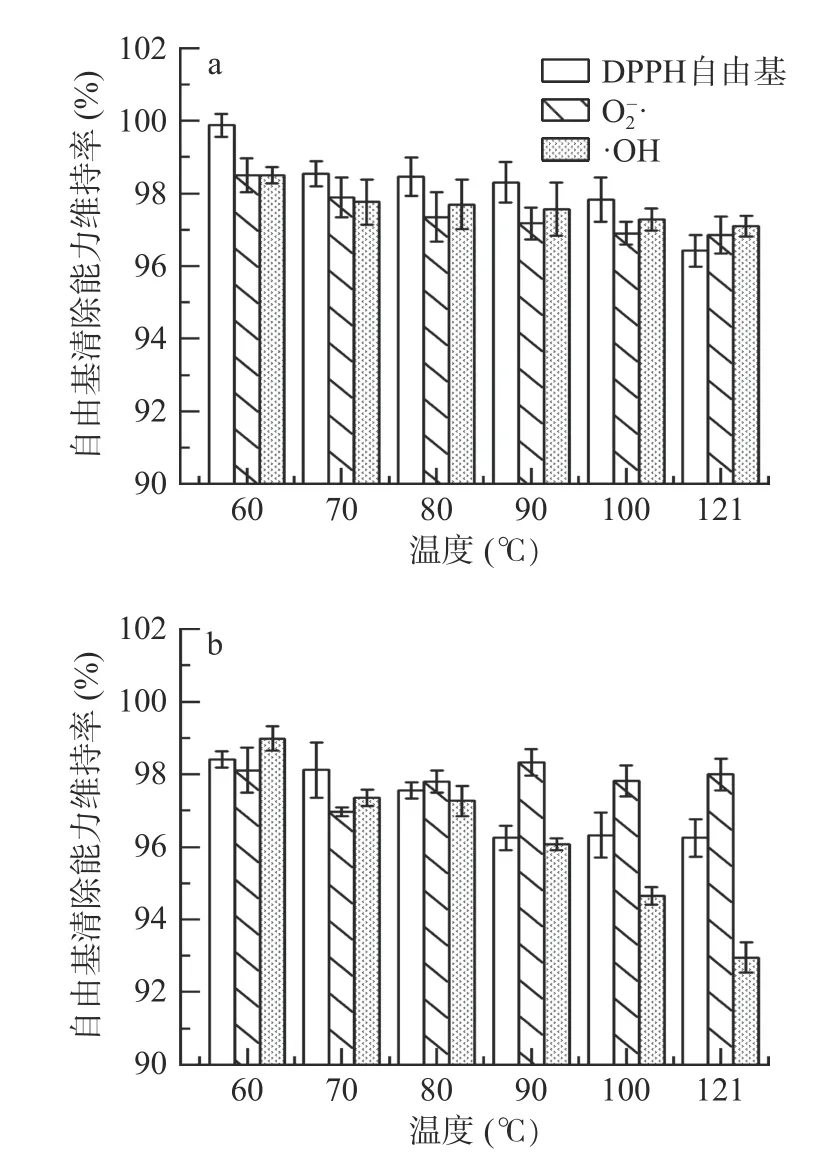
图2 温度对SSPH-Ⅰ(a)和SSPH-Ⅱ(b)抗氧化活性的影响Fig.2 Effects of temperatures on antioxidant activities of SSPH-Ⅰ (a) and SSPH-Ⅱ (b)
2.2.2 pH 对红花籽不同分子量多肽抗氧化稳定性的影响 不同pH 环境下,SSPH-Ⅰ、SSPH-Ⅱ各自由基清除能力维持率具有显著性差异(P<0.05),在强酸强碱环境下,两者DPPH 自由基、O2−·及·OH 清除能力维持率都显著降低(P<0.05),只维持在40%左右,而pH 在6~8 时,SSPH-Ⅰ及SSPH-Ⅱ的各自由基清除能力维持率最高达到98%左右(见图3)。这是因为在强酸强碱环境下,红花籽抗氧化肽SSPH-Ⅰ和SSPH-Ⅱ发生外消旋或脱酰胺反应,其含有的L-型氨基酸部分转化为D-型氨基酸,形成D-和L-型多肽混合物,引起了化合物极性、空间位置等结构性质的改变,当在强碱性条件下还可能会消耗红花籽多肽提供清除自由基效果的氢供体上的氢,影响多肽带电荷性质,导致活性下降[28],这与元宝枫籽抗氧化肽在过酸过碱环境中活性显著下降得到的结果一致[29],因此,弱酸弱碱环境对红花籽抗氧化肽活性影响较小。
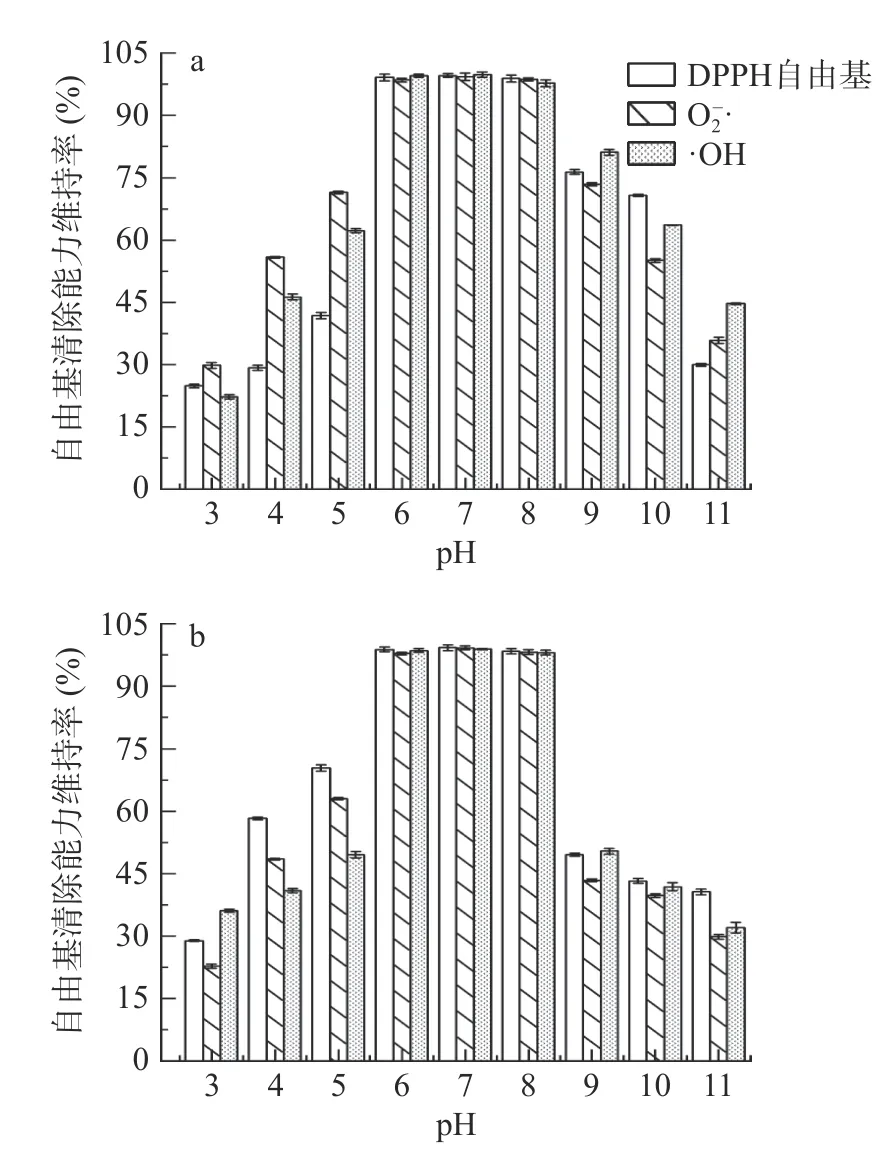
图3 pH 对SSPH-Ⅰ(a)和SSPH-Ⅱ(b)抗氧化活性的影响Fig.3 Effects of pH on antioxidant activity of SSPH-Ⅰ(a) and SSPH-Ⅱ (b)
2.2.3 食品原辅料对红花籽蛋白不同分子量多肽抗氧化稳定性的影响
2.2.3.1 NaCl 对红花籽不同分子量多肽抗氧化稳定性的影响 添加不同浓度NaCl 对红花籽抗氧化肽SSPH-Ⅰ和SSPH-Ⅱ两组分的DPPH 自由基、O2−·及·OH 的清除率维持率影响不明显(见图4),SSPH-Ⅰ与SSPH-Ⅱ的自由基清除能力维持率随着NaCl浓度的增加,呈现不断增加的趋势,当NaCl 浓度为10 g/100 mL 时,SSPH-Ⅰ各自由基清除能力维持率分别增加至108%、107%、105%;SSPH-Ⅱ各自由基清除能力维持率分别增加至105%、106%、104%左右,这可能是因为加入NaCl 后,离子化的Na+和Cl−会打破肽的电荷平衡,使溶液体系中的离子强度发生变化,增强自由基清除能力,这与紫花芸豆和鱼胶原蛋白肽研究得到的结果相似[30−31]。由此可见,一定浓度的NaCl 可以对多肽抗氧化活性产生增效协同作用。
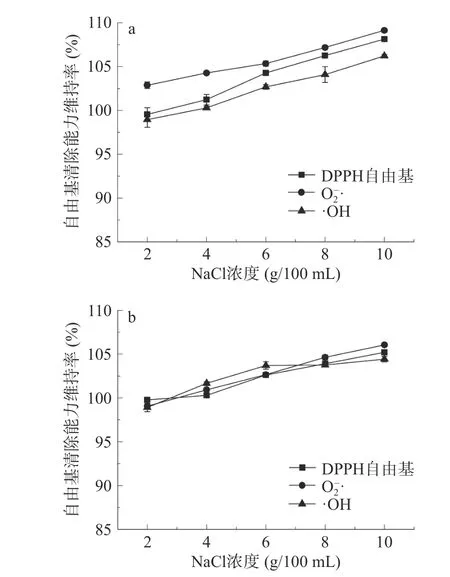
图4 NaCl 对SSPH-Ⅰ(a)和SSPH-Ⅱ(b)抗氧化活性的影响Fig.4 Effect of NaCl on antioxidant activity of SSPH-Ⅰ(a)and SSPH-Ⅱ(b)
2.2.3.2 蔗糖和葡萄糖对红花籽不同分子量多肽抗氧化稳定性的影响 添加蔗糖和葡萄糖对红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)活性的影响如图5 所示,蔗糖含量在2~10 g/100 mL 范围内时,SSPH-Ⅰ三种自由基清除能力维持率均保持在95%以上,SSPH-Ⅱ三种自由基清除能力维持率保持在93%以上,两种分子量多肽的抗氧化活性均未见明显变化。葡萄糖含量在2~10 g/100 mL 范围时,SSPH-Ⅰ三种自由基清除能力维持率相比添加蔗糖明显上升,最高浓度下增加至106%,SSPH-Ⅱ的三种自由基清除能力维持率也有所上升,最高浓度下增加至104%(见图5)。葡萄糖对红花籽抗氧化肽活性的影响大于蔗糖,可能是因为100 ℃加热条件下,葡萄糖加入后发生美拉德反应,生成醛、酮等还原性物质在一定程度上提高了抗氧化能力,而蔗糖不属于还原糖,不与多肽发生反应,证实了高温下还原糖与多肽结合产生某些物质能增强抗氧化活性这一结论,且与芝麻多肽美拉德反应后抗氧化活性提高得到的结果相似[32]。因此,在试验浓度范围内,葡萄糖的添加能增强SSPH-Ⅰ和SSPH-Ⅱ的抗氧化活性,添加蔗糖对其活性影响不大。
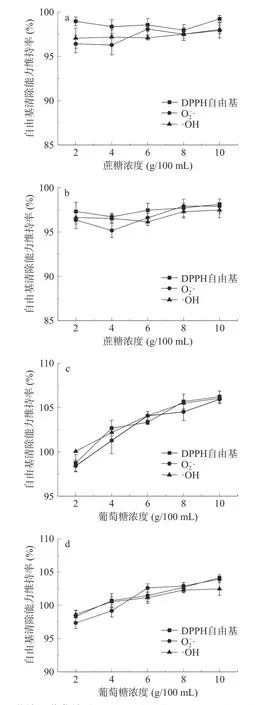
图5 蔗糖和葡萄糖对SSPH-Ⅰ(a、c)和SSPH-Ⅱ(b、d)抗氧化活性的影响Fig.5 Effects of sucrose and glucose on antioxidant activities of SSPH-I(a,c)and SSPH-II(b,d)
2.2.3.3 柠檬酸对红花籽不同分子量多肽抗氧化稳定性的影响 在红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)中添加一定浓度的柠檬酸,能够提升SSPH-Ⅰ和SSPH-Ⅱ自由基清除能力。一定浓度范围内,柠檬酸的浓度越高,SSPH-Ⅰ的各自由基清除活性越高,当浓度为0.2 g/100 mL 时,各自由基维持率提高了3%~5%(图6a),这可能是因为柠檬酸中的羧基或羟基可能会与肽链上的某些氨基酸残基结合成为供氢体,从而增加自由基清除率。柠檬酸浓度对SSPH-Ⅱ各自由基清除率影响较小,这可能是由于柠檬酸分子的羟基结构对抗氧化剂起到稳定的作用,故当浓度最大时,各维持率接近100%(图6b),与菜籽肽添加柠檬酸后活性稳定结果一致[15]。柠檬酸溶液虽然呈酸性,但试验中的浓度范围对于体系pH 影响较小,可忽略不计。因此,柠檬酸有助于提升SSPH-Ⅰ自由基清除能力,对SSPH-Ⅱ活性无明显影响。
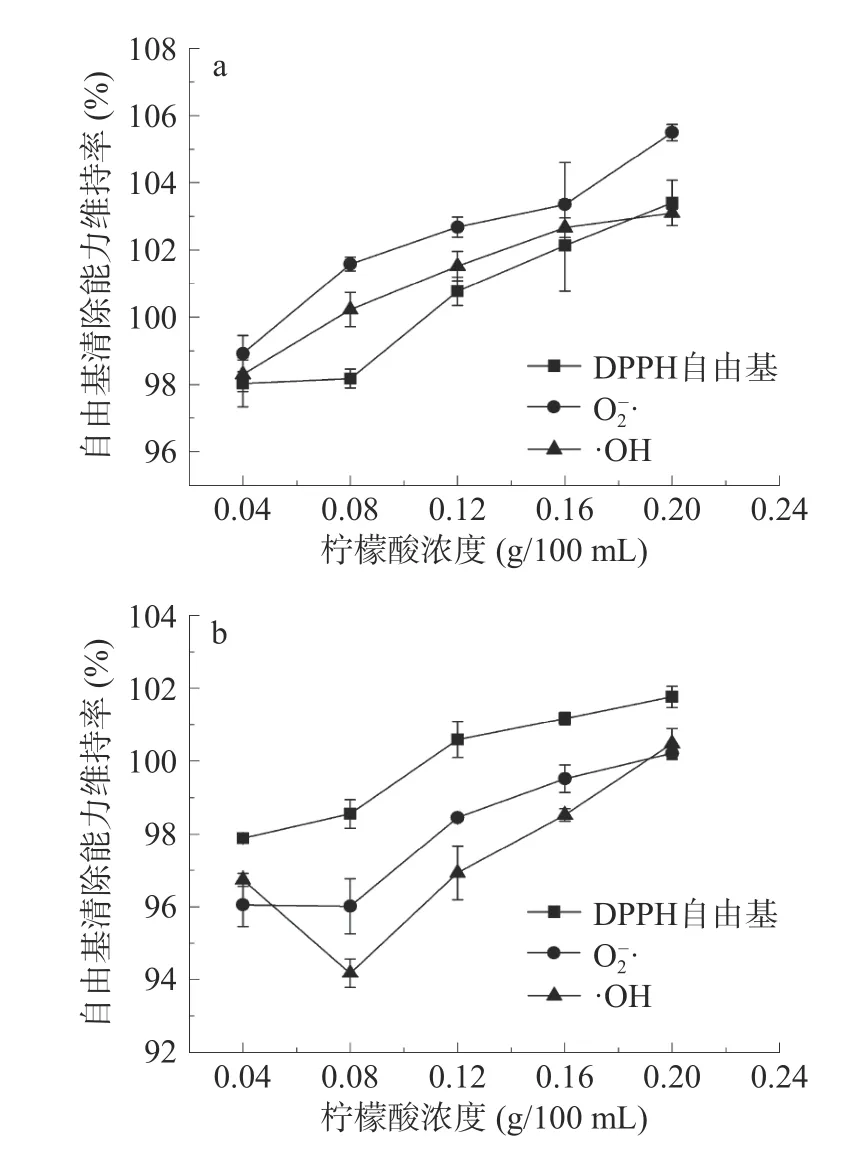
图6 柠檬酸对SSPH-Ⅰ(a)和SSPH-Ⅱ(b)抗氧化活性的影响Fig.6 Effect of citric acid on antioxidant activity of SSPH-Ⅰ(a)and SSPH-Ⅱ(b)
2.2.3.4 防腐剂对红花籽不同分子量多肽抗氧化稳定性的影响 防腐剂是食品加工过程中常用的食品添加剂。两种常见防腐剂山梨酸钾和苯甲酸钠添加后对SSPH-Ⅰ与SSPH-Ⅱ的活性稳定性影响较小(见图7)。添加一定浓度山梨酸钾后,如图7a、b 所示,SSPH-Ⅰ活性维持率出现先下降后趋于稳定的趋势,SSPH-Ⅱ活性维持率呈缓慢下降趋势;添加一定苯甲酸钠后(图7c、d),SSPH-Ⅰ和SSPH-Ⅱ活性维持率都呈现下降趋势,在两种防腐剂添加浓度达到最大时,SSPH-Ⅰ各自由基维持率最低达到85%以上,SSPH-Ⅱ各自由基维持率最低在83%以上。因此,在规定使用浓度范围内,两者不会对SSPH-Ⅰ和SSPH-Ⅱ自由基清除能力造成严重干扰,红花籽抗氧化肽依然能保持较好的抗氧化功效,这与小米醇溶蛋白肽防腐剂对其稳定性影响的研究结果相似[33]。
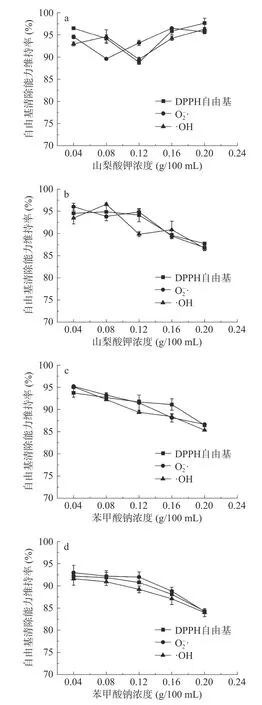
图7 山梨酸钾和苯甲酸钠对SSPH-Ⅰ(a、c)和SSPH-Ⅱ(b、d)抗氧化活性的影响Fig.7 Effects of potassium sorbate and sodium benzoate on antioxidant activities of SSPH-Ⅰ(a,c)and SSPH-Ⅱ(b,d)
2.2.4 金属离子对红花籽不同分子量多肽抗氧化稳定性的影响 食品在加工、储藏和运输中不可避免地要接触各种金属容器,不同金属离子对红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)活性影响差异显著(P<0.05),添加金属离子后SSPH-Ⅰ与SSPH-Ⅱ自由基清除能力维持率显著下降(P<0.05),不同金属离子对SSPH-Ⅰ影响排序为Cu2+>Zn2+>K+>Mg2+>Ca2+,添加Cu2+后,各活性维持率仅在55%、54%、55%左右。金属离子对SSPH-Ⅱ影响排序为Zn2+>Cu2+>K+>Mg2+>Ca2+,添加Zn2+后,各活性维持率仅在52%、53%、52%左右(见表1)。这可能是因为其破坏了多肽之间的特殊化学力作用,导致溶解度降低、疏水基团外露等性质改变[34]。因此,在加工应用过程中应避免与Cu2+、Zn2+等金属离子接触,保持抗氧化活性稳定。
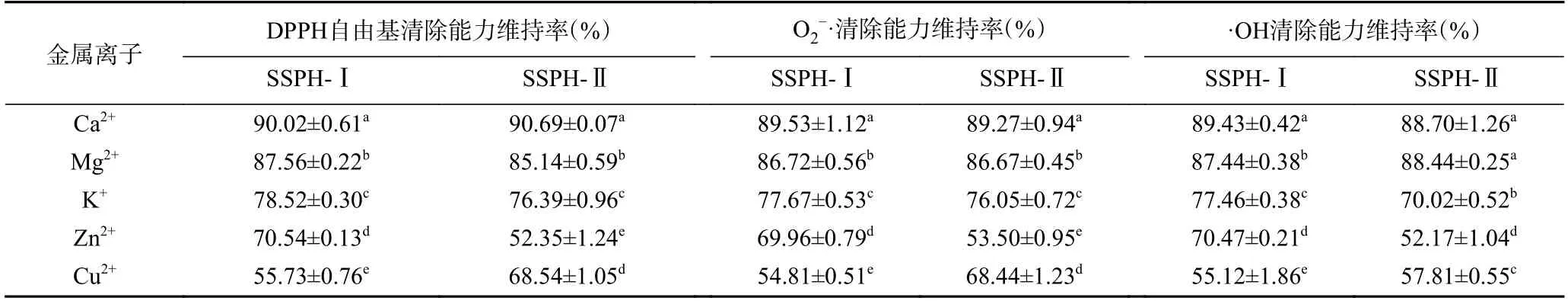
表1 不同金属离子对红花籽不同分子量多肽活性稳定性影响Table 1 Effects of different metal ions on the activity and stability of polypeptides with different molecular weights in safflower seed
2.2.5 体外模拟胃肠消化对红花籽蛋白及不同分子量多肽抗氧化活性影响 红花籽蛋白及不同分子量多肽经体外模拟胃肠消化后三种自由基清除率差异较大(图8)。总体来看,消化各个阶段的SSP 抗氧化活性显著低于酶解分离后的多肽(P<0.05),且胃消化对自由基清除活性影响显著小于肠消化(P<0.05);SSPH-Ⅰ在胃消化2 h 前、后各自由基清除能力无显著差异(P>0.05);肠消化3 h 后各自由清除能力显著下降(P<0.05),但维持率仍在80%以上。SSPH-Ⅱ在胃消化后各自由基清除率对比消化前显著下降,肠消化后下降更为显著(P<0.05),三种自由基维持率最高仅为77%,这与菠萝蜜籽抗氧化肽胃肠消化得到的结果相似,在胃肠消化一段时间后活性下降[9]。这可能是因为SSPH-Ⅰ分子量较小,结构简单,酶解位点酶切完全,在消化过程中结构没有被破坏,活性较稳定,对胃肠消化酶具有一定耐受度;而SSPH-Ⅱ抗氧化活性显著下降,是由于SSPH-Ⅱ肽链长度与结构较为复杂,更多的疏水基团被酶解反应破坏,氨基酸排列顺序及结构发生改变,抗氧化活性降低,也可能是因为其在模拟肠道消化过程中对环境变化较敏感,结构发生变化,导致抗氧化活性降低[9,35−36]。综合来看,SSPH-Ⅰ(<3 kDa)对体模拟胃肠消化有更强的耐受性。
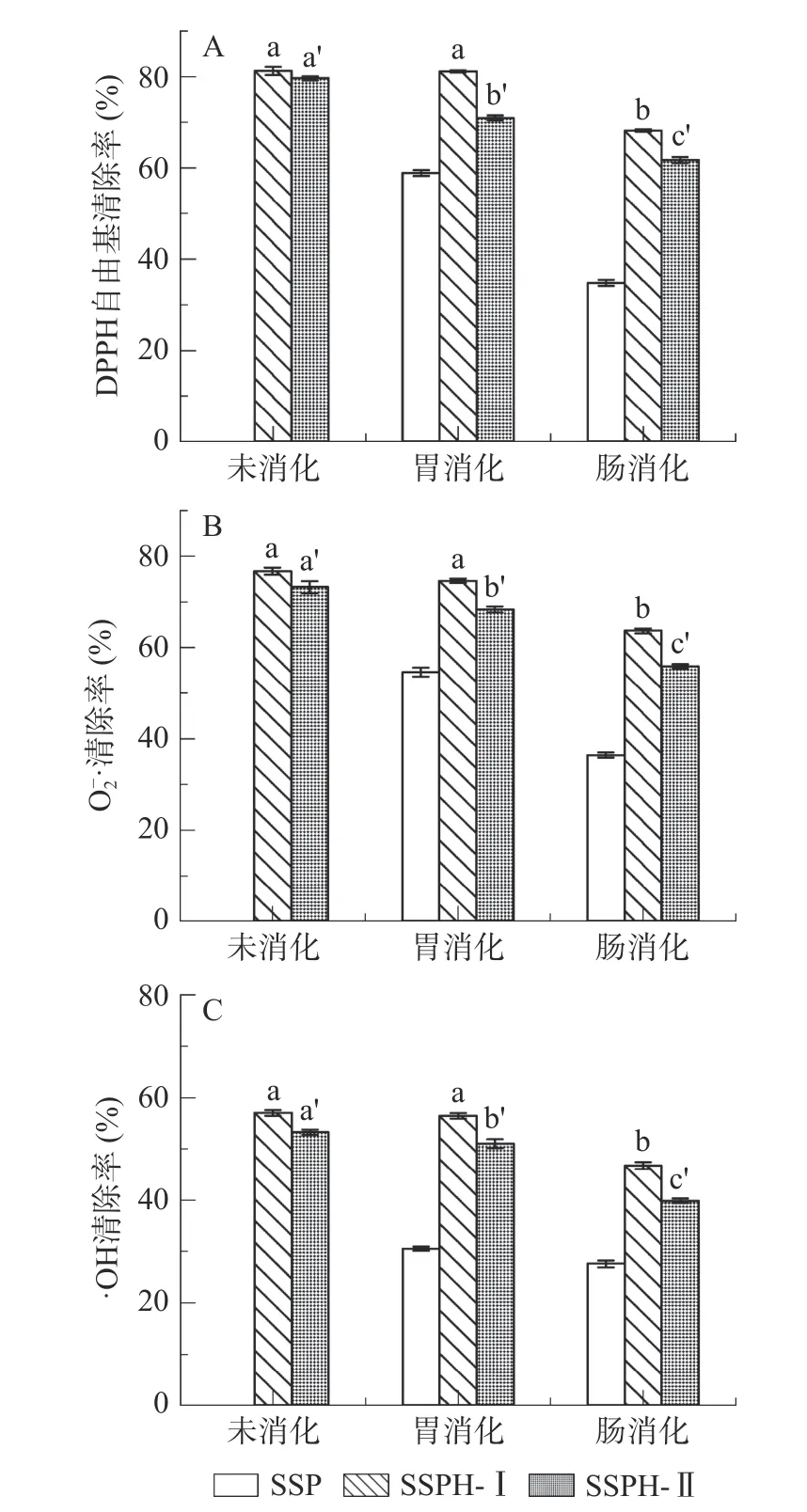
图8 红花籽蛋白及不同分子量多肽体外模拟消化抗氧化活性变化Fig.8 Antioxidant activity of safflower seed protein and different molecular weight polypeptides during simulated digestion in vitro
3 结论
本试验研究了加工、贮藏及模拟胃肠消化等环境因素对不同分子量红花籽抗氧化肽稳定性的影响。红花籽蛋白复合酶水解后对酶解产物超滤分离,分离后SSPH-Ⅰ与SSPH-Ⅱ抗氧化活性显著上升(P<0.05),以DPPH 自由基、O2−·及·OH 清除能力维持率为指标,考察不同分子量抗氧化肽活性稳定性,筛选得到了抗氧化稳定性高的多肽组分(<3 kDa),在高温、弱酸弱碱环境下能保持抗氧化活性稳定,添加一定浓度NaCl、柠檬酸和葡萄糖对SSPH-Ⅰ抗氧化活性具有增效协同作用,蔗糖、防腐剂对其抗氧化活性影响不明显,常见金属离子对红花籽抗氧化肽的稳定性影响不一,在应用过程中避免与Cu2+、Zn2+等金属离子接触,经模拟胃肠消化,SSPH-Ⅰ在模拟胃消化时活性较稳定,在模拟肠消化时活性下降显著(P<0.05),但维持率仍在80%以上。本文初步得到<3 kDa 分子量红花籽抗氧化肽活性较强且在常见加工过程及模拟胃肠消化环境影响下活性较稳定,后续可对其进一步纯化,研究体内活性发挥效果,为新型抗氧化肽功能性产品的开发与工业化应用提供理论依据,促进红花产业的经济与发展。
