基于脱氧核酶的食品安全快速检测方法研究进展
2022-07-08谌委菊雷艳丽
曾 瑜 谌委菊 全 珂 雷艳丽
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410114;2. 细胞化学湖南省重点实验室,湖南 长沙 410114)
食品在加工、运输、贮存等过程中易引入有害物质,如重金属、病源微生物、非法添加剂等,使得食品质量与安全面临严峻考验[1]。近年来,随着食品安全事件的频繁爆发,食品安全已发展成为危害人体健康的全球性问题。全球每年约6亿人口因食用被污染的食物而生病,其中42万人口因此丧生[2]。传统的食源性有害物质分析方法包括高效液相色谱法[3]、液质联用法[4]、聚合酶链式反应[5]、免疫分析法[6]等,具有良好的准确性和灵敏度,但是存在仪器昂贵、样品前处理过程复杂且对操作者专业素养要求高等不足,难以实现食物样品的现场快速检测。因此,发展高效、简便的食源性有害物传感技术已成为当前食品安全领域关注的焦点。
脱氧核酶(DNAzyme)是一类经指数富集的配基系统进化筛选技术获得的,具有高特异性底物识别能力和高效催化能力的单链DNA分子[7]。Breaker等[8]发现短的单链DNA可以催化RNA磷酸二酯键水解断裂,并提出了脱氧核酶的概念。脱氧核酶的发现打破了人们对DNA是一种结构、功能单一的惰性分子的认知。随后一系列具有不同催化活性的脱氧核酶被相继发现,如介导核酸连接、磷酸化等[9]。与传统的蛋白质酶相比,脱氧核酶具有以下优势:① 性质稳定,在高温、极度酸碱环境下发生变性后可复性,且复性前后催化活性基本没有变化,便于存储与运输;② 易化学合成与修饰,合成成本低且批次差异小;③ 依赖特定辅因子激活催化活性,辅因子种类丰富,涉及金属离子、小分子、氨基酸、蛋白质、致病微生物等;④ 结构柔软,可设计性强,如能对其进行劈裂处理或改变其催化构象;⑤ 基于其核酸本质,能够与滚环扩增(RCA)[10]、杂交链式反应(HCR)[11]等核酸等温扩增技术完美结合,在不借助特定仪器设备的情况下对检测信号进行放大。因此,基于上述优点,脱氧核酶为开发高灵敏、高效的临场检测方法提供了理想的分子工具,近年来在食品安全检测领域得到了广泛应用。
研究拟综述基于脱氧核酶的食品安全快速检测方法的研究进展,以期为食品有害物的现场检测提供借鉴。
1 脱氧核酶的结构与活性
1.1 具有RNA切割活性的脱氧核酶
根据催化功能的不同,当前脱氧核酶大体可以分为5类:① 具有核酸切割活性的脱氧核酶[12];② 具有核酸连接活性的脱氧核酶[13];③ 具有DNA激酶活性的脱氧核酶[14];④ 具有DNA戴帽活性的脱氧核酶[15];⑤ 具有过氧化物酶活性的脱氧核酶[16]。其中,具有RNA切割活性的脱氧核酶应用最为广泛。该类核酶由催化功能域和位于两侧的结合臂组成,其可通过结合臂与底物序列进行碱基互补配对进而发生特异性结合,在金属离子或生物分子等辅因子作用下,诱导催化功能域折叠形成特定的二级结构,随后催化底物序列中RNA碱基上的2′-OH位置发生酯交换反应,最终将底物链裂解成两段[17-18]。
以筛选过程中第10轮循环中的第23个克隆(10-23)和第8轮循环中的第17个克隆(8-17)2种研究最为深入的脱氧核酶为例,两者的辅因子均为Mg2+,前者能够识别并催化RNA底物的5′-R/Y-3′位点断裂(Y为嘧啶核苷酸,R是嘌呤核苷酸),后者能够识别并催化RNA底物的5′-G/rA-3′位点断裂(图1)[19]。研究[19]表明,这2种脱氧核酶催化功能域的碱基序列高度保守,且决定了其具体切割位点,催化功能域的碱基突变会导致脱氧核酶催化活性降低甚至丧失。与之不同,脱氧核酶的结合臂为可变序列,可根据底物RNA的具体序列进行灵活调节。因此,脱氧核酶的催化域决定了其催化活性的高低(或有无),而结合臂则决定了其底物选择性。此外,脱氧核酶结合臂的长度还将影响其催化的周转率。随着结合臂长度的增加,脱氧核酶与底物的杂交稳定性逐渐增加,有助于两者靠近结合。但当稳定性过强,脱氧核酶切割底物产生的断裂片段不易从脱氧核酶上解离下来,将阻碍下一个底物与核酶结合,进而影响脱氧核酶循环。最佳的结合臂长度取决于底物的序列组成和反应条件。

图1 脱氧核酶8-17和10-23催化域的序列信息[19]
1.2 具有过氧化物酶模拟活性的脱氧核酶

根据G-四链体中链的走向差异进行划分,可分为平行G-四链体、反平行G-四链体和混合型G-四链体(图2),而G-四链体的拓扑结构与G4/hemin-DNAzyme的催化活性密切相关。有研究[23-24]报道,平行结构有利于氯化血红素通过末端堆叠的方式与其配位,因而平行G-四链体结构能够结合更多血红素,催化活性明显高于其他几种结构。G4/hemin-DNAzyme的催化活性还受G-四链体所结合的阳离子种类、环部及末端序列的影响。例如,相比于G-四链体3’-端,只有在5’-端增加胸腺嘧啶(T)才能明显提高G4/hemin-DNAzyme的催化活性[25]。此外,对辅因子血红素进行优化或化学修饰亦可以改善G4/hemin-DNAzyme的催化活性。如Liu等[26]发现带组氨末端的氯化血红素与G-四链体的结合能力得到明显改善,因而所形成的复合体催化活性也得以增强。
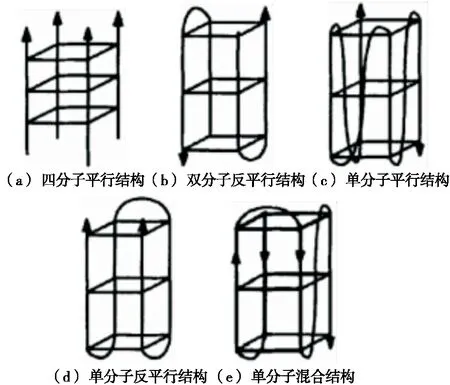
图2 G-四链体的结构示意图[21]
G-三链体由G-三分体平面堆叠组成,存在时间短,稳定性较差,被认为是G-四链体形成过程中的中间态[27]。与G-四链体相比,虽然G-三链体在拓扑结构上存在明显差异,但是具有类似的过氧化物酶模拟活性。此外,由于基于G-三链体的分子探针涉及更少的G-C碱基对,因此在设计上更为灵活,近年来引起了科研者的广泛关注。
基于G4/hemin-DNAzyme、G3/hemin-DNAzyme的催化特性,目前该类酶已被用作信号输出单元用于构建各种各样的生化传感器。例如,利用该类酶模拟辣根过氧化物酶活性,催化H2O2氧化ABTS产生颜色变化,进而构建比色型传感器(图3)[28-29];催化鲁米诺产生化学发光,构建荧光型传感器(图3)[30]。还可将G4/hemin-DNAzyme修饰在电极上,通过催化H2O2氧化还原性底物产生电信号变化,构建电化学传感器[31-32]。
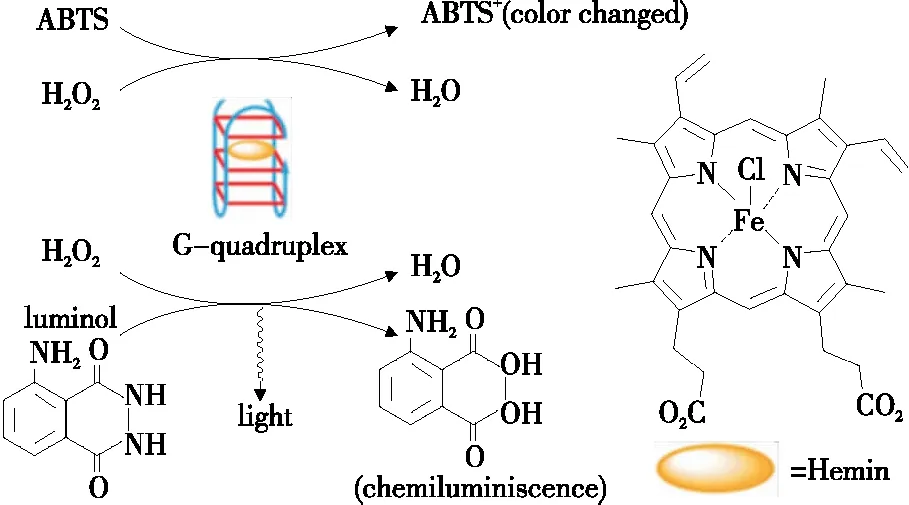
图3 G-四链体/血红素的过氧化物酶模拟脱氧核糖核酸酶[28]
2 脱氧核酶在食品安全检测中的应用
2.1 重金属离子的检测
重金属具有危害性大、生物富集性强的特征,其会经工业三废进入食物链,在人体内积累可引起慢性中毒甚至死亡。建立痕量重金属离子检测技术成为迫切需求,对于防止重金属摄入、保障食品安全具有重要意义。传统的重金属分析方法(如电感耦合等离子体质谱法、原子吸收/发射光谱法)虽然具有准确度、灵敏度高的优点,但涉及复杂的样品前处理和大型仪器设备,难以满足食品样品日常快速检测需求[33]。目前,已有以铅[34]、汞[35]、镉[36]、铜[37]等重金属为辅因子的特异性脱氧核酶相继被筛选出。利用脱氧核酶对靶标金属离子的高亲和力,可开发重金属离子选择性激活的脱氧核酶探针,在此基础上,对核酶探针进行化学修饰或结合纳米材料,构建荧光、比色、电化学传感平台,有望实现对食源性重金属离子的快速、精准检测。
例如,Vijitvarasan等[38]基于脱氧核酶开发了一种适用于现场的纸质扫描法检测Pb2+。首先,将含核酶切割位点(rA位点)底物链修饰于AuNP上,Pb2+特异性核酶链修饰在磁性微珠(MB)上。两者混合后,经底物链和核酶链杂交,可形成MB-脱氧核酶-AuNP复合物。在Pb2+存在下,脱氧核酶被激活,将底物链切割成长短不一的两个片段。附着在AuNP上的DNA短链与核酶链结合不稳定,容易地从复合体中脱落下来。故施加磁场后,可将AuNP从MB-DNAzyme-AuNP复合物中分离出来。收集上清液中的AuNP并在色谱纸上点样进行浓缩,然后采用银增强剂溶液处理。由于硝酸银能在AuNP表面被还原为灰色的银颗粒,且银沉积量与Pb2+的浓度呈正比,因而可根据灰色强度定量分析Pb2+。该方法能选择性检测河水中的Pb2+,检测限为1.1 nmol/L。在该设计中,由于底物链修饰于信号输出基元(AuNP)上,因而底物链加入的比例需小于或等于核酶链,否则易造成假阳性。然而有限的底物链则制约了核酶本身循环切割底物的放大效应,导致检测灵敏度不佳。
为了避免上述问题,Wang等[39]在设计中引入催化发卡自组装放大技术,开发了一款基于脱氧核酶的便携式微流控装置用于饮用水中Cd2+的超灵敏检测。其原理如图4所示,当引用水中存在Cd2+时,Cd2+能特异性激活脱氧核酶切割底物,产生并释放短的切割片段。后者可打开DNA发卡结构1(H1),暴露与DNA发卡结构2(H2)杂交位点。由于H2与H1的结合力强于切割片段,故H2能够竞争性将切割片段挤下来,得到H1和H2的杂交体(H1H2),实现催化发卡自组装。释放出的切割片段又可诱发下一轮催化发卡自组装,如此循环,即可得到大量H1H2。H1H2的黏性末端能分别与DNA功能化的磁性微珠(MMP)和聚苯乙烯微珠结合,得到MMPs-H1H2-PMPs复合体。将整个反应体系转移到微流控芯片上,在引入磁场分离MMPs-H1H2-PMPs复合体后,由于进入微孔道的PMPs减少,孔道中的液面柱高明显低于无Cd2+的水样。
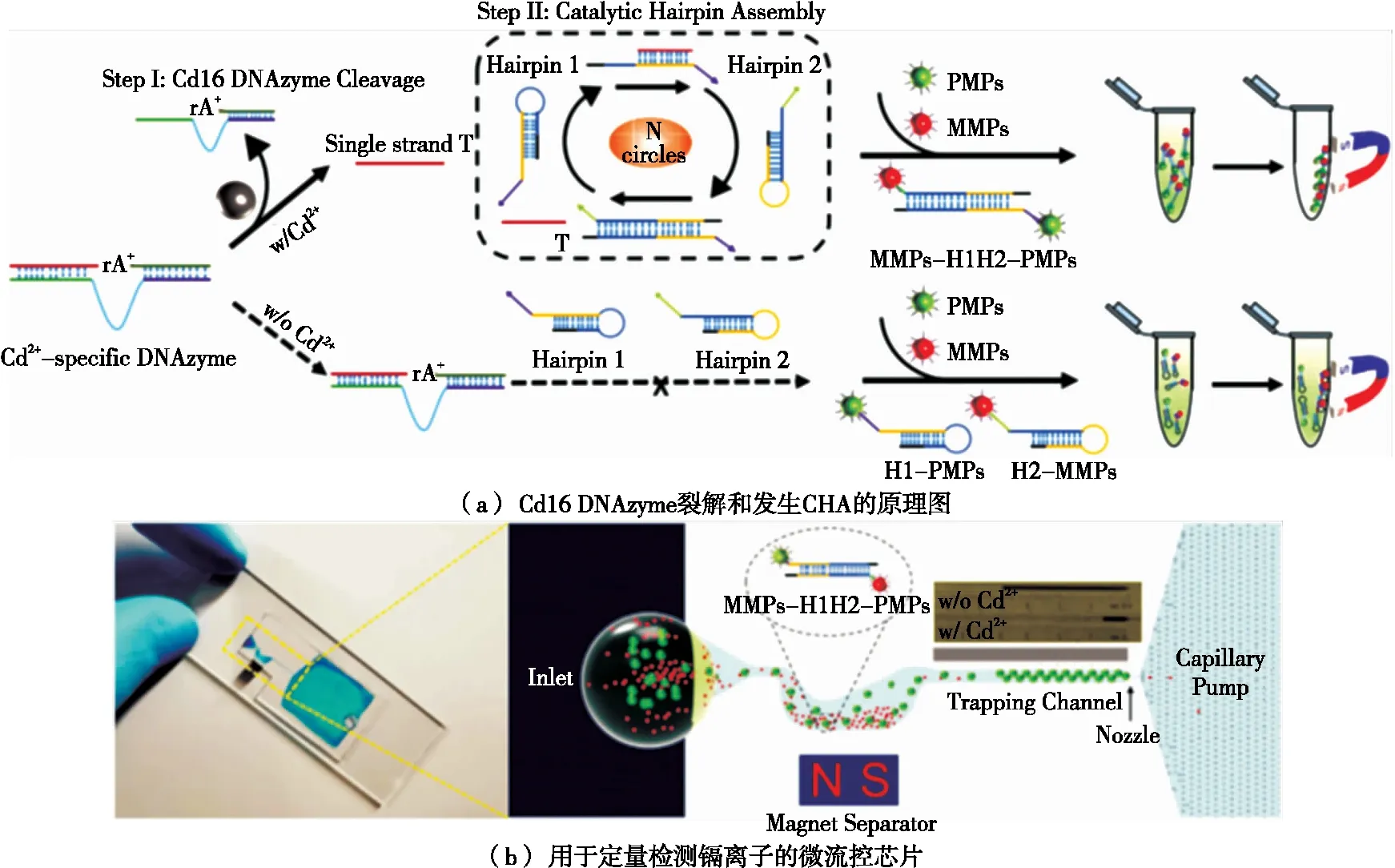
图4 使用脱氧核酶功能化微流控芯片可视化检测饮用水中的镉离子[39]
与上述检测体系不同,Lim等[40]采用了具有过氧化物酶模拟活性的G-四链体构建比色型3D打印芯片,用于饮用水中无机汞离子(Hg2+)的检测研究。首先使用3D打印技术制造x含环形DNA模板的一次性芯片,在无Hg2+存在时,含12个T碱基的引物可与环形DNA模板特异性杂交并触发滚环扩增反应(RCA)产生含多个G-四链体结构的长链序列。G-四链体结构结合氯化血红素后可催化H2O2氧化ABTS发生颜色变化。而当Hg2+存在时,由于Hg2+可与引物上的T碱基结合形成T-Hg2+-T复合物[41],无法引发RCA反应生成G-四链体,因而最终不能观察到溶液颜色变化。由于引入了RCA核酸放大技术,该芯片可灵敏检测自来水样品中的Hg2+,检测限低至3.6 μg/L。该策略将检测平台转移到芯片上,实现了设备的微型化,在此基础上采用裸眼可观察的比色信号输出模式,有望在现场、快速检测方面取得突破。
2.2 食源性致病菌的检测
食源性致病菌是指通过食物或饮用水进入人体,并引起机体功能障碍的致病性微生物,主要包括大肠杆菌O157:H7、单增李斯特菌、金黄色葡萄球菌、沙门氏菌、幽门螺杆菌等。当前,食源性致病菌污染已成为食品安全问题的重要来源,对公共卫生体系造成了巨大冲击。尽早发现并实现致病菌的现场快速检测,对于避免致病菌引起的疾病暴发及减少其持续流行所带来的负面影响具有重要意义。然而传统检测技术,如菌落形态观察、生物发光法、聚合酶链式反应法等,难以满足快速检测需求[42]。以DNA为基础的脱氧核酶将分子识别元件和催化信号放大元件双重功能集成于一体,在致病菌的快速、灵敏检测中显示出良好的应用前景。
如Yousefi等[43]基于脱氧核酶设计了一种应用于食品包装袋上的生物传感器,旨在通过食品包装袋即可实时评估大肠杆菌污染情况,检测原理如图5所示。该传感器通过将大肠杆菌特异性响应的荧光脱氧核酶探针与透明的环烯烃聚合物薄膜(COP)共价连接而成。当大肠杆菌存在时,荧光脱氧核酶探针被激活,进而切割rA位点产生标记有淬灭基团的短链。由于短链与脱氧核酶臂结合不稳定,可从脱氧核酶上脱落下来,使得荧光基团和淬灭基团相互远离,荧光恢复。试验结果显示,这种生物传感器在pH为3~9条件下至少能稳定保存14 d,并且能实现肉、苹果汁中大肠杆菌的即时检测,检测限低至103CFU/mL。该检测方法简单、快速,但是由于核酶探针直接与食品接触,因此有两个方面的问题值得关注:① 保证核酶探针在复杂食品基质中的稳定性是实现精准检测的关键;② 引入化学荧光基团的安全性,以及消费者的认可度。

图5 通过在食品包装上打印大肠杆菌激活的脱氧核酶探针实时监测食品污染的原理图[43]
而将核酶探针与便携式检测平台结合,不仅可以保证检测的便捷性和时效性,还可规避探针与复杂基质长期接触带来的各种隐患。基于这种理念,Ali等[44]利用脱氧核酶构建了便携式纸基传感器检测幽门螺杆菌。其检测原理如图6所示,首先将脱氧核酶修饰于琼脂糖珠上,后者固定在纸基芯片上。在脱氧核酶的5'-末端设计DNA标签,以便通过碱基互补与连接有尿素酶的DNA相结合。当幽门螺杆菌存在时,脱氧核酶发生特异性切割反应,得到含有尿素酶的DNA片段,并随着溶液从纸芯片的传感域移动到检测域。之后,尿素酶水解检测域中的尿素,使溶液pH值升高,最终导致酚红指示剂的颜色由黄色变为红色。该传感器能够灵敏、特异性地检测人类粪便样本中的幽门螺杆菌,并在几分钟内提供结果,检测限低至104CFU/mL。该策略无需借助外界仪器即可完成检测,为食源性致病菌的快速检测提供了新思路。
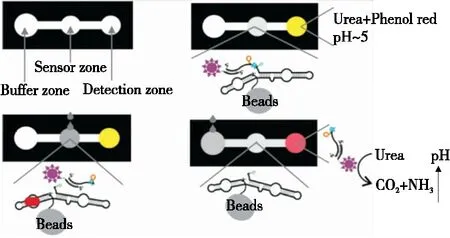
图6 基于脱氧核酶的比色型纸芯片用于幽门螺杆菌检测的原理图[44]
2.3 微生物毒素的检测
微生物毒素是指由细菌或真菌合成分泌的、不可自复制的有毒化学物质,种类繁多且普遍具有致癌、致畸作用。如赭曲霉毒素A是由青霉菌属和曲霉菌属经次级代谢产生的毒素,常见于未妥善保存的谷物、葡萄酒、果汁中,被国际癌症研究机构列为2B类致癌物质[45]。黄曲霉毒素则是由黄曲霉和寄生曲霉等菌株产生的双呋喃环类毒素,常见于发霉的花生、玉米、大米等农产品中,1993年被世界卫生组织划定为1类致癌物[46]。不同于食源致病菌可通过热处理灭活,大多微生物毒素性质稳定,难以被破坏。因此,发展分析准确、鉴定微生物毒素的传感技术是避免毒素中毒最有效的途径。
Zhang等[47]巧妙结合磁分离技术和便携式血糖仪检测平台,开发了功能核酸探针用于赫曲霉素的特异、灵敏分析。其原理如图7所示,通过在磁珠上固定脱氧核酶底物链和特异性识别赫曲霉素的核酸适配体,构建传感平台。其中底物链末端修饰了转化酶,核酸适配体的部分序列可与脱氧核酶杂交,从而使脱氧核酶也锚定于磁珠表面。当赫曲霉素存在时,可诱导核酸适配体发生构象变化释放脱氧核酶。后者则可与底物链结合,在Zn2+的辅助下切割底物,使修饰了转化酶的短链从磁珠表面脱落进入溶液。同时,释放的脱氧核酶又可催化下一个底物断裂,实现循环释放大量短链。溶液中的转化酶可催化蔗糖转化为葡萄糖,后者可通过便携式血糖仪检测。试验表明,该平台能选择性检测食物中的曲霉毒素,检测限为0.88 pg/mL。

图7 基于脱氧核酶放大技术的适配体传感平台检测赫曲霉素的工作原理图[47]
Wang等[48]则开发了基于适体/G-四链体脱氧核酶探针的适体传感器,通过荧光信号变化判断食品中是否存在黄曲霉毒素B1(AFB1)。当AFB1不存在时,重组的G-四链体/氯化血红素体系可催化无荧光邻苯二胺(OPD)生成有荧光的2,3-二氨基吩嗪(DAP)。而当AFB1存在时,将诱导核酸适配体发生构象变化,进而破坏G-四链体/氯化血红素体系,因而检测不到荧光产生。该研究引入磁氧化多壁碳纳米管吸附多余的血红素,有效降低了检测背景信号,从而实现对AFB1的高灵敏检测,检出限低至0.02 ng/mL。相比于比色传感平台,荧光传感平台在检测灵敏度方面具有明显优势,更加适合微生物毒素这种痕量、高危害性食品污染物的检测。
2.4 兽药残留的检测
抗生素是最广泛使用的一类兽药,常被用于防治畜禽传染性疾病和抗寄生虫。残留在畜禽体内的抗生素最终可通过食物链进入人体并富集,从而威胁人类健康[49]。针对抗生素滥用问题,Zhou等[50]构建了一种基于引物交换反应(PER)和脱氧核酶的同步信号放大方法检测卡拉霉素,检测原理如图8所示。当检测样品中存在卡那霉素时,其可诱导核酸适配体发生构象变化,进而从发卡1(HP1)上脱落下来,暴露引物结合位点。之后,引物与HP1杂交,在Bst-DNA聚合酶启动作用下自主合成Mg2+依赖性脱氧核酶序列,该过程可重复进行,产生大量脱氧核酶序列。在Mg2+辅因子的存在下,脱氧核酶循环切割信号发夹底物中的rA位点,释放出大量游离的G-四链体片段。后者与有机染料硫黄素T(ThT)结合后,可显著增强ThT的荧光,从而实现对卡那霉素的高灵敏度检测,检测限低至0.36 nmol/L,且实现对真实牛奶样品中的卡那霉素的检测。

图8 基于引物交换反应和Mg2+依赖性脱氧核酶的同步信号放大检测卡那霉素的平台原理图[50]
同样采用了G-四链体结构,Tang等[51]则利用其过氧化物酶模拟活性实现了对四环素的可视化检测。当检测体系中不存在四环素时,G-四链体结构可顺利结合氯化血红素,之后催化H2O2彻底氧化TMB,颜色由无色变成黄色。当四环素存在时,其可通过π—π堆积力竞争性结合氯化血红素,大大降低G4/hemin-DNAzyme复合体的生成,导致TMB不能被充分氧化,溶液颜色呈绿色。该方法通过简单的颜色变化即可检测四环霉素,检测限为3.1 nmol/L。
总体而言,当前基于脱氧核酶的抗生素检测方法大多需要与核酸适配体结合,通过将核酸适配体对抗生素的特异性识别事件转化为脱氧核酶的激活事件,从而实现抗生素的选择性检测。因此,促进脱氧核酶在抗生素检测方面广泛应用的前提在于丰富识别元件或识别机理。
2.5 其他非法成分的检测
非法食品添加剂、食品接触材料中有害小分子的迁移等是引发食品安全问题的又一来源。针对上述物质开发精确、快速的检测技术是食品安全检测的重要内容之一。如双酚A(BPA)是一种内分泌干扰化合物,即使在非常低的浓度下也会对人体健康产生不利影响[52]。设计可靠、灵敏的双酚A检测方法对于保护食品安全和人类健康具有重要意义。基于此,Pan等[53]将具有信号放大功效的DNA电路与Mg2+依赖性脱氧核酶集成到传感系统,用于检测双酚A。双酚A与结合适配体结合后,可激活DNA电路,通过链置换反应输出大量辅助链。辅助链可稳定Mg2+依赖性脱氧核酶构象,使其在Mg2+存在的情况下能将双标记(FAM和Dabcyl)的底物DNA切割成两段,导致荧光团和猝灭团的分离,产生荧光信号。该生物传感器具有良好的选择性和超高灵敏度,检测限低至50 fmol/L,能实现牛奶样品中双酚A的检测,且检测结果与液相色谱结合质谱(LC-MS)无明显差异。
3 总结与展望
综上所述,脱氧核酶凭借合成成本低、靶标丰富、特异性高、可设计性强的优点,目前已作为信号识别元件或信号输出元件被广泛应用于食品安全检测领域。结合当前研究开发现状和未来实际应用需求,基于脱氧核酶的食品检测传感器在以下3个方面有待改善:① 在实际检测体系中的稳定性,尽管脱氧核酶的热稳定性和耐酸碱性能均优于传统蛋白酶,但脱氧核酶的构象稳定性很大程度依赖于环境中金属离子的含量,而大多数情况下实际检测体系无法满足这一需求。因此,如何提高脱氧核酶在苛刻环境下的构象稳定性应该是未来研究的重点。② 在复杂体系中的抗干扰能力,由于食品基质复杂,脱氧核酶生物传感器在实际应用中面临着其他物质或核酸酶的影响,导致二级结构被破坏。因此,需要综合评价其在不同复杂样品基质中对靶标的特异性、灵敏度以及稳定性等性能,并在此基础上选择性引入化学修饰以提高其抗酶切稳定性。③ 目前大部分研究工作还停留于实验室阶段,检测过程繁琐。与微流控芯片、试纸条、移动设备结合的快速、现场检测方法的开发将是未来的发展方向。随着机理的完善及多学科交叉融合,基于脱氧核酶的分子传感器在检测性能、平台构建、应用革新方面都将得到完善,有望在食品安全分析领域发挥重要作用。
