DWI对盆腔肿瘤放疗后骨盆不全性骨折与骨转移的鉴别诊断*
2022-07-08黄昭君吴巍裴宇覃媛媛冯朝燕刘栋
黄昭君, 吴巍, 裴宇, 覃媛媛, 冯朝燕, 刘栋△
1松滋市人民医院放射科(湖北荆州 434200); 2华中科技大学同济医学院附属同济医院放射科(湖北武汉 430030)
近年来,随着放射治疗在盆腔肿瘤患者治疗中的应用越来越广泛,骨盆不全骨折(pelvic insufficiency fracture,PIF)的发生率呈上升趋势[1]。PIF是应力性骨折的一个亚组,是正常或生理应力作用于弱化骨骼而引起的[2]。PIF易与骨转移或骨转移引起的病理性骨折易混淆,虽然骨扫描和PET/CT检查有助于二者的鉴别诊断[3-5],但存在辐射污染及检查费用昂贵等缺点,目前临床缺乏简单易行、无创无辐射的有效鉴别诊断手段。“Honda sign”被认为是双侧骶骨不全性骨折特征性的表现,然而荟萃分析显示,只有42.7%的患者出现此征象[6]。CT可以显示骨折线及骨质硬化,但对骨髓水肿显示不敏感,常规MRI对早期的骨髓水肿十分敏感,但对骨折线的显示不及CT[7]。如果影像科医生诊断经验不足,常规MRI显示的PIF骨盆异常信号易被误诊为骨转移,因此仅使用常规MRI难以准确识别骨转移与PIF[5]。扩散加权成像(diffusion-weighted imaging,DWI)是MRI功能成像技术之一,能够根据水分子的扩散特性观察生物组织的结构,其定量参数表观扩散系数(apparent diffusion coefficient,ADC)可定量反映水分子扩散运动的快慢[8]。已经证实DWI在骨髓疾病的良恶性鉴别中起着重要作用[9]。本文旨在探讨DWI对盆腔肿瘤放疗后PIF与骨转移的鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月至2020年10月期间在华中科技大学同济医学院附属同济医院放射科同时行盆腔常规MRI平扫及DWI扫描的869例盆腔肿瘤患者,总结分析其临床及影像资料,根据以下纳入和排除标准,最终纳入50例经随访或活检证实为PIF或骨转移的病例进行本研究。其中,PIF的纳入依据为:放疗过程中新出现骨盆病灶、但随访12个月无软组织肿块,或者CT随访有骨质硬化区或可见骨折线,MRI可见骨髓水肿减退,病灶静止或可见骨折线等[5];骨转移的诊断依据为:放疗过程中新出现骨盆病灶、活检证实为骨转移,或者影像学资料随访12个月观察到病变范围逐渐扩大并伴有软组织肿块。排除标准:(1)患者有骨盆外伤史或放疗前骨盆有病变;(2)患者有其他部位肿瘤病史;(3)随访12个月仍不能确定是骨转移或不全性骨折;(4)盆腔MRI图像质量不能满足诊断要求或图像序列不完整。本研究已经过华中科技大学同济医学院附属同济医院医学伦理委员会同意(TJ-IRB20220132)。
1.2 MRI常规及DWI扫描方案 所有受试者在3.0 T MRI扫描仪上行MRI检查(Discovery 750;GE公司),使用18通道腹部相控阵线圈。患者取仰卧位,脚先进。扫描范围为髂棘至坐骨结节。盆腔常规MRI检查包括:(1)轴位快速自旋回波T1加权成像(重复时间/回波时间=568/6.8 ms;视野=340 mm× 340 mm;矩阵=320×192;层厚4 mm;层间隔1 mm;带宽=50 kHz);(2)轴位脂肪饱和T2加权像(重复时间/回波时间=3 920/68 ms;视野=340 mm×340 mm;矩阵=320×256;层厚4 mm;层间隔1 mm;带宽=62.5 kHz)。DWI扫描采用自由呼吸脂肪抑制单次激发平面回波序列(重复时间/回波时间=4 000/57 ms;视野=340 mm×340 mm;矩阵=128×160;层厚4 mm;层间隔1 mm;带宽=250 kHz;b值=800 s/mm2)。
1.3 图像分析 由2名分别有5年、15年MRI诊断工作经验的医师联合阅片,采用5分法对整体图像质量进行评价(1分=差,2分=不足,3分=中等,4分=良好,5分=优)。在满足诊断要求的情况下(图像质量≥3分)。分别记录每个患者病灶的位置、数量,并评估是否有骨折线、骨髓水肿、软组织肿块及是否有弥散受限。骨折线在T1WI、T2WI图像上表现为线样低信号;PIF相关的反应性骨髓水肿表现为均匀弥漫的T1WI低信号,T2WI高信号,而没有软组织肿块;如果病灶在DWI图像上显示的信号强度高于同层面的肌肉信号,而在ADC图像上显示的信号强度低于周围的肌肉信号,则认为弥散受限。
DWI原始图像经过GE工作站(AW462)后处理得到ADC参数图。同时在工作站上将轴位T2WI与ADC参数图配准,在轴位T2WI序列上选取病灶最大层面作为感兴趣区(region of interest,ROI),由2名医师分别独立测量每个病灶的ADC值,取两者测量的平均值进行统计分析。平均ROI面积大小取80 mm2,ROI的选取避免坏死、钙化、出血区域及骨折线。
1.4 统计学方法 采用SPSS 23.0统计软件,计量资料以平均值±标准差表示,采用两独立样本t检验进行分析。分类资料采用2检验或Fisher确切率检验进行分析。通过受试者工作特征(receiver operating characteristic, ROC)曲线定量分析ADC诊断PIF和骨转移的曲线下面积(area under curve,AUC)、敏感度、特异度。计算组内相关系数(interclass correlation coefficient,ICC)以评估观察者间ADC测量的可靠性(≤0.40差,0.41~0.75一般到良好,0.76~1很好)。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 50例患者中,32例为PIF,18例为骨转移。32例PIF患者,男2例,女30例,其中绝经前4例,绝经后26例;年龄(55.50±9.29)岁,14例无明显临床症状,18例有腰部及下背部、下肢疼痛症状。18例为骨转移,男4例,女14例,其中绝经前3例,绝经后11例;年龄(55.00±11.76)岁,8例无明显临床症状,10例有腰部及下背部、下肢疼痛症状。PIF组中,宫颈癌患者22例,直肠癌8例,子宫内膜癌2例,其中10例仅行单纯根治性放疗,22例行根治性手术后放疗。骨转移组中,宫颈癌患者11例,直肠癌6例,子宫内膜癌1例,其中6例仅行单纯根治性放疗,12例行根治性手术后放疗。两组之间的性别、年龄、绝经状态、临床症状、肿瘤类别和治疗方式均差异无统计学意义(P>0.05),见表1。
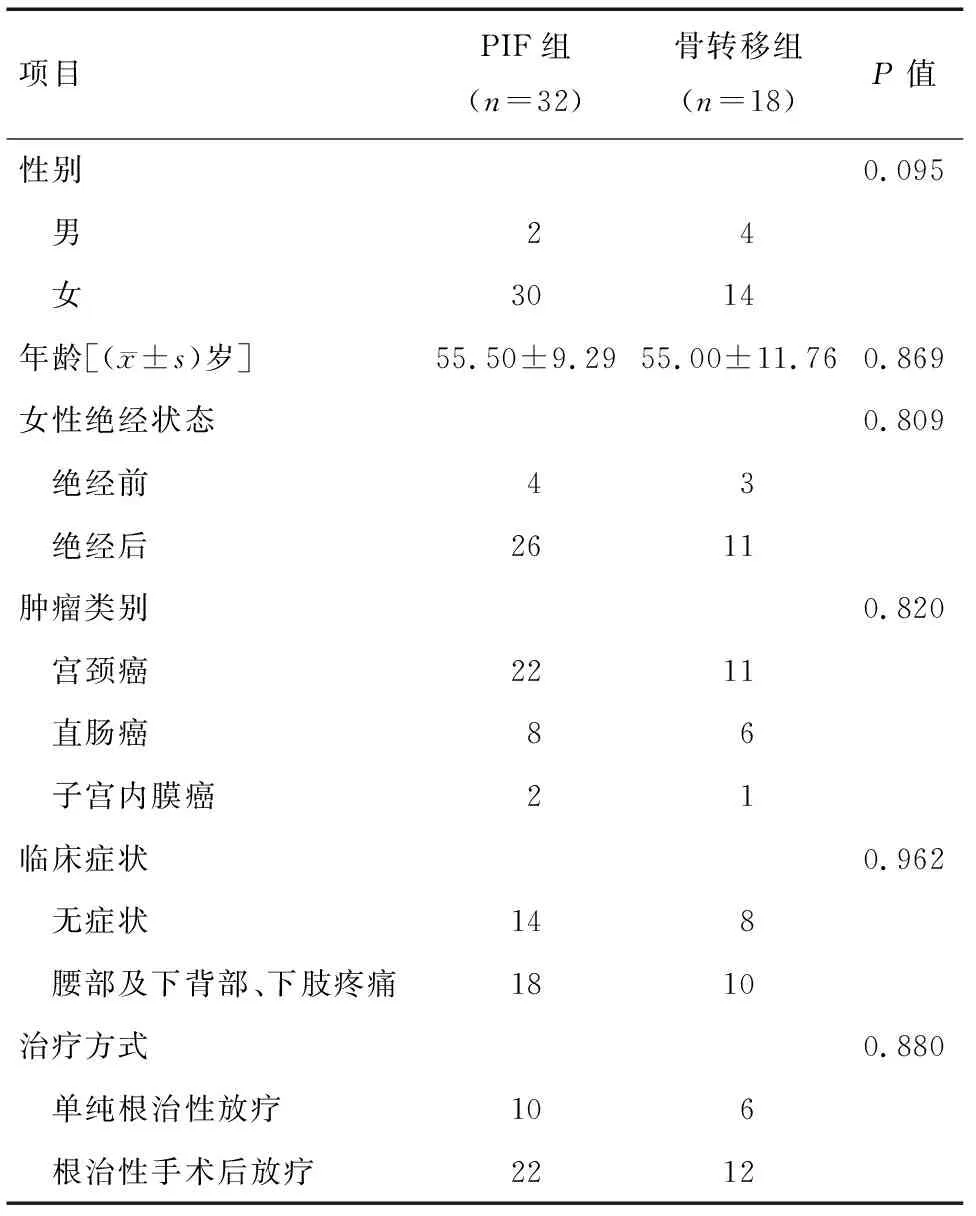
表1 PIF和骨转移患者临床特征比较 例
2.2 影像学特征 50例PIF和骨转移患者,从病灶数量上来看,PIF单发11例,多发21例共64个病灶;骨转移单发11例,多发7例共19个病灶。两组间的病灶数量差异无统计学意义(P=0.068)。从病灶位置来看,PIF和骨转移均好发于骶骨,PIF占69.3%(52/75),骨转移占56.7%(17/30),但PIF更多见于骶骨翼,32例患者均可见,其中双侧20例。骨转移则多见于骶骨体,两组之间的病灶位置差异有统计学意义(P=0.000)。
骨转移在常规MRI表现为结节状、斑片状等或稍长T1稍长T2信号改变,DWI呈稍高信号、ADC呈等或稍低信号(图1),6例伴周围软组织肿块形成。PIF在常规MRI表现为弥漫反应性骨髓水肿,T1WI呈低信号而T2WI则呈高信号,PIF组32例均可见,DWI呈等或稍高信号、ADC呈稍高信号,极少病例可见掩盖在骨髓水肿中的骨折线(图2~3)。两组之间的T1WI信号强度(P=0.218)、T2WI信号强度改变(P=0.217)差异无统计学意义。见表2。

表2 PIF和骨转移患者的影像学特征比较 例
PIF组的平均ADC值为(1.261±0.291)×10-3mm2/s,骨转移组的平均ADC值为(0.722±0.164)×10-3mm2/s,两组差异有统计学意义(P=0.000)。两个观察者之间ADC值的测量具有良好的一致性(ICC=0.858,P=0.000)。ROC分析显示,ADC值区分PIF和骨转移的曲线下面积(area under curve,AUC)为0.946(P=0.000),ADC区分PIF和骨转移的最佳阈值为0.901×10-3mm2/s,敏感度90.5%,特异度85.7%。见图4。
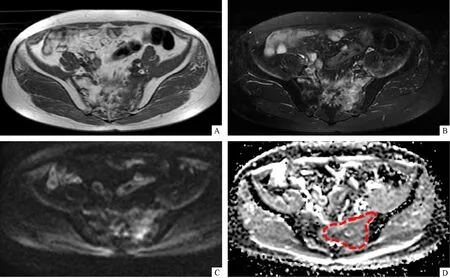
注:A:轴位T1WI; B:T2WI; C:DWI; D:ADC,病灶在ADC图上用红色虚线勾画
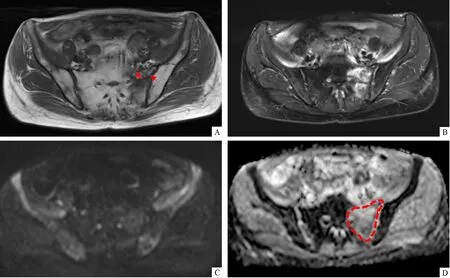
注:A:轴位T1WI,红色箭头示病灶位置;B:T2WI;C:DWI;D:ADC,病灶在ADC图上用红色虚线勾画
3 讨论
盆腔放疗是治疗盆腔肿瘤的标准治疗方法之一,近年来随着放疗技术在盆腔肿瘤治疗中的广泛应用,PIF的发生率也随之增加。PIF是盆腔肿瘤放疗后的远期并发症,临床极易误诊为骨转移或骨转移引起的病理性骨折,从而导致不必要的活检或过度治疗。本文通过比较盆腔肿瘤放疗后PIF和骨转移的影像学特征,发现PIF多发生于骶骨翼,不同于骨转移常见于骶骨体;同时,PIF典型的DWI表现为等或稍高信号,其定量参数图ADC对于盆腔肿瘤患者放疗后PIF和骨转移的鉴别诊断具有重要价值。
PIF好发于骶骨翼且多为双侧,发生在骶骨的骨折线多垂直或略微倾斜于腰椎外缘[10],并可累及骨盆其他组成骨如髂骨、髋臼和股骨头。骶骨、骶髂关节及髂骨内侧部是人体重要的负重结构,而骶骨是脊柱负重转移力量的直接部位。放疗时,骨盆及下腰椎位于照射野内,故骶骨翼是放疗后PIF好发的部位[6]。研究表明,放疗患者PIF发生率明显高于未接受者[11]。目前放疗辐射对骨骼重构的影响机制尚不完全清楚,但辐射可直接导致骨基质生成障碍和成骨细胞数量减少,从而导致骨质密度减低、容易发生骨折;同时,辐射后期可损伤成熟骨的微血管导致微循环障碍,使得骨折风险进一步增加[12]。
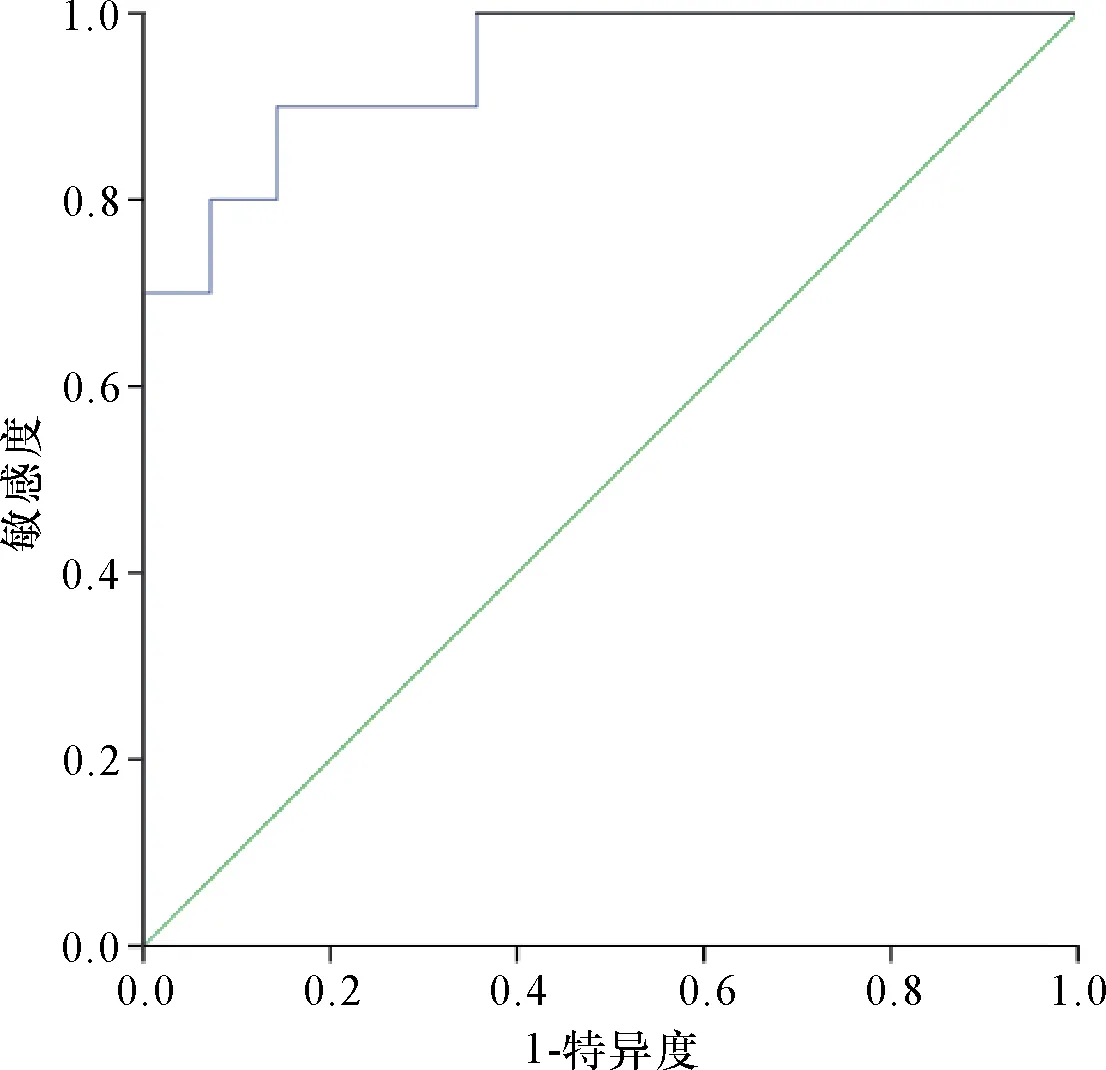
图4 ADC值鉴别骨盆不全性骨折与骨转移的ROC曲线
对于PIF的诊断,MRI已被证明是最敏感的影像检查手段[13]。反应性骨髓水肿是PIF最主要也是最早的表现,本研究中反应性骨髓水肿在所有PIF病例中均有记录,与以往报道一致,即PIF的反应性骨髓水肿发生率接近100%[13]。骨折线是PIF的一个特征性表现,但MRI对于骨折线的显示不敏感,骨折线的可见性在很大程度上取决于观察者的主观判断,据报道,MRI的骨折线检出率仅在79.7%~87.0%之间[10],究其原因除了观察者间的差异,还可能是常规MRI序列采集较少使用FS-T2WI冠位成像,而冠位显像对骨盆骨折线尤其是骶骨骨折有优势。虽然MRI有助于发现软组织肿块,但骨转移中的成骨性转移因没有软组织肿块形成,且与PIF的表现相似,常规MRI难以鉴别[14]。可见,常规MRI对于骨折和没有软组织肿块形成的骨转移诊断价值有限。
近年来,DWI已被广泛应用于骨髓疾病的定性诊断,在常规MRI中加入DWI可以提高诊断性能[15]。Zhong等[16]在常规MRI中加入DWI可显著提高宫颈癌放疗后PIF和骨转移的敏感性(92.5%)。ADC值受细胞密度和细胞外空间体积影响,可定量反映水分子扩散运动的快慢。骨转移病灶因肿瘤细胞浸润,细胞增殖旺盛导致细胞密度增高,再加上生物膜的限制,使细胞内外的空间狭窄,水分子在其中的扩散能力下降,因而在DWI上表现为弥散受限,ADC值降低;而在反应性骨髓水肿中,水分子扩散能力并未下降,因此ADC值较高[8]。定量ADC在良、恶性椎体压缩性骨折中的鉴别价值已得到证实,恶性骨折的ADC值明显低于良性病变[17-20]。最近一项荟萃分析表明,定量ADC评估鉴别良性与恶性压缩性骨折的敏感度为92%,特异度为91%[18]。同样,我们也评估了定量ADC在PIF和骨转移中的鉴别诊断价值,发现PIF组平均ADC值明显高于骨转移组,与Sung等[17]的研究一致。因此,我们认为在常规MRI中加入DWI以区分骨转移和PIF是必要的。
当骨折累及两侧骶骨翼和骶骨体的水平部分,PIF骨扫描显像呈典型的“Honda sign”即“H”征。然而当没有典型“H”征时或恶性肿瘤患者表现出“H”征或类似“H”征时,骨扫描的特异性明显降低,病理摄取值的增加易被误认为是骨转移[21]。18F-FDG-PET-CT对PIF显像特征类似MRI上水肿信号特征,表现为平行于骶髂关节的弥漫性线性吸收模式,SUVmax值低于骨转移组,其敏感度83.2%,特异度98.5%[3,22-23];但PET显像取决于骨折的分期,摄取强度也受到诸多因素影响如PET检查与骨折发生的间隔、患者的年龄、骨折稳定性、骨折部位等。最重要的是,骨扫描与PET-CT检查均存在辐射污染及检查费用昂贵等缺点,而DWI及定量ADC参数图简便易行、无创无辐射且可重复,更适用于盆腔放疗患者的长期随访监测。
本研究存在以下不足之处:第一、本研究是回顾性研究,样本的选择可能存在选择偏差;第二、PIF和骨转移的年龄差异可能影响ADC值,老年患者(PIF组)较低的骨密度和较高的脂肪含量可能导致ADC值减低。总之,我们的初步研究表明,DWI及其定量参数图ADC对于盆腔肿瘤患者放疗后PIF和骨转移的鉴别具有重要价值。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:黄昭君、刘栋实施研究并撰写论文,吴巍、裴宇、覃媛媛、冯朝燕设计并指导本研究。
