Toll样受体7抑制剂的高通量筛选模型建立及应用
2022-07-08郑祖国刘志红
赵 越 郑祖国 周 萍 李 萍 刘志红
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)最常见且最严重的并发症之一,也是造成SLE患者死亡的主要危险因素[1]。现有治疗方案对于难治性LN的完全缓解率仍然偏低,国家肾脏疾病临床医学研究中心在国际上首次提出“多靶点”的治疗理念并牵头组织完成了两项全国多中心随机对照临床研究(RCT),证实“多靶点”疗法(MT)疗效显著优于传统疗法[2-3],进一步探究疗效机制发现,MT可特异性抑制TLR7信号[4]。Toll样受体7(TLR7)是一类模式识别受体(PRRs),能够识别病毒来源或内源性的单链RNA(ssRNA),活化下游信号并诱发免疫炎症反应。既往研究证实TLR7通路异常活化在LN中发挥关键作用[5-6],TLR7表达上调可增加SLE发病风险[7-8],近期《Nature杂志》发表的工作证实TLR7单基因突变即可导致SLE发生[9]。以上结果强烈提示TLR7是LN药物研发的重要靶点,因此本研究构建高通量筛选(HTS)模型开展TLR7抑制剂筛选。既往文献已证实瑞喹莫德(R848)可作为配体活化TLR7[10]而羟氯喹(HCQ)能够抑制TLR7信号[11]。本研究利用R848激活TLR7,选择HCQ作为阳性药从140余种中药活性成分中筛选TLR7抑制剂并进行验证,研究结果将为LN药物研发提供重要依据与参考。
材料和方法
材料标准品来自中国药科大学天然药物活性组分与药效国家重点实验室天然产物库。标准品溶解于二甲基亚砜(DMSO)中,制备成储备液;雌性MRL/lpr小鼠和C57BL/6小鼠均购自江苏艾凌菲生物科技有限公司。
主要试剂葫芦素B(CuB,Sigma);RNA提取试剂盒(Takara);逆转录试剂盒(Takara);qPCR试剂盒(ABI);BCA蛋白定量试剂盒(碧云天);p-p65抗体(CST);p65抗体(Santa Cruze);髓样分化因子88(MyD88)抗体(CST)。
方法
CCK8法检测细胞活性 细胞种板后进行加药处理24 h后加入CCK8检测试剂,37℃孵箱孵育 1 h,酶标仪进行OD值测定(450 nm)。
流式细胞分析 用PBS重悬细胞沉淀,加入BSA封闭后PBS洗2次,参照说明书加入相应体积的流式抗体,冰上避光孵育30 min,离心后弃上清,PBS重悬后流式细胞仪上机分析。
实时荧光定量PCR(RT-qPCR) 参照Takara试剂盒说明抽提总RNA,用逆转录试剂盒(Takara)合成cDNA,利用SYBER Green法进行RT-qPCR检测肾组织中肿瘤坏死因子α(TNF-α)、抗黏液病毒1蛋白(MX1)、抗黏液病毒2蛋白(MX2)、包含三角形四肽重复序列1的干扰素诱导蛋白(IFIT1)的mRNA表达水平。引物序列如表1。

表1 引物序列
统计学方法应用《Graphpad Prism 8》 软件进行图表制作及数据分析,数据以均数±标准差表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用Dunnett法,P<0.05为差异有统计学意义。
结 果
HTS模型建立及优化给予HEK-BlueTMhTLR7细胞不同浓度TLR7配体R848刺激(0 ng/mL,0.1 ng/mL,1 ng/mL,10 ng/mL,102ng/mL,103ng/mL,104ng/mL)24 h,收集细胞上清加入QUANTI-Blue工作液,37 ℃孵育不同时间(15 min,30 min,1 h,1.5 h,2 h,3 h,4 h,5 h,6 h)后观察显色情况并在酶标仪630 nm波长处读取OD值,结果发现R848在刺激浓度为103ng/ml及104ng/ml时可分别将核因子κB(NF-κB)活性上调至4倍和5倍(图1)。
R848在剂量为103ng/mL及104ng/mL时尽管能够活化TLR7信号,但尚未出现拐点,故进一步设置以下浓度梯度:0,0.1 μg/mL,0.2 μg/mL,0.4 μg/mL,0.8 μg/mL,1.6 μg/mL,3.2 μg/mL,6.4 μg/mL,12.8 μg/mL,25.6 μg/mL,51.2 μg/mL,102.4 μg/mL处理细胞24 h后收集上清加入QUANTI-Blue工作液,37℃孵育30 min后在酶标仪630 nm波长处读取OD值,评估NF-κB活性,结果显示当R848剂量为12.8 μg/mL时可出现拐点,此时NF-κB活性较未加药组上调约5倍,差异有统计学意义,此后随剂量增加NF-κB活性逐渐下降(图2A)。CCK8结果显示当R848剂量为12.8 μg/mL时对细胞活性影响较小(图2B)。因此,本研究后续筛选中选择10 μg/ml 的R848用于诱导TLR7信号活化。为进一步明确阳性药HCQ的最佳工作浓度,我们联合R848和不同浓度梯度的HCQ(0、1μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L、128 μmol/L)处理后检测NF-κB活性,结果显示随HCQ浓度增加,R848诱导的NF-κB活性上调受到抑制且呈剂量依赖性,当HCQ剂量为32 μmol/L时对NF-κB活性的抑制效率可达50%以上(图2C),且对细胞活力无明显影响(图2D)。因此本研究中我们选择32 μmol/L作为HCQ的给药剂量。至此,HTS体系已成功建立。
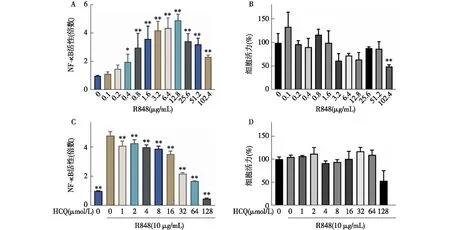
图2 R848和HCQ最佳工作浓度确定
TLR7抑制剂初级筛选通过对传统中药文献调研遴选,我们从中国药科大学天然产物库中选取142种具有潜在活性的中药活性成分,基于以上建立的HTS体系开展TLR7抑制剂的初级筛选。给予HEK-BlueTMhTLR7细胞系R848、R848+HCQ或R848联合不同化合物刺激24 h后评估NF-κB活性,利用CCK8实验评价不同化合物对细胞活力的影响。最后计算每个化合物处理后NF-κB活性与细胞活力的比值(图3)。

图3 评估142个天然产物对TLR7信号抑制效果及细胞活性的影响
TLR7抑制剂次级筛选根据初筛结果,以HCQ为参照选择19个化合物进入次级筛选(表2)。

表2 次级筛选化合物列表
分别给予HEK-BlueTMhTLR7细胞R848、R848+HCQ(32 μmol/L)处理或R848联合不同剂量化合物处理,每种处理设置3个副孔,评估以上19个化合物对TLR7信号的抑制作用。结果显示除甘草苷在各刺激浓度对NF-κB活性均无影响之外,其他18个化合物都表现出对NF-κB活性的抑制效果,差异有统计学意义(图4),提示我们构建的HTS体系具有较强的稳定性及可靠性。我们以阳性药HCQ作为参照,发现以下7个化合物:粉防己碱(图4B)、CuB(图4D)、黄腐醇(图4E)、卡瓦胡胡椒素B(图4F)、沙蟾毒精(图4H)、椰穿鱼黄素(图4N)、异贝壳杉烯酸(图4Q)在一些剂量浓度下对TLR7信号的抑制效果优于阳性药HCQ。
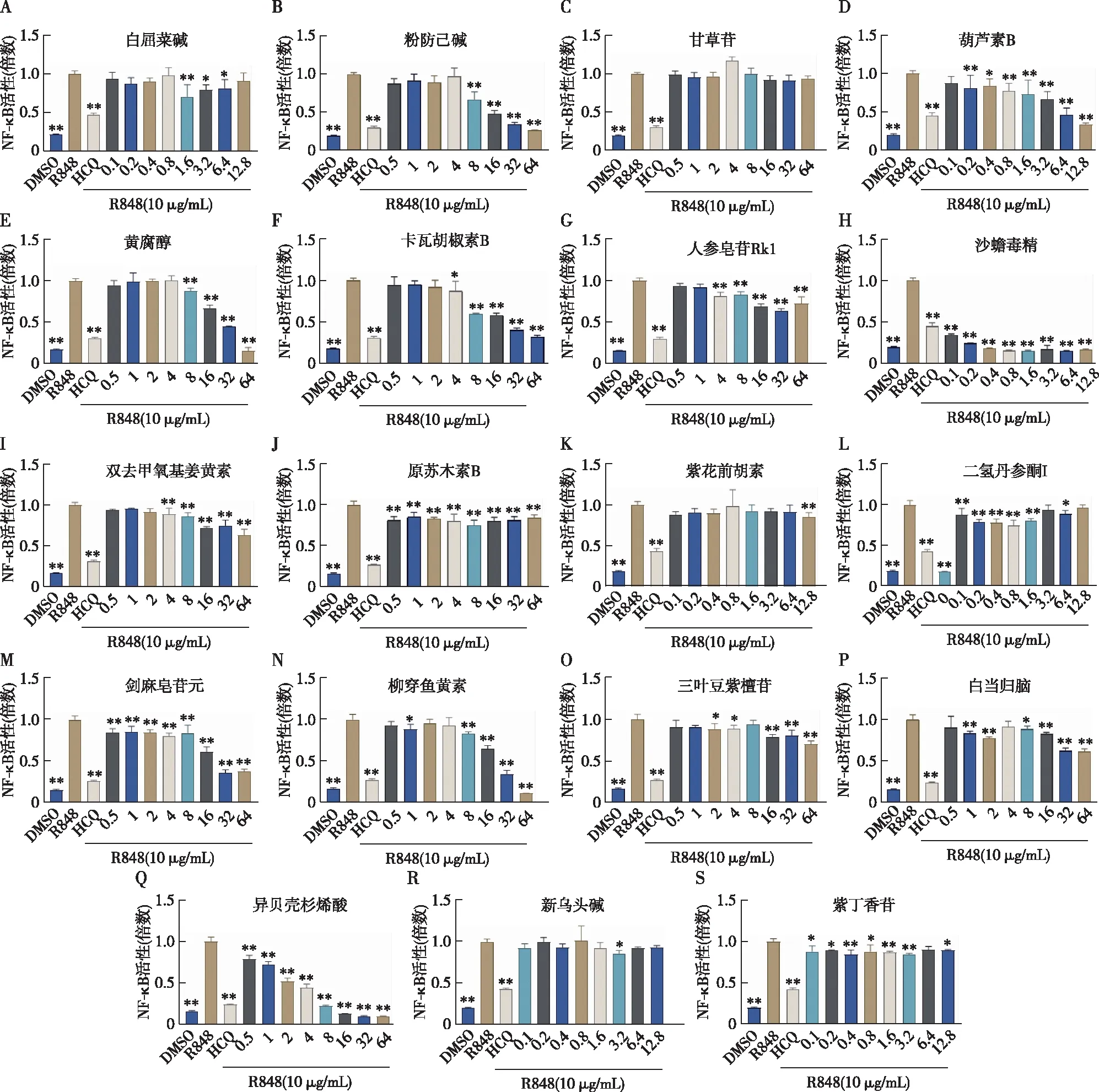
图4 评估各化合物对Toll样受体7信号的抑制作用
CCK8实验结果显示粉防已碱和黄腐醇在剂量为64 μmol/L时抑制效果优于阳性药HCQ,但对细胞活性影响较大(图5A、C);CuB在处理剂量为12.8 μmol/L时对TLR7信号的抑制效果优于HCQ且对细胞活性影响小于HCQ(图5B);卡瓦胡椒素B在64 μmol/L剂量时对TLR7的抑制效果与HCQ类似,但该剂量可导致细胞活性<50%(图5D);沙蟾毒素和异贝壳杉烯酸对TLR7的抑制效果优于HCQ,但CCK8结果提示该抑制作用是基于细胞毒性(图5E、G);椰穿鱼黄素在64 μmol/L剂量下能够将NF-κB活性抑制90%左右,但细胞活力低于50%(图5F)。基于以上结果,我们选择CuB进行下一步验证。
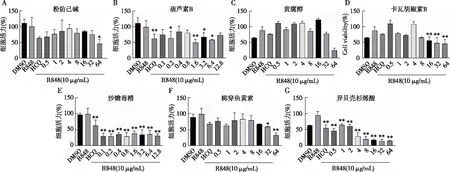
图5 CCK8实验检测各化合物对细胞活力的影响
CuB抑制TLR7信号异常活化为评估CuB对LN异常活化的TLR7信号抑制作用,我们原代分离MRL/lpr小鼠脾脏单个核细胞后进行体外培养,给予HCQ(32 μmol/L)或不同剂量CuB(0.5 μmol/L、1 μmol/L、2 μmol/L)刺激48 h后观察 TLR7下游信号分子MyD88表达和NF-κB(p65)的磷酸化水平。Western blot结果显示CuB在剂量为2 μmol/L时能够显著抑制LN小鼠脾脏中p-p65和MyD88表达,与HCQ效果类似(图6A)。ELISA结果显示给予HCQ或CuB(1 μmol/L或2 μmol/L)处理能够显著抑制LN小鼠脾脏细胞培养液上清中白细胞介素6(IL-6)和干扰素γ(IFN-γ)的分泌水平(图6B、C)。LN患者Ⅰ型干扰素签名基因(ISGs)表达可出现明显上调,通过qPCR检测TNF-α、IFIT1、MX1和MX2的mRNA水平,结果显示CuB在剂量为1 μmol/L或2 μmol/L时能够显著抑制LN小鼠脾脏ISGs基因表达,且呈一定剂量依赖性,效果优于HCQ(图6D~G)。以上结果提示CuB能够抑制TLR7异常活化及其介导的免疫炎症反应。
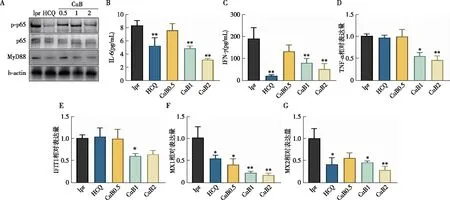
图6 CuB抑制LN小鼠脾脏TLR7信号异常活化
讨 论
LN是我国最常见的继发性肾小球肾炎之一,约20%的LN患者会在十五年内进展至终末期肾病[12]。目前LN的临床治疗一线方案为糖皮质激素及免疫抑制剂,尽管能够延缓LN疾病进展提高患者生存率,但其完全缓解率仍旧偏低[13-14]。近年来出现的生物制剂,缺乏长期安全性和有效性的有力证据并且受到价格和疗效的限制,目前尚未成为LN治疗的一线药物。因此,寻找新型治疗方案及药物成为目前亟需解决的问题。
本中心在国际上首次提出“多靶点”治疗理念并牵头组织完成了两项全国多中心RCT证实MT疗效显著优于传统疗法[2-3],机制研究发现MT能够特异性抑制肾组织TLR7信号[4],提示阻断TLR7信号有望成为LN治疗的有效策略。此前已有一些TLR7抑制剂研究,如寡核苷酸和抗疟药等[15-17],但目前尚无TLR7抑制剂用于临床,因此开发新型TLR7抑制剂具有重要应用价值。
HTS技术能够在短时间内基于已知靶标从大量候选化合物中筛选出潜在药物从而有效加速药物研发进程。本研究中我们采用稳定表达hTLR7基因的HEK-BlueTMhTLR7细胞系,对140余种中药活性成分展开TLR7抑制剂筛选。为保证筛选结果的可靠性和准确性,我们首先对体系进行优化:(1)明确显色系统的最佳孵育时间为30 min;(2)确定TLR7激动剂R848的最佳工作浓度为10 μg/ml;(3)选择HCQ作为阳性药并通过实验确定其最佳工作浓度为32 μmol/L。
天然产物来源丰富,种类繁多,结构多样,长期以来一直是新药开发的重要来源。我们基于前期构建的HTS筛选体系从142种天然产物中通过初筛和次筛获取对TLR7抑制效果较好且对细胞活性影响较小的CuB。CuB是从葫芦科植物中分离获取的一种四环三萜,具有多种生物学活性,是一种应用前景广泛的抗癌化合物[18-19],近年来CuB的抗炎活性逐渐获得关注,Xue等[20]证实CuB通过抑制炎症小体改善痛风性关节炎小鼠疾病症状。CuB能够调控NF-κB/STAT3信号抑制咪喹莫特诱导的角质细胞炎症反应[21]。以上研究提示CuB具有抗炎特性,但其在LN中的作用及机制未见报道。本研究中,我们原代分离LN小鼠脾脏单个核细胞后给予HCQ或CuB刺激,评估了CuB在疾病状态下对TLR7信号的抑制作用,结果发现CuB能够显著抑制TLR7介导的下游NF-κB/MyD88信号活化、IL-6、IFN-γ炎症因子分泌以及ISGs mRNA表达水平,以上结果提示CuB能够抑制TLR7介导的免疫炎症反应。
小结:本研究基于临床疗效确切的MT疗法和前期疗效机制研究,建立并优化了筛选体系,通过对天然产物化合物库进行HTS发现具有TLR7抑制效果的化合物CuB并通过体外实验证实CuB能够抑制TLR7信号通路,为LN新药研发提供了理论依据。
