基于网络药理学与分子对接探讨“仙茅-淫羊藿”药对治疗勃起功能障碍的分子机制*
2022-07-08张静益杨薆黎俞旭君
张 凤 张静益 杨薆黎 阳 方 俞旭君,
1.成都中医药大学附属医院,代谢性疾病中医药调控四川省重点实验室
2.成都中医药大学医学与生命科学学院/附属生殖妇幼医院
勃起功能障碍(erectile dysfunction,ED)作为男科性功能障碍疾病中的常见病之一,不仅对患者的身心健康造成极大困扰,还严重影响患者夫妻关系和谐及社会稳定。ED在传统医学中归属于“阳痿”范畴,病机上认为与肾虚、肝郁、血瘀、痰湿等密切相关,故其治法也常因人而异。二仙汤组成包括仙茅、淫羊藿、当归、巴戟天、黄柏、知母,具有温肾阳、补肾精、泻肾火等功效,可用于男科因精气虚寒、命火衰微所致阳痿等病。前期报道二仙汤可帮助改善ED患者的阴茎勃起效应,提高性交满足感,并能增益大鼠血清NO浓度提高[1,2]。方中仙茅、淫羊藿温肾阳、补肾精、辛温助命门共为主药,为补肾壮阳常用药对。因此本研究旨在通过网络药理学与分子对接技术探究仙茅-淫羊藿药对治疗ED的物质基础与分子机制,从而进一步证实在中医辨证、辨病论治中中药配伍运用的科学性、有效性,以期能够对ED后续的临床研究与治疗提供一定的理论基础和新的研究方向。
资料与方法
一、仙茅-淫羊藿药对化学成分筛选
通过中药系统药理学数据库和分析平台(TCMSP)检索仙茅、淫羊藿化学组成成分,以口服生物利用度(Oral bioavailability,OB)≥30%,且类药性(Drug-likeliss,DL)≥0.18为筛选条件筛选出药对化学成分。
二、化学成分作用靶点预测与有效活性成分获取
利用TCMSP和pubchem数据库获取各个化学成分的Canonical SMILES结构式,导入Swiss Target Prediction数据库预测化学成分作用靶点,选择物种为“Homo sapiens”,根据经验选取probability值≥0.04的靶点为化学成分作用靶点。
三、勃起功能障碍疾病靶点获取
以“勃起功能障碍(Erectile dysfunction)”为关键词,分别在Genecards、OMIM、DrugBank数据库中挖掘调治ED的潜在靶点。在Genecards数据库中,若靶点过多可选择Score值>中位数的靶点为ED的治疗靶点,靶点Score值越高代表其与ED的联系越紧密。将上述3个疾病数据库所获靶点合并去重后得到ED治疗靶点。
四、药对-活性成分-疾病-靶点网络图构建
将仙茅-淫羊藿药对作用靶点和ED治疗靶点导入微生信平台(http://www.bioinformatics.com.cn)构建成比例面积文氏图,并获得药对-疾病共同靶点,此共同靶点即为仙茅-淫羊藿药对治疗ED的潜在靶点。将共同靶点与药对化学成分进行映射后,得到药对有效活性成分,然后利用Cytoscape3.7.2构建药对-活性成分-疾病-靶点网络图。
五、PPI网络构建与拓扑分析及关键靶点筛选
将筛选出的药对-疾病共同靶点导入STRING数据库中构建PPI网络,选择物种为“Homosapiens”,其余均采用默认设置。将所获PPI网络数据导入Cytoscape3.7.2进行可视化显示,分析网络后以BetweennessCentrality、ClosenessCentrality值均大于等于中位数,且AverageShortestPathLength小于等于中位数为基础筛选条件,选取degree值大于2倍中位数的靶点作为仙茅-淫羊藿治疗勃起功能障碍的关键靶点,并对关键靶点单独进行可视化显示。
六、GO功能富集分析和KEGG通路富集分析
将仙茅-淫羊藿药对治疗ED的潜在靶点导入Metascape平台,选择物种为“H.sapiens”,分析方式为“Custom Analysis”,设置P<0.05,进行基因的GO与KEGG通路富集分析。其中GO功能富集分析包括生物学过程 (Biological Processes,BP)、细胞组分(Cellular Components,CC)、分 子功能(Molecular Functions,MF)三部分。以P值为主要筛选条件,包含靶点数为次要筛选条件分别选取前20项作为关键条目导入微生信平台构建柱状图和气泡图进行可视化显示。
七、分子对接
将关键靶点的“degree”值由高到低排序,选取排名前3的靶点与作用靶点个数前6的关键活性成分进行分子对接。①靶点蛋白结构准备:AKT1(PDB ID:4GV1),TP53(PDB ID:5BUA),VEGFA(PDB ID:5DN2)靶点蛋白结构均来自RCSB数据库(https://www.rcsb.org/)。蛋白结构在Maestro11.9平台进行处理,用Schrödinger Maestro的Protein Preparation Wizard去除蛋白结晶水,补加缺失的氢原子,并修复缺失键信息,修补缺失肽段,最后对蛋白进行能量最小化、以及几何结构的优化[3,4]。②小分子结构准备:从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载关键活性成分MOL000006,MOL000098,MOL001792,MOL003044,MOL004380,MOL004391的3D结构,并利用Chem3D进行格式转化以及能量最小化,之后将所有小分子的结构导入Schrödinger Maestro软件建立数据库,进行加氢、结构优化、能量最小化,保存为分子对接的配体分子数据库。③分子对接:采用Schrödinger Maestro软件中的Glide模块进行。所有分子均按LigPrep模块的默认设置制备。在Glide模块中进行筛选时,导入准备好的受体,以在受体网格生成中指定合适的位置。选取蛋白的原配体以及预测活性位点作为10A盒子的质心。最后通过SP方法进行分子对接及筛选。④对接结果筛选与分析:分析活性成分和靶点蛋白的作用模式,如产生的氢键作用、π-π相互作用、疏水相互作用等,得到活性成分与蛋白残基作用的情况。再参考活性成分的对接打分,推测拟筛的化合物是否具有与阳性化合物相似的活性作用。
结果与分析
一、仙茅-淫羊藿药对的有效活性成分与作用靶点
在TCMSP数据库中检索获得仙茅-淫羊藿药对化学成分共30个,其中仙茅7个、淫羊藿23个(见表1)。将仙茅、淫羊藿的各个化学成分导入SwissTargetPrediction平台预测靶点,得到仙茅作用靶点47个,淫羊藿作用靶点445个,两药靶点合并去重后共得到445个作用靶点。

表1 仙茅-淫羊藿化学成分
二、ED治疗靶点
以“Erectile dysfunction”为关键词在Genecards数据库中检索获得ED治疗靶点共1692个,Score值最大31.52,最小0.21,中位数为1.97,筛选后得到ED治疗靶点846个。OMIM和DrugBank数据库中分别检索获得84个和28个靶点,将上述3个数据库所获靶点合并去重后获得ED治疗靶点共947个。
三、药对-活性成分-疾病-靶点网络图构建
将仙茅-淫羊藿药对作用靶点与ED治疗靶点导入微生信平台,构建成比例面积文氏图,获得仙茅-淫羊藿药对与ED共同靶点121个(见图1)。将共同靶点与药对化学成分进行映射后,得到药对有效活性成分共计24个,其中仙茅4个,淫羊藿20个。将药对有效活性成分、药对疾病共同靶点、药物名称和疾病名称导入Cytoscape 3.7.2构建药对-活性成分-疾病-靶点网络图进行可视化显示(见图2)。
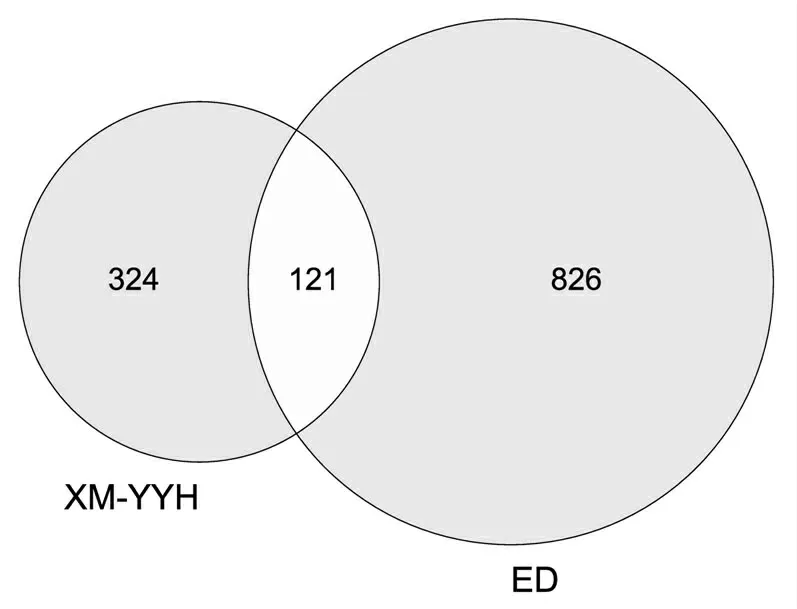
图1 仙茅-淫羊藿药对-勃起功能障碍靶点文氏图

图2 药对-活性成分-ED-靶点网络图
四、PPI网络构建与分析及关键靶点筛选
将仙茅-淫羊藿药对治疗ED的潜在靶点导入string数据库构建PPI网络及拓扑分析,PPI网络图中共计121个节点,1313条边,平均节点度为21.7。将上述PPI网络数据导入Cytoscape 3.7.2进行可视化显示(见图3),并根据靶点连接度、中间中心性、亲密中心性、平均最短路径长度的大小筛选出丝氨酸/苏氨酸蛋白激酶1(Protein kinase Bα,AKT1)、血管内皮生长因子A(Vascular endothelial growth factor-A,VEGFA)、肿瘤蛋白p53(Tumor protein p53,TP53)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)等21个仙茅-淫羊藿药对治疗ED的关键靶点。其中靶点连接度排名前三的AKT1、VEGFA、TP53,其连接度依次为73、72、69。靶点连接度越大,表示其越有可能为仙茅-淫羊藿药对调治ED的关键靶点。

图3 仙茅-淫羊藿药对治疗ED的潜在靶点及关键靶点的PPI网络图
五、GO功能富集分析和KEGG通路富集分析
将仙茅-淫羊藿药对治疗ED的靶点导入metascape数据平台进行GO与KEGG富集分析。分析结果显示其潜在治疗靶点主要参与以细胞对氮化合物的反应、血液循环、蛋白磷酸化的正向调节及跨膜受体蛋白酪氨酸激酶信号通路等为主的1947个生物学过程,和以受体复合物、膜筏、膜微域、神经元细胞体等为主的137个细胞组分,以及以蛋白激酶活性、磷酸转移酶活性、跨膜受体蛋白激酶活性、蛋白质丝氨酸/苏氨酸激酶活性为主的198项分子功能(见图4)。主要通路涉及以EGFR酪氨酸激酶抑制剂耐药性、PI3K-Akt、cAMP、5-羟色胺能突触、MAPK等为主的161条信号通路(见图5,表2)。
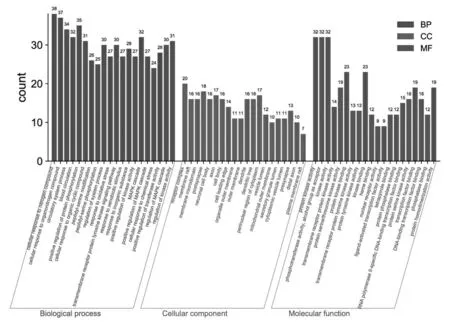
图4 仙茅-淫羊藿药对治疗ED潜在靶点的GO富集分析

图5 仙茅-淫羊藿药对治疗ED潜在靶点的KEGG通路富集分析

表2 仙茅-淫羊藿药对治疗ED的主要KEGG通路中的富集靶点
六、分子对接结果与分析
根据SP方法得到分子对接结果[5](见表3)。此外,靶点蛋白与小分子的复合物采用Pymol2.1进行可视化分析(见图6)。

图6 仙茅-淫羊藿关键活性成分DFV与AKT1、VEGFA、TP53分子对接模式

表3 活性成分的靶点蛋白对接结果
分子对接结果表明,仙茅-淫羊藿药对的6个关键活性成分与3个靶点蛋白均存在很好的结合作用且匹配度高(结合能均小于-6 kcal/mol)。其中,MOL001792(DFV)与AKT1,TP53,VEGFA靶点在对接打分以及结合模式方面表现最好。将对接后活性成分与蛋白形成的复合物利用Pymol2.1软件进行可视化(每个靶点选取打分最好的活性成分),得到活性成分与蛋白的结合模式,根据结合模式可以很清晰的看到活性成分与蛋白口袋相结合的氨基酸残基。DFV与AKT1蛋白的活性位点存在相互作用的氨基酸残基有VAL-164,ALA-177,MET-227,TYR-229,THR-211,ALA-230,MET-281,GLU-234,PHE-438,GLY-157等。DFV是黄酮类化合物,含有多个活性基团,能够与活性位点氨基酸(GLU-234,ALA-230)形成很强氢键相互作用,氢键距离短,结合力强,对锚定蛋白空腔中的稳定壳聚糖分子有着重要作用。另外,该化合物的苯环能够与VAL-164,VAL-177形成π-π共轭相互作用,对稳定蛋白口袋中的小分子有着重要贡献。DFV化合物与TP53,VEGFA两个靶点形成很强的氢键相互作用以及疏水相互作用,与蛋白口袋能够形成很好的匹配作用,与蛋白有着很好的关联性。同时也间接验证了化合物对AKT1,TP53,VEGFA靶点具有调节作用。
讨 论
ED属于中医“阳痿”范畴,中医概括其症状特点为“痿而不举,举而不坚,坚而不久”,认为其病机以肾虚为本,肝郁气滞、湿热、血瘀等为标,单独或多种因素共同作用酿生本病[6]。临证常选用仙茅、淫羊藿、巴戟天、肉苁蓉等补肾壮阳类中药治疗男子因命门火衰、肾气虚寒所致的阳痿。其中仙茅、淫羊藿(又名仙灵脾)俗称“二仙”,是临床常用药对,仙茅来源于石蒜科植物仙茅属,味辛,性热,有毒,以其叶似茅,根状茎久服补肾阳、益精血、强筋骨而得名。《本草备要》载仙茅有“助命火、益阳道”之功。淫羊藿来源于小檗科植物淫羊藿属全草,味辛、甘,性温,主入肝肾,具有补肾壮阳、益精气、强筋骨等多种功效。《日华子本草》言其有疗“丈夫绝阳不起,女子绝阴”之效。两药合用,共奏益精填髓、壮阳起痿之功。现代药理学亦表明仙茅、淫羊藿能直接作用于下丘脑-垂体-性腺轴及肾上腺皮质轴,增益细胞激素和生殖器官,且能发挥调节免疫、抗氧化、降糖、降脂、降压等多种药理作用[7,8]。
现代医学认为阴茎海绵体平滑肌(penis cavernosum smooth muscle,PCSM)舒张和收缩信号通路异常是诱发ED的核心机制,血管内皮功能障碍与海绵状血管生成受损[9]等均可致不同程度的ED。Baba[10]等人观察到去势术后大鼠阴茎中含有一氧化氮合酶(NOS)的神经纤维数显著低于接受假手术的大鼠组,且伴有勃起功能明显下降。而去势术后接受延迟睾酮替代治疗的大鼠阴茎中含有NOS的神经纤维数和勃起功能与假手术组大鼠无显著差异。这表明睾酮水平可能在男性勃起功能的启动和维持中起着重要作用,但目前睾酮对阴茎组织的影响仍存在争议。本研究结果表明,仙茅-淫羊藿药对治疗ED主要通过化合物DFV、金圣草(黄)素、木犀草素、槲皮素等来发挥作用。金圣草黄素、木犀草素和槲皮素为天然黄酮类化合物,三者均具有较好的抗炎、抗氧化作用。同时,现有研究亦证实槲皮素具有较好的扩血管和保护血管内皮功能等药理作用[11],其可能通过减少海绵体组织的内皮细胞凋亡、增强内皮型一氧化氮合酶(eNOS)表达及NOS的活性来改善动脉性ED大鼠的勃起功能[12]。Adefegha SA[13]等人发现槲皮素能显著降低帕罗西汀诱导的ED大鼠阴茎组织中AChE、PDE-5、精氨酸酶、ACE等与勃起相关酶的活性,并改善抗氧化状态。木犀草素亦能通过减少氧化应激、提高NO含量和NOS活性来降低高糖介导的内皮依赖性舒张反应损伤[14]。金圣草(黄)素对勃起功能的调节作用尚不明确,但已有研究报道其可能通过阻断激活蛋白1活化有效抑制脂多糖诱导的诱导型一氧化氮合酶(iNOS)的基因表达,使NO的释放减少[15]。DFV由于目前缺乏文献支持,其药理作用及机制仍需后续实验进一步证实。
根据本研究结果显示,仙茅-淫羊藿药对治疗ED的靶点主要为AKTI,VEGF,TP53等,且其治疗ED的潜在靶点主要富集在EGFR酪氨酸激酶抑制剂耐药性通路、PI3K-Akt通路、cAMP通路、MAPK通路等。现有研究表明,NO由NOS催化L-精氨酸产生。AKT1作为PI3K-Akt信号通路的主要参与者,可调节NOS的表达与活性,进而影响阴茎勃起的关键因子-NO的生成。NO主要通过一氧化氮/环磷酸鸟苷(NO/cGMP)通路引起PCSM舒张,改善阴茎海绵体内皮功能,从而增强勃起功能[16,17,18]。具有类似调控作用的还有cAMP通路。与之相反,蛋白激酶类则通过参与蛋白激酶C/蛋白激酶C磷酸抑制蛋白17(PKC/CPI-17)或细胞外调节蛋白激酶1/2(ERK1/2)通路调节PCSM的收缩功能,导致ED的发生[9]。ERK属于MAPK家族,MAPK信号通路在细胞的增殖、分化和凋亡中起关键作用,其家族成员还包括应激激活蛋白激酶(JNK)和p38丝裂原活化蛋白激酶(p38 MAPK)。通过抑制ERK、JNK、p38信号通路可降低精氨酸酶活性,增强内皮和氮能神经介导的糖尿病小鼠海绵体舒张功能,从而改善勃起功能[19]。此外,血管内皮生长因子(VEGF)也可通过促进血管增生、改善血流灌注、上调NOS表达改善阴茎勃起功能[20]。已有研究证实VEGF在海绵体平滑肌细胞中的表达水平可随着年龄的增长而逐渐下降[21],提示ED随着年龄增长发病率逐渐上升的特点或与此有关。郭玉刚[22]等人经动物实验表明高脂血症大鼠阴茎组织中的VEGF含量的明显降低可能是高脂血症继发ED的发病机制之一。杨文德[23]等人通过对双侧海绵体神经损伤的大鼠移植VEGF和GDNF共过表达的脂肪源性干细胞,发现其可促进阴茎海绵体神经的修复、保护血管内皮、预防纤维化,恢复神经源性ED大鼠的勃起功能。TP53是一种广谱肿瘤抑制基因,可抑制细胞的生长、增殖与分化,已有研究报道TP53表达降低可抑制海绵体内皮细胞凋亡,改善勃起功能[24]。但目前针对TP53在男性生殖系统中所起作用的相关研究较少,其在ED的发生发展过程中所起作用及机制仍有待进一步研究证实。
综上所述,预测仙茅-淫羊藿药对治疗ED具有多成分、多靶点、多通路的特点,二者在治疗靶点上既有相同点,又有不同点,可起到相互促进、相互补充、相辅相成的作用。通过本研究为今后进一步深入研究仙茅-淫羊藿药对治疗ED的作用机制奠定了一定的理论基础,同时也为研发治疗ED的新药提供了新的思路。本研究不足之处在于研究结果均基于生物信息学分析所得,所获理论结果仍需后续辅以动物实验或临床试验加以证实。
