结直肠癌腹膜转移瘤的18F-FDG PET/CT参数与其原发肿瘤位置及病理类型相关性分析
2022-07-08孙春锋毛小英谭忠华包善磊
孙春锋,张 丁,高 艳,毛小英,谭忠华,包善磊,沈 忱
1.南通大学附属医院核医学科,南通 226001
2.南通大学附属医院普通外科,南通 226001
结直肠癌(colorectal cancer, CRC)通过腹腔局部播散和种植转移可导致腹膜转移癌(peritoneal carcinomatosis, PC)。结直肠腹膜转移癌(colorectal peritoneal carcinomatosis,CRPC)是CRC患者死亡的第二大原因,鉴于其在临床诊治过程中的重要性,2018年的美国癌症联合委员会(AJCC)第8版癌症分期系统[1]中将M分期中进一步细化—新增Mlc期,即CRPC(且无论是否合并有其他器官部位转移),属于ⅣC期。18F-FDG PET/CT检查在恶性肿瘤中的临床应用越来越广泛[2-3]。既往CRPC的影像学评估以CT或MRI为主,但存在评估范围的局限性及较高的假阴性,而18F-FDG PET/CT检查在完成全身常规评估的同时能高效地评估CRPC情况[4-6]。结直肠黏液腺癌的原发灶和腹膜转移灶一般都表现为密度和葡萄糖代谢偏低,给影像学诊断和评估带来一定的困难。本研究将腹膜转移癌PET/CT参数与CRC原发灶之间的关系报告如下。
1 资料与方法
1.1 研究对象回顾性分析2016年5月至2019年12月在南通大学附属医院核医学科PET/CT中心检查的441例CRC患者资料,其中CRPC患者132例。CRPC纳入标准:(1)年龄18~85岁;(2)原发灶经病理确诊为结直肠腺癌、黏液腺癌和印戒细胞癌;(3)经临床及影像随访和(或)病理诊断腹膜转移癌。排除标准:(1)同时合并其他恶性肿瘤、腹部外伤、腹盆腔感染等病变;(2)检查前3个月内进行化疗、放疗、靶向治疗、免疫治疗等;(3)腹膜病变最终无法定性或随访失访。本研究以横结肠右侧2/3和左侧1/3为界和多发者的主病灶所在位置将原发灶CRC分为右半结肠癌(right colon cancer,RCC)组、左半结肠癌(left colon cancer,LCC)组和直肠癌(rectal cancer,RC)组,按照术后主要病理类型分为中高分化腺癌组、低分化腺癌组和黏液腺癌组。本研究经南通大学附属医院伦理委员会批准免知情同意(2018-K037)。
1.2 PET/CT显像放射性药物18F-FDG由南京江原安迪科正电子研究发展有限公司提供,要求放化纯度>95%。常规准备后采用DiscoveryTMPET/CT 710机(GE公司)先行MSCT扫描,范围从颅顶至股骨中段,然后应用3D模式进行PET图像采集,据身高设6~8个床位。采集结束后运用软件AW 4.6进行分析。延迟显像于注射18F-FDG 2 h后再次行PET/CT扫描,采集条件与早期扫描选择的条件一致。
1.3 图像分析目前国际上最常用的腹膜转移癌分级系统采用的是Harmon等[7]提出的腹膜癌指数(peritoneal carcinomatosis index,PCI)分级系统。该系统将腹腔划分为13个区域,分别测得每个区域内最大CRPC病灶的长径(lesion size,LS)后进行综合评分。LS-0指未见CRPC病灶,LS-1指CRPC病灶长径<0.5 cm,LS-2指CRPC病灶长径0.5~5.0 cm,LS-3指CRPC病灶长径>5.0 cm。每例患者综合PCI最小评分为0分,指没有CRPC;最大评分共计39分,指此患者每个区域均有长径>5.0 cm的CRPC。其中,若能分辨出融合性病灶的边界者则分别记为2个或多个病灶;无法分辨出边界者,则记为1个病灶。原发肿瘤和(或)局部复发处可被切除者不计算在内。与临近脏器融合在一起、无法分辨者,直接评分为LS-3[5-7]。
采用感兴趣区(ROI)技术,由计算机自动计算标准摄取值(standardized uptake value, SUV),取 最 大 值(SUVmax)。SUV(g/mL)= 局 部ROI平均放射性活度(MBq/mL)/[注入放射性活度(MBq)/体质量(g)]。进行延时检查患者根据计算公式,获得滞留指数(retention index,RI),RI=[(SUVmax延时-SUVmax早期)/SUVmax早期]×100%,RI≥5%为阳性,RI<5%为阴性。图像分析及数据测量由2位从事PET/CT 3年以上的诊断医师共同完成,定量数值的测量由2位医师分别测量后取均值,若2位医师所得结果差别较大且协商不一致时交由上一级医师决定。每位CRPC患者的SUVmax和RI均取最大枚CRPC病灶进行分析获得。
1.4 CRPC诊断CRPC诊断符合以下之一:(1)手术(含术后再次手术、腹腔镜)病理证实;(2)穿刺活检病理证实;(3)腹水细胞学检查找到肿瘤细胞;(4)影像学随访证实病灶经过治疗后缩小或消失;(5)影像学证实病灶在随访过程中有进展(形态增大、直径增加、SUVmax增加或新增等)。
1.5 统计学处理采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以x±s表示,不符合的以M(P25,P75)表示,计数资料以n(%)表示,采用χ2分割法,调整检验水准为0.017(0.05/3)。两样本均数比较,采用独立样本t检验或近似t检验。3组以上整体指标比较采用单因素方差分析,两两比较采用t检验。检验水准(α)为0.05。
2 结 果
2.1 一般资料分析441例CRC患者中符合纳排标准的CRPC患者有132例(29.9%)。CRPC患者平均年龄(61.81±11.52)岁。其中男性82例,平均年龄(62.57±11.51)岁;女性50例,平均年龄(61.59±11.42)岁;男性与女性年龄差异无统计学意义。CRC原发灶单发128例、多发4例;按照主病灶所在位置分为RCC 37例、LCC 44例、RC 51例;按照术后主要病理结果(44例经肠镜活检取得大体病理结果后没有手术者未纳入)分为中高分化腺癌组(n=57)、低分化腺癌组(n=16)和黏液腺癌组(n=15,1例印戒细胞癌归入)。CRPC诊断方法包括手术病理(15例)、穿刺活检(32例)、腹水脱落细胞(13例)、影像学随访(好转4例、进展68例)。
2.2 CRPC患者的PCI、SUVmax、RI情况132例CRPC患者的PCI为2~30,平均值为(7.40±8.14),病灶的SUVmax范围为1.2~31.0,平均SUVmax为9.65±6.01。72例CRPC患者进行了延时检查,RI为-10.0%~112.2%,RI四分位数为(13.5%,48.9%)。RI≥5%为阳性者65例,其中RI≥20%明显升高者为43例,5%≤RI<20%升高为22例;RI<5% 无明显变化(阴性者)为7例。
2.3 PCI、SUVmax、RI、CRC病理类型与原发灶位置的关系结果(表1)显示:原发灶病理类型、PCI和RI在3组间差别有统计学意义(P<0.05),SUVmax无统计学意义。3项差异有统计学意义的观察指标进行两两比较。病理类型方面,RCC组与RC组(χ2=9.49,P=0.009)之间差异具有统计学意义(P<0.017),RCC组以黏液腺癌和低分化腺癌为主、尤其黏液腺癌较RC组相对偏多,RC组以中高分化腺癌为主;RCC组与LCC组(χ2=6.33,P=0.04)、LCC组 与RC组(χ2=2.22,P=0.33)之间差异无统计学意义。PCI方面,RCC组与RC组之间差异具有统计学意义(P=0.02),RCC组的PCI高于RC组;RCC组与LCC组、LCC组与RC组之间差异无统计学意义。RI方面,共计72例CRPC患者进行性了延时扫描,RCC组与LCC组(t=4.88,P<0.001)、RCC组与RC组(t=3.94,P<0.001)间差异有有统计学意义,RCC组的RI低于LCC组和RC组;LCC组与RC间差异无统计学意义。
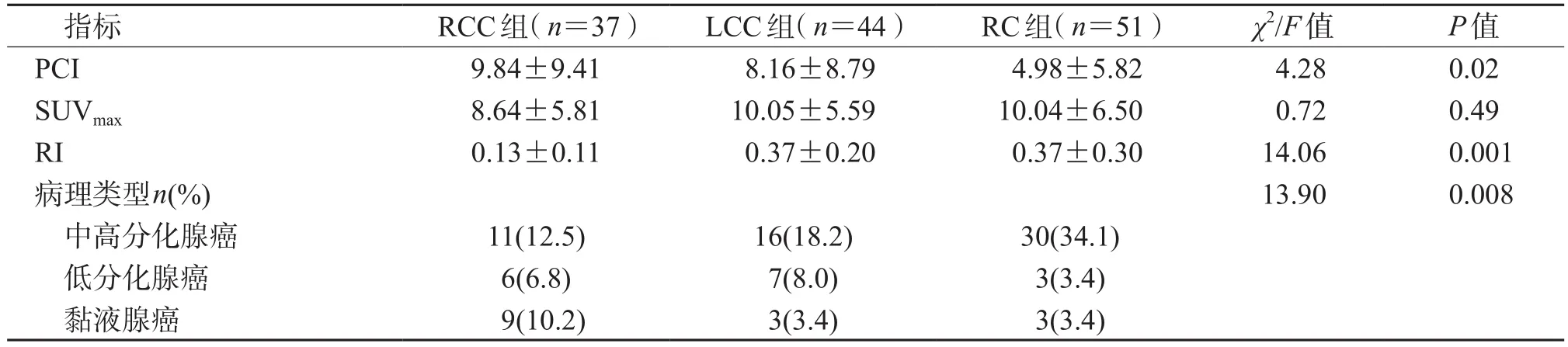
表1 PCI、SUVmax、RI、CRC病理类型与原发灶位置的关系
2.4 PCI、SUVmax、RI、CRC位置与原发灶病理类型的关系结果(表2)显示:按照CRPC原发灶CRC病理类型分为中高分化腺癌组、低分化腺癌组和黏液腺癌组,CRC位置在3组间差异有统计学意义(P<0.05),其余观察指标PCI、SUVmax和RI差异均无统计学意义。CRC原发灶位置方面,中高分化腺癌组与黏液腺癌组(χ2=11.49,P=0.003)之间差异具有统计学意义(P<0.017),中高分化腺癌以直肠为主,黏液腺癌以右半结肠为主;中高分化腺癌组与低分化腺癌组(χ2=4.00,P=0.14)、低分化腺癌组与黏液腺癌 组(χ2=4.36,P=0.14)之间差异无统计学意义。 因SUVmax是最常用的代谢参数,且在3组资料之 间差异接近有统计学意义(P=0.09)。因此进一 步两两比较,结果显示中高分化腺癌组SUVmax高 于黏液腺癌组,2组之间的差异具有统计学意义 (P=0.03),中高分化腺癌组与低分化腺癌组、 低分化腺癌组与黏液腺癌组之间差异均无统计学 意义。

表2 PCI、SUVmax、RI、CRC位置与原发灶病理类型的关系
3 讨 论
结直肠的解剖部分之间存在发育和生理上的差异。近年来,因RCC和LCC的不同结局、预后以及对化学疗法的临床反应,其之间的区别已成为研究热点[8]。据美国癌症中心统计,不同部位CRC发病趋势有所不同,LCC发病率逐渐下降,而RCC发病率却增加了约25%[9]。芬兰学者Bufill[10]研究认为,因LCC和RCC在临床病理特征、诊治方针及预后上存在差异,结肠癌应以结肠脾曲为界限做不同区分,首次提出将RCC与LCC作为2种不同疾病看待的概念。Benedix等[11]研究认为,肿瘤分化程度与肿瘤位置关系密切:肿瘤越靠近回盲部,肿瘤分化程度越低;越靠近乙状结肠,则中高分化越多见。RCC病变一般比LCC病变更大,更晚期,主要是分化较差的呈黏液状印戒组织学特征[12]。本研究中RCC组与RC组在病理类型方面有差异,分析提示RCC组黏液腺癌及低分化腺癌为15例、中高分化腺癌11例,而RC组黏液腺癌及低分化腺癌仅6例、中高分化腺癌为30例,提示越靠近回盲部低分化肿瘤占比越高;越靠近直肠中高分化肿瘤占比越高,与上述研究[11-12]基本一致。
国内外已经达成共识,腹膜转移是一个多阶段、多因素参与且涉及许多分子机制的复杂过程。CRC腹腔内播散形成CRPC的途径有直接蔓延、种植转移、手术操作或创伤等[13]。虽然存在一定的肿瘤异质性,但是肿瘤原发灶的性质往往与其转移病灶相近。相比LCC,RCC多为黏液腺癌及印戒细胞癌,分化程度低,生物学行为上更具侵袭性[14]。有关研究[15-17]也显示,黏液腺癌患者发生CRPC的概率明显增加。本研究中,RCC组的PCI评分为(9.84±9.41)分,而直肠组PCI评分为(4.98±5.82)分,差异具有统计学意义,提示RCC组累及腹膜的范围要比RC组更广泛、更严重。本研究结果未能显示RCC组与LCC组间的PCI与原发灶病理类型的差别,可能与入组病例数偏少有关。
黄斯韵等[18]回顾性分析经病理证实的37例黏液腺癌和50例非黏液腺癌的CT和PET/CT图像数据发现,黏液腺癌组CT平扫和增强上的密度、CT强化幅度均明显低于非黏液腺癌组;黏液腺癌的病灶内低密度区的强化程度、低密度区占比、淋巴结及远处转移比例均高于非黏液腺癌组;在PET/CT上黏液腺癌的SUVmax明显低于非黏液腺癌。黏液腺癌和印戒细胞癌内具有大量的黏蛋白及黏液成分,血管稀疏,因此在CT上密度偏低、18F-FDG代谢较低。
本研究中,中高分化腺癌组CRPC的SUVmax为 10.25±6.08,而黏液腺癌组SUVmax为6.62±3.36,2组差异有统计学意义,可见黏液腺癌组CRPC的18F-FDG代谢水平普遍低于中高分化腺癌组。另外,由于本研究中RCC组中以黏液腺癌和低分化腺癌为主,而LCC组和RC组以中高分化腺癌为主,RCC组的RI明显低于LCC组和RC组。提示即使增加显像时间,黏液腺癌的18F-FDG代谢水平增加幅度有限,一般也低于非黏液腺癌组;另一方面,低RI的CRPC病灶可能提示其倾向黏液腺癌为主。常规腹盆腔CT增强上由于CRPC密度和强化与脏器相仿,常易被忽略导致假阴性。对于经验不足的低年资PET/CT诊断医生来说,高FDG代谢的CRPC容易诊断,但对于这些低FDG代谢CRPC(PET上假阴性)易漏诊。因此,在分析此类患者的PET/CT图像时,需要更加注重基于CT的解剖结构和病变的仔细分析,而不能过分依赖基于PET的高FDG摄取的显著标识。
本研究尚存在一些不足:(1)44例无术后病理的CRPC患者被排除进一步分析,中、高分化腺癌未能分组研究,低分化腺癌组与黏液腺癌组病例数偏少;(2)CRPC影像学评估存在一定的假阴性和假阳性,尤其是长径小于0.5 cm的小病灶以及小于1.0 cm的低FDG代谢乏血供病灶,这是现阶段医学影像学检查的局限性;(3)本中心CRPC外科切除的有限开展导致仅有部分CRPC获得病理证实。进一步将计划加强与胃肠外科和肿瘤科等相关科室密切合作,力争取得可疑病灶完整病理学结果,后期扩大样本量对CRPC进行更高效的前瞻性研究。
综上所述,CRPC的PET/CT参数与原发灶CRC位置和病理类型有一定关系,右半结肠黏液腺癌的PCI高于直肠中高分化腺癌,但葡萄糖代谢指标(SUVmax与RI)相对较低。因此,18F-FDG PET/CT尤其葡萄糖代谢功能显像有利于中高分化腺癌的CRPC的检出,对于CRC患者CRPC的诊断和评估有重要临床价值和意义。
利益冲突:所有作者声明不存在利益冲突。
