双氢青蒿素对MRL/lpr狼疮鼠的治疗作用及其对滤泡辅助性T细胞的调控作用
2022-07-08薛美娟黄俊霞
薛美娟,黄俊霞,杨 骥
复旦大学附属中山医院皮肤科,上海 200032
系统性红斑狼疮(systemic lupus erythematosus,SLE)是多种因素共同作用而导致免疫功能异常的自身免疫性疾病,可累及全身多种组织和器官。SLE的主要特征是产生大量自身抗体,形成免疫复合物在组织中沉积,导致补体激活,自身反应性细胞增多[1-2]。滤泡辅助性T细胞(T follicular helper cells,TFH)作为一类特殊的CD4+T细胞亚群,其主要作用是辅助B细胞分化增殖、抗体分泌,B细胞产生大量自身免疫性抗体,造成SLE免疫炎症损伤[3-4]。TFH细胞及分泌的IL-21增多与SLE病情活动度、自身抗体分泌正相关[5-6]。
青蒿素及其衍生物除抗疟作用外,双氢青蒿素高效且低毒,有较明显的免疫抑制作用,有良好开发前景,但有关双氢青蒿素治疗SLE的免疫研究机制仍较少[7-10]。有研究[11]表明,双氢青蒿素在SLE中发挥免疫调节作用,通过调节Th17/Treg平衡,抑制Th17细胞分化及促炎作用,促进Treg细胞分化及其免疫抑制作用。迄今未发现关于双氢青蒿素对狼疮鼠体内外TFH细胞的调控研究。本研究旨在探讨双氢青蒿素对狼疮鼠的治疗作用,及其在体内外对TFH细胞分化的调控作用,为双氢青蒿素应用于红斑狼疮治疗提供理论基础。
1 材料与方法
1.1 实验材料雌性MRL/lpr狼疮鼠购买自中科院上海生命科学院斯莱克实验动物有限公司;双氢青蒿素(相对分子质量284.35)购买自CSNpharm公司;IL-21和IL-6于Peprotech公司购买;初始CD4+T细胞分选试剂盒和T细胞活化/扩增试剂盒购买自德国美天旎公司(Miltenyi Biotec);尿蛋白检测试剂盒来自南京建成生物工程研究所;异硫氰酸荧光素(FITC)-CD4流式抗体、别藻蓝蛋白(APC)-CXCR5流式抗体、藻红蛋白(PE)-PD-1流式抗体均来自于BD公司。IL-21酶联免疫吸附(ELISA)试剂盒购买自R&D Systems公司。
1.2 实验动物分组及处理12只12周龄的雌性MRL/lpr鼠,饲养于我院SPF级动物房,体质量(30.1±2.1)g。随机数字表法将小鼠随机分为2组,双氢青蒿素治疗组和对照组,每组各6只。通过查阅相关文献[11-13]及咨询CSNpharm公司实验人员,100~150 mg/kg双氢青蒿素灌胃治疗可有效治疗狼疮症状。本研究体内实验予150 mg/kg双氢青蒿素灌胃给药,1次/d,持续给药4至16周,对照组以同样方法PBS溶液灌胃给药。治疗结束时使用考马斯亮蓝法检测24 h尿蛋白,之后处死狼疮鼠,取脾称重,剪碎研磨脾脏从其中分离单个核细胞,之后用FITC-CD4、PE-PD-1、APC-CXCR5流式抗体,4℃避光染色20 min,上机检测圈出CD4+T淋巴细胞,再从CD4+T的淋巴细胞图中圈出PD-1+和CXCR5+的淋巴细胞,计算CXCR5+PD-1+淋巴细胞在CD4+细胞中的百分比。取肾脏,放入4%多聚甲醛固定,其后经脱水透明处理后,样品浸蜡包埋,病理切片机切片,根据H-E染色进行肾脏病理评分,评分方法参考该文献[14]。收集血清,ELISA试剂盒检测治疗组和对照组抗ds-DNA抗体及ANA抗体含量。
1.3 体外TFH细胞培养诱导分化及流式检测从对照组MRL/lpr狼疮鼠中分离单个核细胞,初始CD4+T细胞试剂盒分选初始CD4+T细胞,在细胞培养液中加入10 ng/mL IL-21、20 ng/mL IL-6和T细胞活化/扩增试剂盒中的MACSiBeads Particles诱导分化5 d,不同浓度梯度(0 μM、0.1 μM、1.0 μM、10 μM)双氢青蒿素干预,共分为4组。体外培养5 d后,用FITC-CD4、PE-PD-1、APCCXCR5流式抗体4℃避光染色20 min,流式细胞仪检测CD4+CXCR5+PD-1+T细胞在CD4+T细胞中的比例。
1.4 IL-21水平测定收集上述TFH细胞培养上清,根据IL-21 ELISA试剂盒说明书检测TFH细胞分化过程中分泌的IL-21含量。
1.5 统计学处理采用GraphPad Prism 7.0软件,通过Studentt检验和方差分析进行统计学分析,计量资料以x±s表示。检验水准(α)为0.05。
2 结 果
2.1 双氢青蒿素对MRL/lpr狼疮鼠的治疗作用结果(图1、表1)显示:双氢青蒿素系统治疗MRL/lpr小鼠4周后与对照组相比较,24 h尿蛋白含量更低,分别为(1 536±150.1)μg/24 h和(2 548±93.30)μg/24 h,t=5.726,P<0.01。双氢青蒿素治疗组肾脏病理评分是2.410±0.535,对照组为5.713±0.662,t=6.716,P<0.01。治疗组抗ds-DNA抗体低于对照组[(345.3±29.00)vs(477.8±20.07)IU/mL,t=7.514,P<0.01],治疗组ANA抗体也低于对照组[(514.5±19.64)vs(726.3±16.27)IU/mL,t=8.302,P<0.01]。

图1 双氢青蒿素治疗MRL/lpr狼疮鼠肾炎H-E染色图
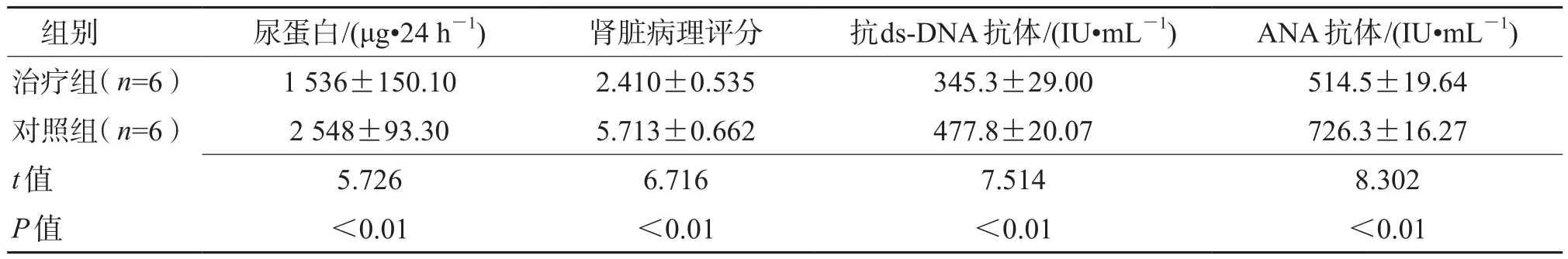
表1 双氢青蒿素治疗组对MRL/lpr狼疮鼠的治疗作用
2.2 双氢青蒿素抑制MRL/lpr狼疮鼠体内外的TFH细胞分化双氢青蒿素治疗MRL/lpr狼疮鼠4周后,可有效抑制MRL/lpr狼疮鼠脾脏增生,治疗组脾脏重量(0.28±0.03)g,对照组(0.69±0.04)g(t=13.83,P<0.01)。 双 氢 青蒿素治疗组和对照组脾脏中TFH细胞比例分别为(12.40%±2.726%) 和(36.33%±2.750%),t=10.71,P<0.01,见图2。体外培养TFH细胞,0 μM与 0.1 μM、1.0 μM、10 μM双氢青蒿素干预,CD4+CXCR5+PD-1+TFH细胞比例和分泌的IL-21水平随着双氢青蒿素浓度增加而降低,相邻2组间差异均有统计学意义(图3)。

图2 流式检测MRL/lpr狼疮鼠脾脏中CD4+ CXCR5+ PD-1+ TFH细胞百分比

图3 双氢青蒿素体外抑制MRL/lpr狼疮鼠TFH细胞分化及其IL-21的分泌
3 讨 论
SLE是一种常见的累及多系统多器官的自身免疫性疾病,目前主要的治疗药物为糖皮质激素,某些特定类型的SLE亦可使用环磷酰胺和生物制剂等免疫抑制剂,但长期使用糖皮质激素和免疫抑制药物会引起诸多严重不良反应。因此,进一步研究SLE免疫学发病机制,寻找新的高效低毒治疗药物,对提高SLE诊疗水平具有重要意义。
SLE是一种以B细胞过度活化和致病性自身抗体形成增加为特征、累及全身系统器官的自身免疫性疾病。TFH细胞主要辅助B细胞向浆细胞分化、促进抗体分泌。诸多前期研究[5,15]发现SLE患者外周血中TFH细胞比例增多,与自身抗体滴度正相关,并与SLE病情活动密切相关。在MRL/lpr狼疮鼠中也证实TFH细胞和其分泌的IL-21与生发中心扩增和自身抗体分泌密切相关[6]。SLE发病与TFH细胞过度活化和IL-21过量分泌密切相关,因此抑制TFH细胞分化和功能可能进一步抑制B细胞过度活化和抗体分泌,从而TFH细胞可作为治疗SLE的有效靶点[16]。
自屠呦呦教授团队因研发青蒿素获诺贝尔奖后,青蒿素及其衍生物的研究备受关注。青蒿素化学结构中含过氧桥结构,可产生大量水溶性和脂溶性衍生物,如双氢青蒿素、蒿甲醚、蒿乙醚和青蒿琥酯等。双氢青蒿素除有抗疟疾作用外,还具有免疫调节作用[7,17-18]。例如,有研究[9]显示,双氢青蒿素衍生物DC32通过恢复Treg/Th17平衡和下调IL-6来减轻小鼠胶原诱导的关节炎。双氢青蒿素通过抑制MRL/lpr鼠中Toll样受体4信号通路的激活和脾细胞中Ⅰ型干扰素的产生进而缓解狼疮炎症损伤[13]。本研究发现双氢青蒿素可有效缓解狼疮鼠肾脏损伤,降低24 h尿蛋白、抗ds-DNA抗体和ANA抗体滴度,可有效抑制狼疮鼠脾脏增生、抑制TFH细胞增生。体外研究表明,双氢青蒿素可剂量依赖性抑制TFH细胞分化及IL-21的分泌,提示双氢青蒿素可能通过抑制TFH细胞扩增分化及其细胞因子分泌,从而达到治疗狼疮的作用。
综上所述,本研究仅从双氢青蒿素对TFH细胞的影响揭示了部分治疗机制,而缓解狼疮发病的其他机制还有待更多研究。双氢青蒿素具有较为明确的抗炎和免疫调节作用,随着相关研究的增多,有望应用于SLE等自身免疫性疾病的治疗。
利益冲突:所有作者声明不存在利益冲突。
