废脱硝催化剂加盐焙烧-酸浸提钛的浸出动力学研究
2022-07-08王路平梅光军袁勤智于明明
王路平,梅光军*,吴 敏,袁勤智,于明明
(1.武汉理工大学资源与环境工程学院,湖北 武汉 430070;2.江西理工大学资源与环境工程学院,江西 赣州 341000)
0 引言
氮氧化物会导致酸雨、臭氧层空洞等各种环境问题[1],而我国火电厂发电过程中会产生大量的氮氧化物[2],随着国家环保政策的推进,烟气脱硝技术被广泛应用[3]。脱硝催化剂是烟气脱硝技术的关键部分,在长期的烟气处理后,催化剂会中毒失活,使用寿命通常为3~5 年[4],随着更换期的到来,废脱硝催化剂的年产量将达到4 万t 以上[5]。多数废催化剂被填埋处理,而2014 年环保部将废脱硝催化剂(钒钛系)纳入危险废物[6],按危险废物直接填埋将大大提高企业经济负担,并且废脱硝催化剂本身含有宝贵的钛资源,因此,对废催化剂中的钛资源进行回收,将危废变为固废,实现环保与经济效益的双收,具有重要的现实意义。
目前市面上的脱硝催化剂基本是以TiO2为载体,典型的脱硝催化剂含80%~90% TiO2,1%~3%V2O5,<10% WO3,对其回收的主要方式包括酸浸法、碱浸法以及钠化焙烧法。酸浸法和碱浸法都是通过浸出钒钨实现和钛的分离,然后进行钒钨的回收,浸渣则为二氧化钛或含部分钛酸钠的二氧化钛,通过酸洗再焙烧得到二氧化钛。而钠化焙烧法则是在加入钠化剂焙烧后水浸分离钒钨,浸渣通过酸洗再焙烧得到二氧化钛[7]。而某企业废脱硝催化剂(本研究的原料)氧化铝和二氧化硅含量在90% 以上,TiO2含量很低,尚无对此类废脱硝催化剂回收的研究,然而企业出于成本考虑,回收愿望迫切。笔者参照其他废催化剂处理方法,在实验室开展了相关探索试验。通过加盐焙烧后水浸得到钒浸出液,浸渣再酸浸得到钛浸出液,然后分别对钒浸出液进行除杂沉钒回收,钛浸出液通过水解回收钛,钒钛提取率都达到90%以上。在前期工作基础上,此处重点研究了酸浸过程中钛的浸出动力学,从酸浸温度、硫酸浓度两方面研究其在浸出过程中的控制作用,用来更深入了解酸浸过程中反应速率的控制因素,为此类废脱硝催化剂中钛的回收提供技术参考。
1 试验部分
1.1 试验原料
试验原料为某企业废脱硝催化剂,经破碎、水洗、烘干后磨至粉状待用。通过X 射线荧光光谱分析得出其化学成分,如表1 所示。
1.2 试验方法
通过文献调研,参照其他废催化剂处理方法,制定了以下具体回收方案:将废催化剂加盐焙烧后,焙烧熟料水洗后烘干进行酸浸。为确保浸出过程中硫酸浓度不变,采用较大的液固比16:1,将硫酸定量加入烧杯中,置于恒温磁力加热搅拌器加热升至设定温度,加入一定量焙烧熟料,定速搅拌,用保鲜膜密封烧杯保证恒定液固比,反应过程中定时取样,分析钛的浸出率,浸出率利用式(1)计算。
式中,取样液钛浓度采用icp 进行测定,mg/mL;酸浸体积,mL;原样质量,g;原样钛含量,mg/g。
探究硫酸浓度影响时,选择硫酸质量分数分别为30%、45%、60%,浸出温度80℃;探究酸浸温度影响时,选择浸出温度分别为30、40、60、80 ℃,硫酸质量分数为60%。液固比均为16:1,定时取样,检测钛的浸出率。
1.3 浸出动力学分析
废脱硝催化剂焙烧熟料的硫酸浸出是液-固多相反应,反应先在颗粒表面发生,随着反应进行逐渐向颗粒中心收缩,未反应核变小,因此钛的酸浸过程可认为符合未反应核收缩模型[8]。核缩模型的浸出过程受液相传质、固膜扩散、表观化学反应三者中最慢环节控制或受混合控制,而在高速搅拌下,可以忽略液相传质的影响,因此浸出反应速率受固膜扩散控制、化学反应控制或两者混合控制[9]。
受化学反应、固膜扩散、两者混合控制的反应方程分别如下[10]:
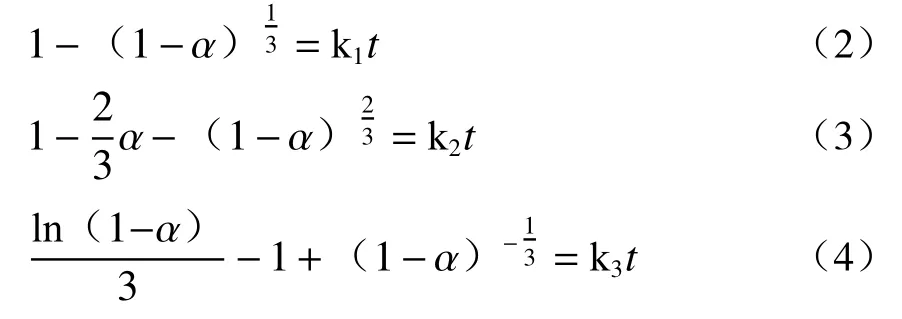
式中,α为浸出率,%;k1为化学反应速率常数;k2为扩散速率常数;k3为混合速率常数;t为反应时间,min。
阿伦尼乌斯公式给出了反应速率常数和温度两者之间的关系,公式为:

式中,k 为反应速率常数;A 为指前因子;Ea为表观活化能,J/mol;R 为理想气体常数,J/(mol·K);T为绝对温度,K。
将阿伦尼乌斯公式经过推导可得到:

因此,以lnk 对1/T作图,拟合直线的斜率k′=−Ea/R,从而可求出表观活化能Ea。
2 结果与讨论
2.1 硫酸浓度对反应速率的影响
不同硫酸浓度下钛浸出率与时间关系见图1。

图1 硫酸浓度对钛浸出率的影响Fig.1 Influence of sulfuric acid concentration on leaching rate of titanium
由图1 可知,在硫酸浓度较低时,钛浸出率也较低,且在短时间内浸出率基本达到稳定,硫酸质量分数30% 时,30 min 浸出率就达到36.76%。而到了180 min,浸出率也只有43.88%,仅提高7.12 个百分点。而随着硫酸浓度的增大,钛浸出率显著提高,在硫酸质量分数分别为45% 和60% 时,30 min 浸出率分别为46.25% 和50.05%,180 min 浸出率则分别为75.53% 和99.41%,分别提高了29.28 个百分点和49.36 个百分点。
硫酸浓度提高,意味着浸出剂与废催化剂颗粒的碰撞概率增大,反应更容易发生,速率更快,图1中45%和60%质量分数的硫酸浸出在相同时间钛浸出率都更高,且浓度越高,增速越大,与之符合。而30%质量分数硫酸浸出钛浸出率很快稳定且较低,可能是因为随着反应进行,硫酸被消耗,导致浸出剂不足。综合考虑,硫酸质量分数选择60%,此时180 min 钛浸出率为99.41%。
2.2 酸浸温度对反应速率的影响
不同酸浸温度下钛浸出率与时间关系见图2。

图2 浸出温度对钛浸出率的影响Fig.2 Effect of leaching temperature on leaching rate of titanium
由图2 可知,在反应初期,温度越高,浸出率越高,速率越快;而随着反应的进一步进行,低温时浸出率很快稳定,保持在一个较低水平,而更高温度时反应速率仍然较大,浸出率迅速提高。
相同时间内,钛浸出率随着温度升高而提高,反应30 min,30 ℃钛浸出率为26.95%,而80 ℃浸出率为50.05%,提高了23.1 个百分点。温度升高,溶液中离子移动速度提高,浸出剂扩散加剧,加快了反应速率。而随着反应继续进行,颗粒外层附着的生成物形成阻碍,低温时扩散力与阻力很快平衡,导致浸出率很快平稳;而更高温度时扩散力更大,浸出速率仍然较高,因此浸出率随时间增加进一步提高。综合考虑,浸出温度选择80 ℃。
2.3 浸出动力学分析
将不同硫酸浓度的钛浸出率变化数据分别带入式(2)~(4)中进行线性拟合,结果如图3 所示。由图3 可知,硫酸质量分数为30% 时,与t有良好的线性关系,而硫酸质量分数为45%和60%时,与t 有较好的线性关系,这说明硫酸质量分数为30%时,酸浸过程主要受化学反应和固膜扩散两者混合控制,而在浓度提高到45% 以上后,则转变为受化学反应控制。

图3 不同硫酸浓度浸出率与时间的关系Fig.3 Relationship between leaching rate and time at different sulfuric acid concentrations
由浸出动力学可知,受外扩散控制时,提高浸出剂浓度能迅速提高浸出速度;而受化学反应控制时,增大浸出剂浓度也能提高反应速率。在低浓度时,外扩散速率和化学反应速率两者同时制约了浸出速率,所以浸出率较低,此时浸出过程受混合控制;而随着浓度增大,外扩散速率迅速增大,不再成为制约,化学反应速率也进一步提高,浸出速率从而提高,浸出过程转变为化学反应控制;随着浓度继续增大,化学反应速率继续提高,浸出速率继续增大,这与图1的数据结果吻合,进一步说明低浓度时酸浸反应过程受固膜扩散(外扩散)和化学反应混合控制,而随着浓度增大转变为化学反应控制。
将不同温度的钛浸出率变化数据分别带入式(2)~(4)中进行线性拟合,结果如图4 所示。
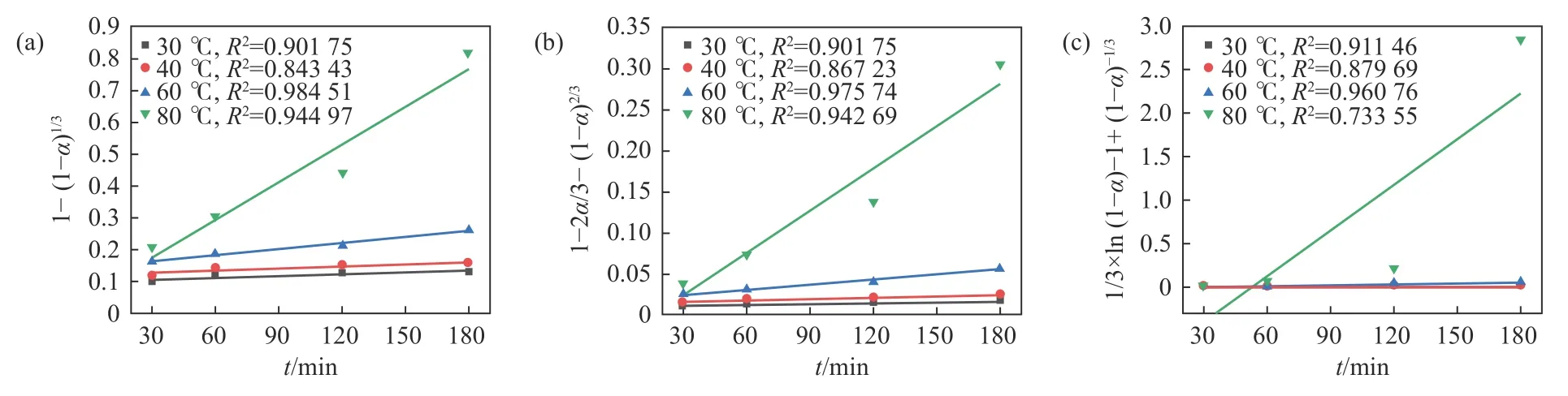
图4 不同温度浸出率与时间的关系Fig.4 Relationship between leaching rate and time at different temperatures
由浸出动力学可知,受固膜扩散或化学反应控制时,升温都能提高浸出速率。较低温时,扩散速率和化学反应速率共同制约了浸出速率,此时酸浸过程受两者混合控制,浸出率低;随着温度升高,扩散速率和化学反应速率都提高,扩散速率不再成为反应速率的制约,酸浸过程转变为化学反应控制,升温使得浸出速率进一步提高,这与图2 的数据结果吻合,进一步说明低温时酸浸过程受混合控制,较高温时则转为化学反应控制。
将不同硫酸浓度C的反应速率常数k 以lnk对lnC作图,拟合直线斜率即为表观反应级数n,由图5 可知,酸浸过程的表观反应级数为4.932。
图5 lnk 与lnC 的关系Fig.5 Relationship between lnk and lnC
利用式(6),分别代入30、40 ℃时和60、80 ℃时的lnk 和1/T数据,分别求得30、40 ℃时的浸出过程表观活化能为30.23 kJ/mol,60、80 ℃时的浸出过程表观活化能为92.92 kJ/mol。由浸出动力学可知,混合控制的表观活化能在12~41.8 kJ/mol,化学反应控制的表观活化能应大于41.8 kJ/mol,这与计算结果吻合,进一步说明30、40 ℃时酸浸过程为混合控制,60、80 ℃时则为化学反应控制。
3 结论
通过对废脱硝催化剂加盐焙烧后酸浸时钛的浸出过程的动力学研究,可得到以下结论:
1)对于试验所用的废脱硝催化剂,加盐焙烧后硫酸浸出钛的过程符合未反应核缩模型。在硫酸质量分数为30%时,浸出过程受混合控制,硫酸质量分数提高到45%以上后,浸出过程受化学反应控制,表观反应级数为4.932。
2)硫酸质量分数为60%时,较低温时浸出过程受混合控制,温度提升后受化学反应控制。受混合控制时,其表观活化能为30.23 kJ/mol,受化学反应控制时,其表观活化能为92.92 kJ/mol。
3)硫酸浓度和浸出温度对反应速率有很大影响。在硫酸质量分数60%,浸出温度80 ℃时,钛浸出率可达99%以上,而在硫酸质量分数为30%时和在温度为30 ℃时,钛浸出率仅分别为43.88%和34.97%。动力学研究表明,提高温度和提高硫酸浓度,都能大大提高钛浸出率。
