室内模拟实验法研究冻融循环下常见肠杆菌在河水中的存活特征及影响因素
2022-07-07袁伟琳封保根申艳萍陈薇薇
郭 平, 袁伟琳, 封保根,3, 申艳萍, 陈薇薇
(1. 吉林大学 新能源与环境学院, 地下水资源与环境教育部重点实验室, 长春 130012;2. 吉林大学 吉林省水资源与水环境重点实验室, 长春 130012; 3. 中国长江三峡集团有限公司, 武汉 430010)
随着畜禽养殖业的迅猛发展, 畜禽养殖, 尤其是病原微生物污染引起的河水环境污染问题日益严重. 病原微生物的大量滋生和传播导致畜禽疫病传播, 甚至危害人类健康[1-3], 已引起人们广泛关注. 肠杆菌细菌是畜禽粪便中常见的病原微生物, 属于人畜共患病致病菌. 因此, 了解河水中肠杆菌的存活特征对于病原微生物污染防控至关重要.
河水是一种化学成分十分复杂的溶液, 通常由可溶性物质、 胶体物质和悬浮物等组成, 是多种微生物群的天然宿主. 文献[4-9]研究了微生物在河流中的存活情况, 并指出它们的存活取决于非生物因素和生物因素. 其中, 河水的pH值、 温度、 电导率(EC)、 溶解氧(DO)、 化学需氧量(COD)、 生化需氧量(BOD)和营养物质是影响微生物存活的重要因素. 冻融循环是全球中高纬度和高海拔地区普遍存在的一种自然现象. 太阳活动和全球变暖引起的异常气候已导致中高纬度地区在初春和深秋季节河水的冻融循环现象更加频繁而且持续时间更长[10]. 冻融循环引起河水的冷冻浓缩效应同样会影响微生物的存活, 其中盐析和冷冻浓缩作用导致的细胞外液高盐度胁迫被认为是冻融循环损伤细菌细胞的两个主要原因[11]. 但目前冻融循环下细菌在河水中的存活规律及主要影响因素尚未见文献报道.
基于此, 本文以河水中常见的肠杆菌科细菌Escherichiacoli(Ec10538),Salmonellaentericasubsp.Enterica(sd-51)和Enterobactercloacaesubsp.Cloacae(Ec7256)为对象, 采用室内模拟实验法研究冻融循环下3株肠杆菌在河水中的存活特征及其与河水性质之间的关系, 并分析冻融循环影响细菌存活的机理, 旨在揭示高纬度和高海拔地区河水中病原微生物的存活规律, 为冻融期河水中病原微生物的污染防治和保障人体健康提供理论依据.
1 材料与方法
1.1 样品采集
在第二松花江干流和支流设置21个采样点采集水样进行室内模拟研究, 采样点设置如图1所示, 其中: 第二松花江干流设置9个采样点, 编号为W1-1~W1-9; 支流饮马河设置6个采样点, 编号为W2-1~W2-6; 支流伊通河设置6个采样点, 编号为W3-1~W3-6. 将采集的河水样品置于无菌瓶中, 4 ℃保存并运送至实验室. 水样过0.45 μm滤膜以除去样品中的水生动物和颗粒状物质. 过滤后的水样在4 ℃条件下密封避光保存, 用于水质分析和后期实验.
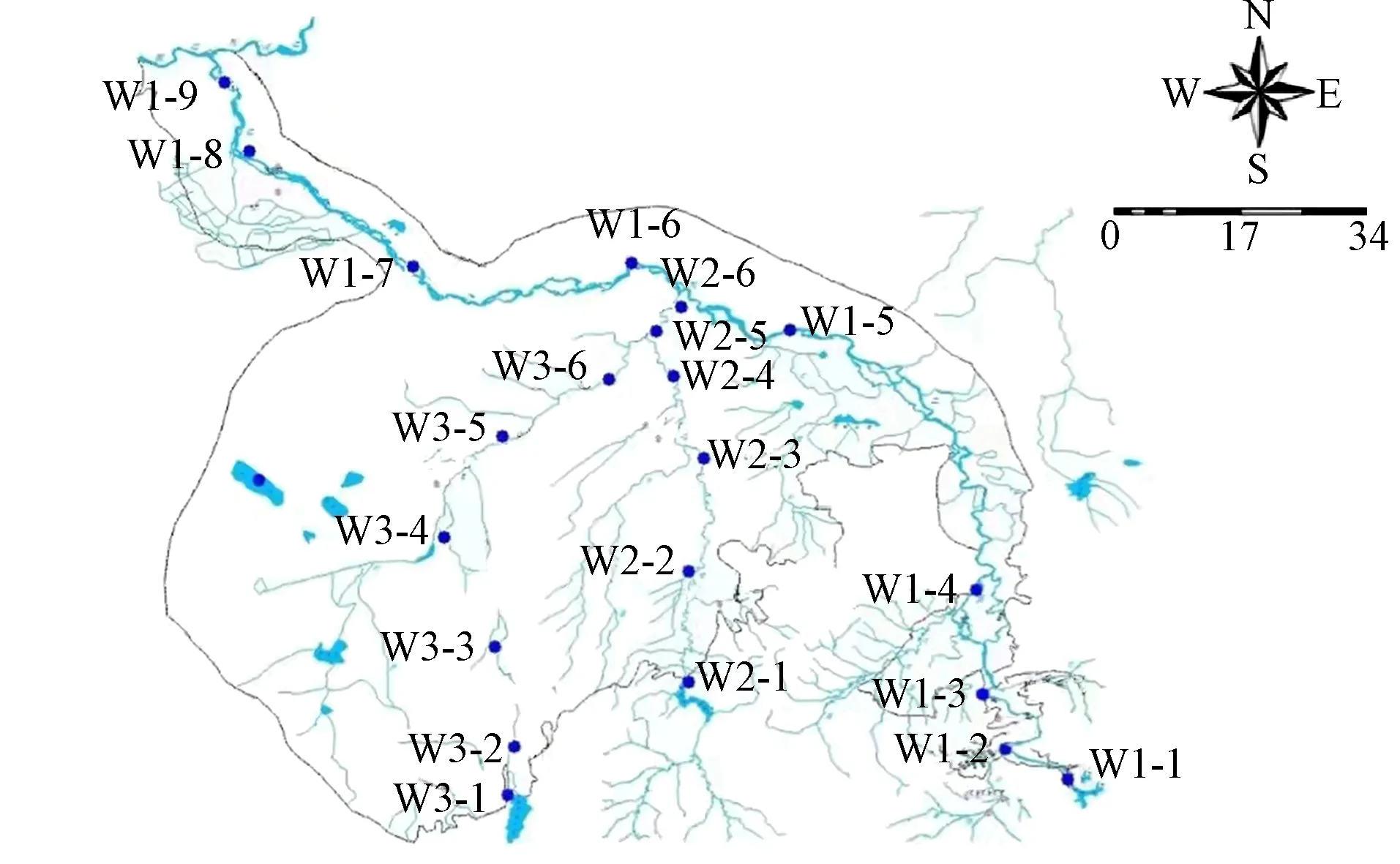
图1 第二松花江流域采样点分布Fig.1 Distribution of sampling points in the Second Songhua River basin
1.2 实验菌株和菌株标记
供试菌株为3株革兰氏阴性肠杆菌, 分别为Escherichiacoli, 分离号NCTC 10538;Salmonellaentericasubsp.Enterica, 分离号sd-51;Enterobactercloacaesubsp.Cloacae, 分离号ATCC 7256. 3株菌均为杆状、 异养兼性厌氧菌, 购自中国普通微生物菌种保藏管理中心(CGMCC). Ec10538最适生长温度为37 ℃, sd-51和Ec7256最适生长温度为30 ℃. 为在选择性培养基上计数, 将3株菌株分别用0.1 g/L利福平(Rif)进行抗生素标记. 采用分光光度法在600 nm下测定未标记和利福平标记实验菌株在不同培养时间的吸光度值, 这些菌株的生长曲线如图2所示. 由图2可见, 利福平抗生素标记未改变菌株的生长曲线.
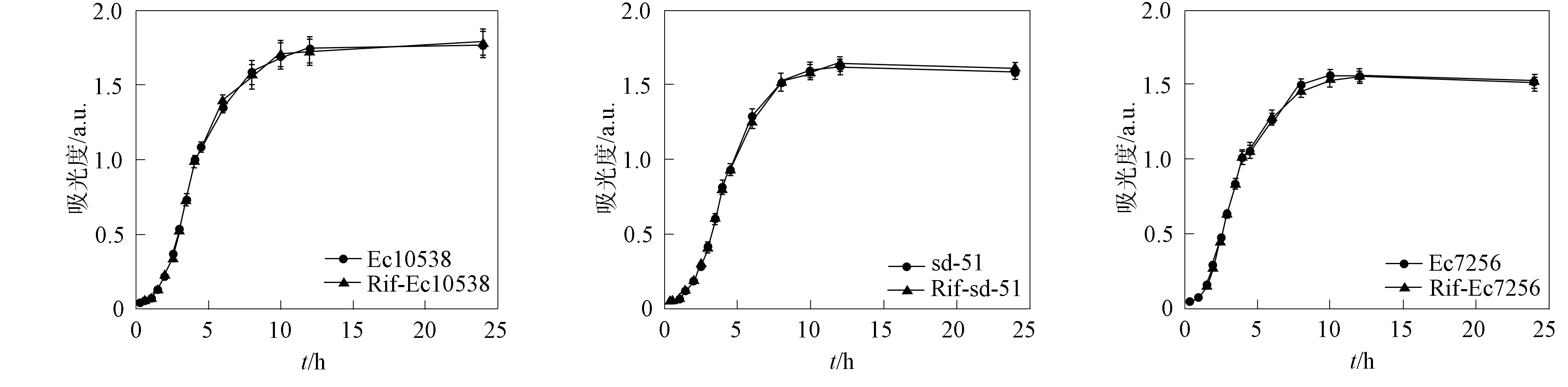
图2 未标记和利福平标记实验菌株的生长曲线Fig.2 Growth curves of unlabeled and Rifampicin-labeled experimental strains
1.3 菌液制备
分别接种3株标记肠杆菌于LB液体培养基中, 先在最适生长温度和250 r/min的恒温振荡箱(上海博珍仪器设备制造厂, TS-200B型)中培养12 h至菌株生长至对数期, 再在4.0 ℃, 8 000 r/min下离心10 min, 用无菌水清洗菌株3次, 调整OD600值为1, 细菌浓度约为l.0×l09CFU/mL(CFU为菌落数,下同). 处于寡养状态的菌液在4 ℃放置过夜备用.
1.4 冻融循环实验
将1 mL制备的菌液加入装有9 mL河水样品的离心管中, 混合均匀, 菌液初始浓度约为108CFU/mL[12], 置于高低温(交变)湿热试验箱(上海一恒科学仪器有限公司, BPHJS-2508型)中, 模拟冻融循环. 一个冻融循环为: -10 ℃冻结12 h和4 ℃融化12 h为处理组(FT). 同时, 以4 ℃培养24 h的细菌为对照组(NFT). 每隔1 d在处理组和对照组中取样, 在含0.1 g/L利福平的LB固体培养基上, 采用平板菌落计数法测定初始和每个冻融循环(即1 d)后细菌的存活数量. 细菌存活数量用lg(CFU)表示. 当连续2次冻融循环未检出细菌或经10次取样后停止取样. 每个实验重复3次.
选择水质较好的W1-1采样点水样和肠杆菌Ec7256为对象研究肠杆菌对冻融循环的耐受机制, 在3个冻融循环频次(FT0, 冻融循环前; FT2, 第二个冻融循环; FTE, 最后一个冻融循环)后测定FT组和NFT组Ec7256菌株的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性以及离解常数(pKa)和细胞表面疏水性(CSH), 从细菌抗氧化酶和表面结构等角度揭示肠杆菌对冻融循环的耐受机制.
1.5 指标测定
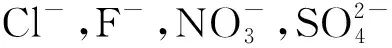
采用SOD和CAT检测试剂盒(紫外分光光度法)参照说明书分别测定细菌的SOD和CAT活性; 采用电位滴定法测定pKa[14]; 采用微生物黏着碳烃化合物法(MATH)测定CSH[15].
1.6 数据分析
通过Weibull分布模型对数据进行拟合, 根据Weibull分布模型拟合得到的相关指数计算水中细菌菌落数量下降至平板计数法最低检测限102CFU/mL所需时间(ttd)[16]. Weibull分布模型为
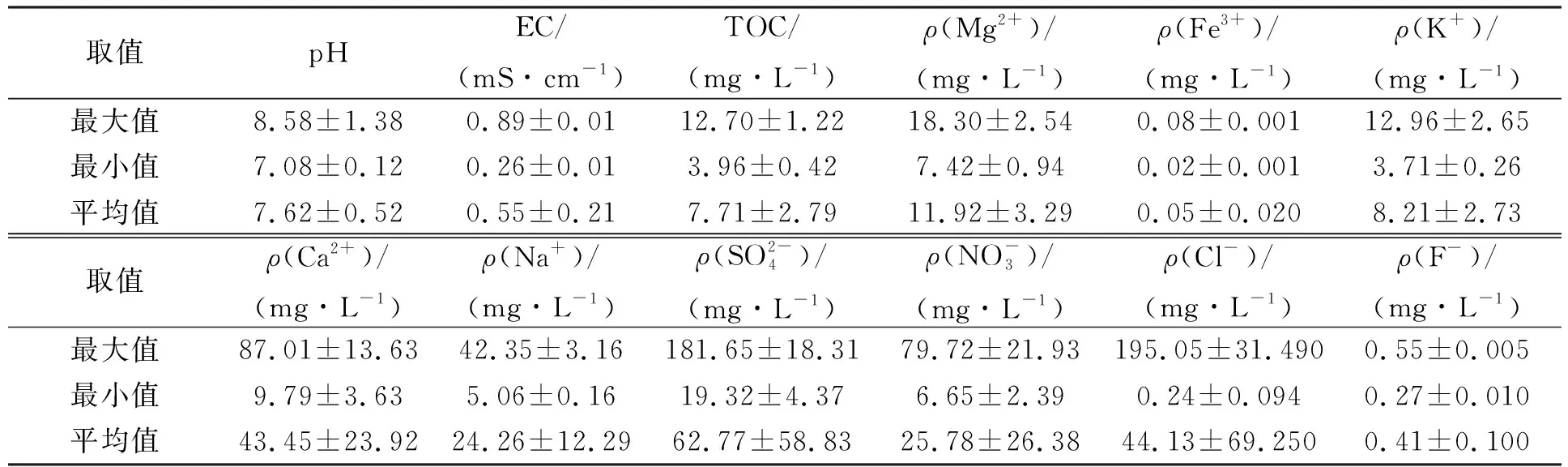
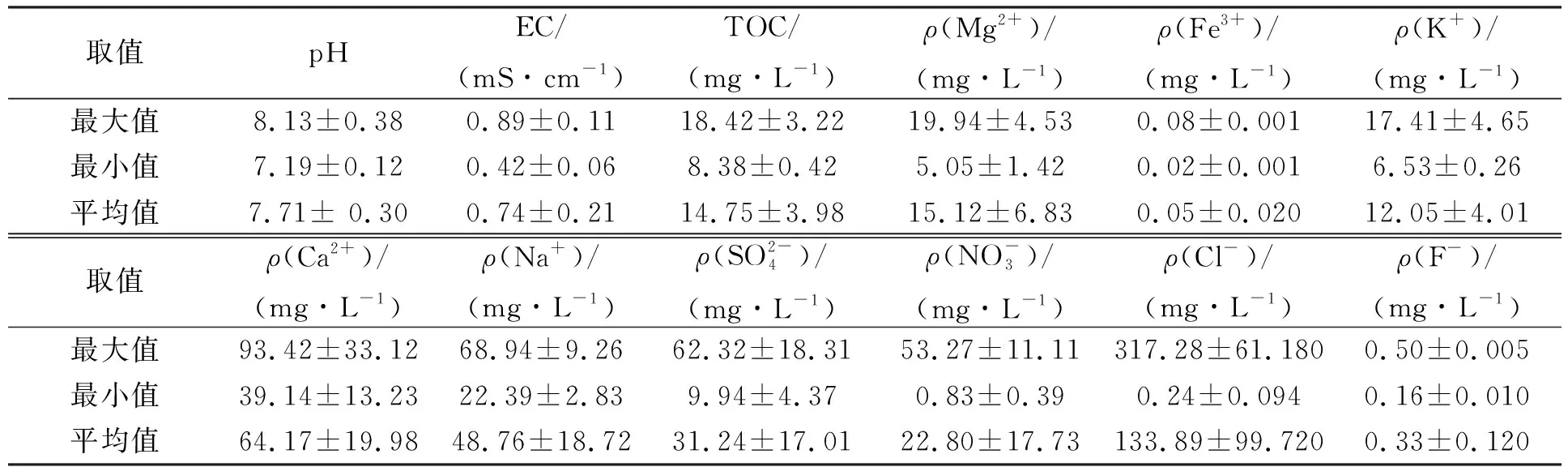
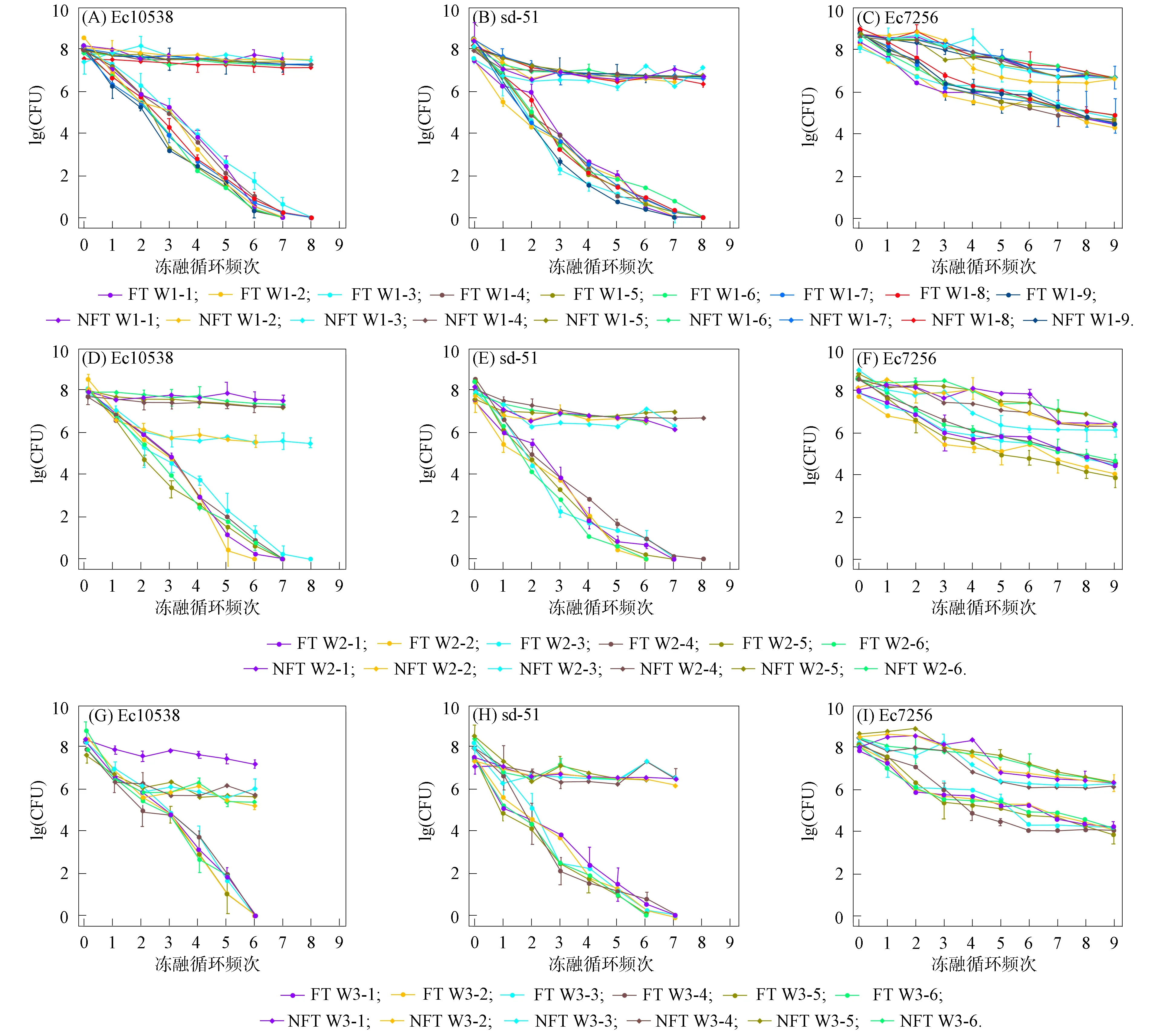
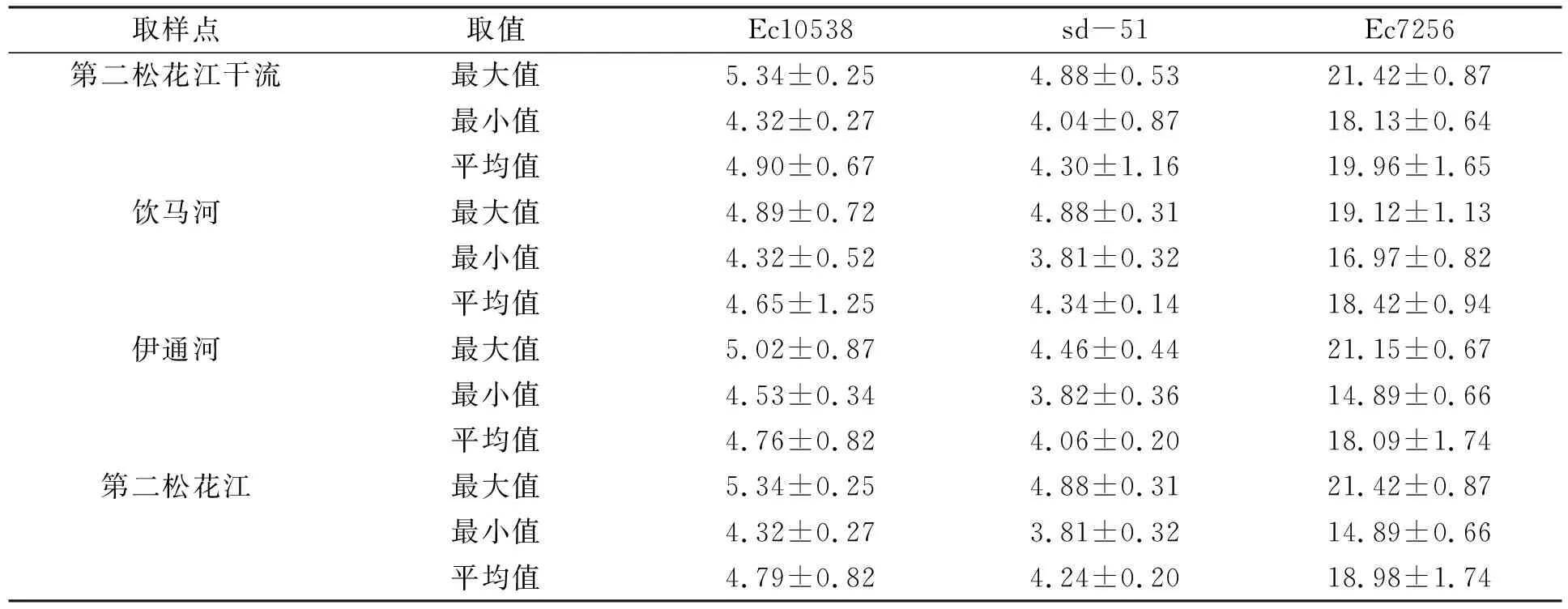
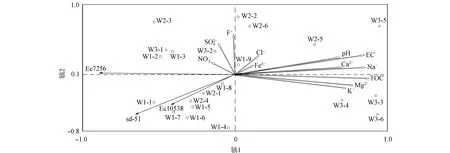
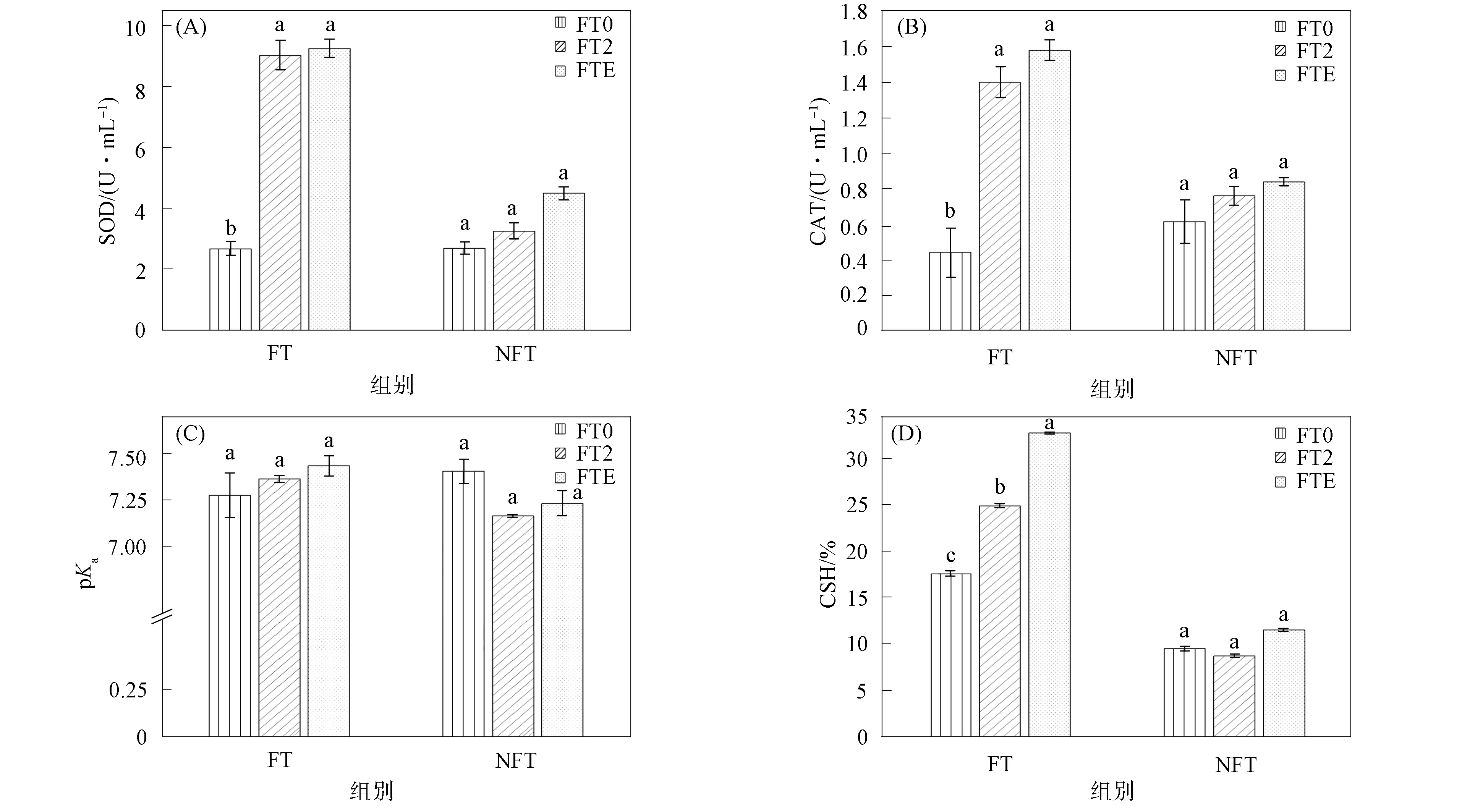
其中Nt为t时取样时水中细菌的浓度,N0为水中细菌的初始接种浓度,t为取样时间,δ为尺度参数,p为弧度参数(p>1时细菌的存活拟合曲线为凸状曲线;p 采用Microsoft Excel 2007进行数据统计分析; 利用SPSS 22.0(美国IBM公司)中单因素方差分析法比较各指标的差异; 采用Canoco 5软件(美国Microcomputer Power公司)进行冗余分析(RDA); 采用origin 2021软件(美国OriginLab公司)进行数据绘图. 2.1 河水性质 21个河水样品的基本性质分别列于表1~表4. 表1 第二松花江干流河水样品的基本性质 表2 饮马河河水样品的基本性质 表3 伊通河河水样品的基本性质 表4 第二松花江河水样品的基本性质 2.2.1 存活曲线 河水中Ec10538,sd-51和Ec7256的存活曲线如图3所示. 由图3可见, 与NFT相比, FT组中3株肠杆菌的存活数量显著降低, 且随着冻融频次的增加, 细菌存活数量逐渐降低. 微生物的形态结构以及生理生化活动和生长发育等生命活动均需稳定适宜的环境温度. 若环境温度发生剧烈变化, 则微生物的形态结构和生命活动均会发生变化, 进而影响其存活. 冻融循环引起肠杆菌存活数量降低主要有3个原因: 1) 水结冰形成冰晶, 导致细菌细胞机械损伤[17-18]; 2) 水冰相变使细胞内外渗透压失衡, 导致细胞脱水[19]和结构损伤[20-21]; 3) 冻融胁迫使细菌细胞产生过多的活性氧(ROS), ROS可破坏细胞结构和功能[22]. 冻融循环下肠杆菌在河水中的存活与菌种和水质有关. 在冻融循环下, Ec10538和sd-51的存活数量值与冻融频次增加的变化趋势相似, 经第1次冻融循环后存活数量明显下降了101~102CFU/mL, 在饮马河和第二松花江干流的水样中第8次冻融循环后以及在伊通河水样中第7次冻融循环后细菌数量低于检出限. Ec7256经第2次冻融循环后的存活数量仅下降约101CFU/mL, 在第9次冻融循环后仍可被检测到, 存活数量可达104CFU/mL. Ec7256在伊通河水样的存活数量显著低于第二松花江干流水样(P<0.05). 因此, Ec7256对冻融胁迫的耐受性比Ec10538和sd-51强, 且3株肠杆菌对冻融胁迫的耐受性与河流水质有关. 图3 不同冻融循环频次下Ec10538,sd-51和 Ec7256在21个水样中的存活曲线Fig.3 Survival curves of Ec10538,sd-51 and Ec7256 in 21 water samples under different frequencies of freeze-thaw cycles 2.2.2 存活曲线的模型拟合 表5 3株肠杆菌Weibull分布模型拟合参数 表6 21份水样中3株肠杆菌的ttd值 Table 6 ttd Values of three Enterobacteriaceae in 21 water samples d 为揭示冻融循环下影响肠杆菌在河水中存活的主要因素, 采用冗余分析研究冻融循环下肠杆菌ttd值与河水性质间的关系, 结果如图4所示. 其中实心箭头表示肠杆菌的ttd值, 空心箭头表示河水性质. 由图4可见, 2个排序轴共解释了肠杆菌ttd值差异的81.3%, 其中轴1和轴2分别解释了肠杆菌ttd值差异的78.93%和1.49%. 结果显示冻融循环下pH值、 EC和TOC对肠杆菌的ttd值具有显著性影响(P<0.05). 由箭头夹角的余弦值可见, pH值、 EC和TOC与肠杆菌的ttd值呈显著负相关, 表明冻融循环下pH值、 EC和TOC抑制了肠杆菌的存活. 图4 肠杆菌ttd值与河水性质的冗余分析Fig.4 Redundancy analysis between ttd values of Enterobacteriaceae and properties of river water 冻融循环下EC对水中细菌存活的抑制作用可能与冷冻浓缩效应导致准液体层中Mg2+,K+,Ca2+和Na+质量浓度增高有关. 高质量浓度的K+和Na+产生高渗透压, 破坏细菌的形态结构. 高质量浓度的Mg2+和Ca2+可与氨基酸中的羧基发生架桥作用[23], 抑制细胞内蛋白质的生成. pH 值对生命活动有重要影响, 也是影响细菌存活的最重要因素之一[24-26]. 碱性环境可抑制粪大肠菌群的存活, 随着pH值升高, 抑制作用增大[26]. 在碱性条件下, OH-影响营养物质的溶解度、 解离状态及细胞表面电荷平衡和细胞的胶体性质, OH-越多, 影响越大[27]. 在冻融循环条件下, 碱性溶液中准液体层的pH值增加[28], 进而抑制了冻融循环条件下肠杆菌的存活数量. TOC对肠杆菌存活具有显著抑制作用, 与可生物同化有机碳(AOC)对微生物存活具有促进作用的研究结果不一致[29]. AOC属于小分子有机物, 仅占溶解性有机质中很小的一部分, 主要成分包括羧酸、 酮类、 氨基酸和糖类等[30-31]. 而TOC代表了河水中的溶解性有机质总量. 通常情况下, 河水中溶解性有机质主要以大分子溶解性有机质为主, 其中溶解态富里酸(FA)在大分子溶解性有机质中的含量可高达90%[32]. FA是一类极其复杂的生物活性有机质, 无法被微生物直接利用. 此外, FA可通过聚集、 配合或沉积作用与细菌细胞分泌的蛋白结合形成腐殖质-蛋白复合物, 使细菌细胞的胞外活性物质失活, 抑制了细菌细胞活性, 从而降低了细菌细胞的存活能力[33]. 2.4 肠杆菌Ec7256对冻融循环的耐受机理 2.4.1 冻融循环下抗氧化酶体系的变化 冻融胁迫是诱发细胞内ROS代谢失衡的原因之一, 这种失衡可导致ROS积累. 超氧阴离子和过氧化氢是ROS的重要组成部分, 这两种活性氧会导致细胞大分子氧化, 如蛋白质羰基化、 脂质过氧化和DNA损伤等[34]. 超氧阴离子和过氧化氢积累量过多会导致细菌死亡. 抗氧化酶可在一定程度上消除各种环境胁迫下细胞产生的ROS. SOD和CAT是细胞内的抗氧化酶, 可将ROS转换为毒害较低的物质或无害物质. SOD可将超氧阴离子转化成过氧化氢, CAT可将体内的过氧化氢分解成无毒的水和氧气. 因此, 这两种酶都是细菌消除冻融胁迫产生ROS的关键酶[35]. 在冻融胁迫下, 细菌细胞可通过产生更多SOD和CAT降低ROS水平实现细胞自我修复, 从而对ROS损伤做出反应. 所以, 在冻融胁迫下, 细菌这两种酶活性越高, 其对冻融胁迫的耐受性越强. 不同处理下SOD和CAT活性随冻融循环频次的变化如图5所示. a,b,c: 相同字母表示无显著性差异(P>0.05); 不同字母表示有显著性差异(P<0.05). 由图5(A),(B)可见, FT组SOD的活性高于NFT组. 在NFT组中, 不同频次下SOD活性均无显著差异, 可见在未冻融循环下细菌体内SOD酶活性没有变化, 表明细菌体内ROS产生和清除是一个动态平衡过程. 但存在少量细菌数量降低, 这可能与细菌正常衰老死亡有关. 在FT组中, FT2和FTE明显高于FT0(P<0.05). NFT组和FT组体系中CAT活性的变化趋势与SOD活性一致, 但活性大小存在差距. 冻融循环导致SOD和CAT活性变化的原因为: 1) 冻融胁迫促进了这两种抗氧化酶的产生, 且抗氧化酶随冻融循环频次的增加而积累; 2) 肠杆菌可能产生更多SOD和CAT以适应冻融的逆境[35]. 微生物中呼吸酶会受到冻融胁迫的抑制, 导致呼吸链中电子积累, 从而诱导更多的ROS产生[36]. 细胞产生更多的SOD和CAT以降低ROS损伤. 随着冻融循环频次的增加, SOD和CAT不断积累(FTE高于其他冻融频次的活性), 进而降低细菌失活数量. 冻融循环后, 体系中SOD((9.05±0.47)~(9.27±0.30)U/mL, 其中U为25 ℃下, 1 min内能转化1 μmol底物的酶量)显著高于CAT((1.41±0.08)~(1.585±0.06)U/mL)的活性, 表明细菌会产生更多SOD以抵抗超氧阴离子. 由细菌存活曲线可见, 细菌数量不断减少, 而SOD和CAT的活性则呈相反趋势. 表明存活的肠杆菌Ec7256对冻融胁迫的耐受性随冻融频次的增加而增加. 综上可见, SOD和CAT活性的变化与大肠杆菌的生存模式和能力密切相关. 2.4.2 冻融循环下表面结构的变化 pKa是水溶液中具有一定解离度的溶质的极性参数, 可反映细菌表面的官能团类型和浓度[37]. CSH是非极性溶液(溶质)在极性水中呈现的“不稳定”状态, 由此引伸出一系列热能(熵)和分子重新分布及排列的变化. CSH值的高低通常可反映细菌团聚潜力的强弱. 由如图5(C),(D)可见, 在FT组和NFT组中的pKa值随冻融循环频次变化均无显著变化, pKa=6.5~7.5, 表明冻融循环未改变细菌表面官能团. 该范围的pKa值对应的基团主要是磷酸基, 是细胞表面重要的组成部分. NFT组中CSH 值随频次无显著变化. FT组高于NFT组的CSH值, 在FT组中CSH随冻融循环频次的增加而显著增加(P<0.05). 这主要是因为肠杆菌是一种典型的革兰氏阴性菌, 其细胞壁的外层从外向内由O-多糖、 核心寡糖和脂质A组成的脂多糖组成, 因此脂多糖的外表面和内表面分别是亲水和疏水的[38-39]. 冻融损伤后, 游离的脂多糖分子会从破碎的细菌细胞中释放到水溶液中, 亲水性的O-多糖与完整的细菌细胞表面结合, 疏水性的脂质A暴露于环境中. 同时, 脂质A与核心寡糖的联系可能被打破, 脂质A直接暴露于外界环境中. 随着冻融循环频次的增加, 可能会出现更多的上述过程, 进而引起CSH增加. 细菌团聚是细菌抵抗环境胁迫的一种重要机制[40]. 细菌团聚与细菌表面结构和官能团有关, 细菌表面疏水性有利于细菌团聚. 因此可推测, 肠杆菌Ec7256对冻融胁迫耐受性随冻融频次的增加而增加可能与CSH的变化有关. 综上所述, 本文揭示了冻融循环下常见肠杆菌在河水中的存活规律及主要影响因素. 1) 冻融循环会改变河水中Ec10538,sd-51和Ec72563肠杆菌的存活规律, 导致Ec10538,sd-51和Ec7256存活数量下降, 并随冻融循环频次的增加而降低; 2) 冻融条件下, 3株肠杆菌的存活能力与其对冻融胁迫的耐受性有关, 并受河水性质影响, 其中河水中pH值、 EC和TOC是抑制肠杆菌存活的主要因素; 3) 冻融循环增加了肠杆菌SOD,CAT活性和CSH值. 肠杆菌增强的抗氧化酶活性和细菌细胞的团聚是肠杆菌耐受冻融胁迫的重要机理.2 结果与讨论

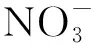
2.2 肠杆菌的存活
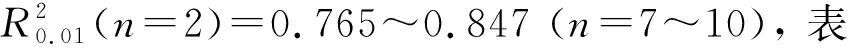

2.3 肠杆菌存活与河水性质间的关系
3 结 论
